T1~2期伴1~3个腋窝淋巴结转移术后未行放射治疗乳腺癌患者的局部复发风险及生存分析
2019-08-16娄立平史振东刘晶晶杨晓楠张瑾
娄立平,史振东,刘晶晶,杨晓楠,张瑾
乳腺癌是目前女性发病率最高的癌症,2018年居美国女性肿瘤的首位,居女性癌症死亡的第2位[1]。而乳腺癌在我国也已成为女性发病率第一的恶性肿瘤,每年新发病例约26.9万[2]。放射治疗是乳腺癌患者的重要辅助治疗方法,对于局部区域复发高危的患者,根据目前相关指南或共识建议,肿瘤直径>5 cm和阳性腋窝淋巴结(axillary lymph nodes,ALNs)≥4枚的患者应接受术后放射治疗(postmastectomy radiotherapy,PMRT)。然而,在1~3个阳性ALNs的早期乳腺癌患者中PMRT的使用存在一些争议。既往回顾性分析显示,对于1~3个ALNs阳性乳腺癌切除术后接受辅助全身治疗而无PMRT患者的10年局部复发率(LRR)相对较低,为6%~10%,某些亚组患者可能会受益于PMRT[3]。早期乳腺癌临床试验协作组(EBCTCG)荟萃分析结果也显示,即使接受了全身治疗,PMRT仍能降低局部区域复发和乳腺癌相关死亡[4]。然而,最近有两项重要的研究表明,1~3个ALNs阳性患者接受区域淋巴结放疗后生存获益不明显[5-6]。而2016年美国临床肿瘤学会也强烈建议将PMRT用于T1~2期伴1~3个阳性ALNs的原发性乳腺癌患者[7]。乳腺癌是一种高度异质性的肿瘤,分子分型不仅反映了肿瘤细胞的内在本质,还可以提供更多的预后信息以促进治疗决策。本研究旨在通过将分子分型与临床病理特征相结合分析,为进一步完善PMRT的个体化适应证提供参考。
1 资料与方法
1.1 一般资料 收集2009年1月—2012年12月我院接受手术治疗的乳腺癌患者。纳入标准:(1)单侧接受根治性乳房切除术的女性患者。(2)术前未行新辅助化疗或其他抗肿瘤治疗。(3)术后未行辅助放疗。(4)根据2016年美国癌症联合委员会(American Joint Committee on Cancer,AJCC)乳腺癌分期标准,术后病理分期为伴1~3个淋巴结转移的pT1-2N1M0期。(5)病理资料和治疗资料完整。(6)既往无恶性肿瘤病史。排除标准:(1)4个及以上阳性ALNs。(2)术后病理免疫组化提示人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER-2)阳性的患者(并非所有HER-2阳性患者均行规范靶向治疗,因此将此类患者排除)。(3)行术后辅助放疗的患者。
1.2 临床和病理特征 共有489例患者纳入了研究,所有患者均接受完整规范辅助化疗,化疗方案以蒽环类和紫杉类为主,其中425例术后病理示激素受体[雌激素受体(ER)/孕激素受体(PR)]阳性患者均接受5年辅助内分泌治疗,临床病理特征见表1,诊断时患者年龄27~89岁,中位年龄52岁。50例患者接受了标准根治术(Halsted术式),439例患者接受了改良根治术。肿瘤病理类型包括浸润性导管癌472例,浸润性小叶癌10例,髓样癌5例,黏液癌2例。
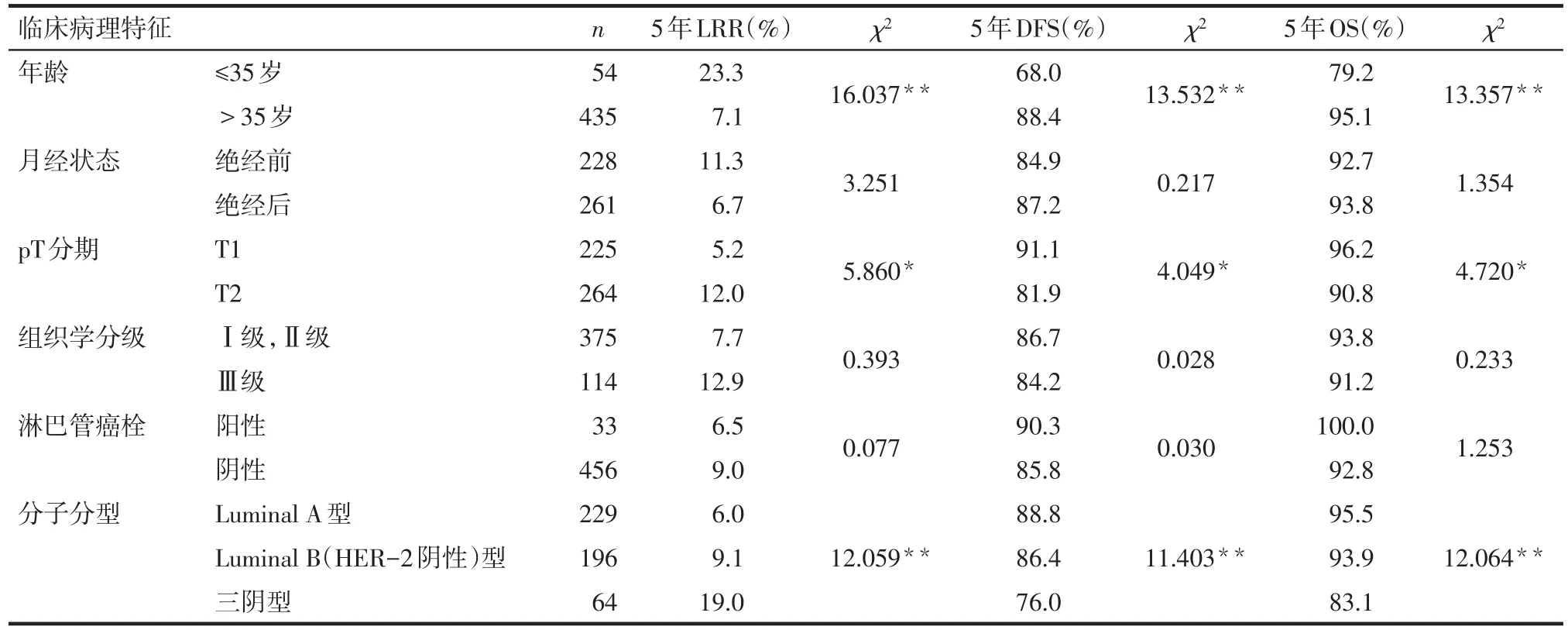
Tab.1 Comparison of 5-year local recurrence rate,disease-free survival rate and overall survival rate between patients with different clinicopathological features表1 不同临床病理特征患者5年局部复发率、无病生存率及总生存率的比较
1.3 乳腺癌分子分型方法 按照2017年中国抗癌协会乳腺癌诊治指南与规范[8]确定的分类方法,患者被分为3种亚型,主要基于其原发肿瘤的免疫组化(IHC)指标:Luminal A型(ER/PR阳性,HER-2阴性,Ki-67<20%);Luminal B(HER-2阴性)型(ER/PR阳性,HER-2阴性,Ki-67≥20%);三阴型(ER和PR阴性,HER-2阴性)。
1.4 随访 患者术后5年内每半年复查1次,5年后每1年复查1次。复查内容包括乳腺钼靶、B超、CT、全身骨显像(ECT)等。通过电话、查阅病历等方式进行随访,随访时间截至2018年6月。主要观察终点是LRR,次要观察终点是无病生存率(DFS)和总生存率(OS)。局部复发定义为无论是否存在远处转移灶,出现术区同侧胸壁或同侧区域淋巴结内的任何复发,包括腋窝,锁骨上下和内乳淋巴结复发。无病生存时间定义为从手术日期至发现复发转移的时间。总生存时间定义为从手术日期到乳腺癌死亡或最后1次随访。
1.5 统计学方法 使用SPSS 25.0软件进行统计分析。单因素生存分析采用Kaplan-Meier法,采用Log-rank检验比较组间生存率。3种分子分型患者间基线特征的分布及组间生存率的比较采用χ2检验。多因素分析采用Cox比例风险模型。双侧P<0.05为差异有统计学意义。
2 结果
2.1 不同分子分型患者的临床病理特征分布情况 Luminal A型229例(46.8%),Luminal B(HER-2阴性)型196例(40.1%),三阴型64例(13.1%)。与Luminal A型相比,Luminal B(HER-2阴性)型和三阴型组织学Ⅲ级的比例更高(Ρ<0.01),除组织学分级外各分子分型之间在临床病理特征方面基线均衡可比(P>0.05),见表2。
2.2 局部复发和生存情况 全组患者随访5~115个月,中位随访时间为75个月,患者总体5年、10年LRR分别为8.9%和13.4%;5年、10年DFS分别为86.1%和76.5%;5年、10年OS分别为93.3%和86.8%。所有患者中共有40例死亡,92例发生复发和转移的患者中,52例发生局部复发时伴有远处转移。此外,11例患者在≥2处发生复发。局部复发部位如下:胸壁20例,锁骨上区26例,腋窝11例,内乳区6例。52例复发患者中Luminal A型18例,Luminal B(HER-2阴性)型21例和三阴型13例。
2.3 Kaplan-Meier法单因素生存分析 结果显示不同年龄、pT分期、分子分型分组的未行PMRT早期乳腺癌患者的5年LRR、DFS和OS比较差异有统计学意义(P<0.05或P<0.01),见表1。
2.4 基于分子分型的分层生存分析 对未接受PMRT的489例患者按照分子亚型进行分层分析显示,Luminal A型和Luminal B(HER-2阴性)型之间5年LRR、DFS和OS差异均无统计学意义(χ2分别为1.027、0.344、0.349,均P>0.05);三阴型5年LRR高于Luminal A 型和 Luminal B型(χ2分别为 7.963、4.222,均P<0.05),5年DFS低于Luminal A型和Luminal B型(χ2分别为6.652、4.229,均P<0.05),5年OS低于Luminal A型和Luminal B型(χ2分别为9.968、6.515,均P<0.05),差异有统计学意义,见图1。由于Luminal A型和Luminal B(HER-2阴性)型各指标间无差异,将两者合并为非三阴型,进一步对分子分型进行亚组分析显示,三阴型5年LRR高于非三阴型(19.0%vs.7.4%,χ2=7.955,P<0.01),5年DFS和5年OS均低于非三阴型(DFS:76.0%vs.87.7%,χ2=6.576,P<0.05;OS:83.1%vs.94.7%,χ2=10.693,P<0.01),差异有统计学意义。
2.5 多因素Cox回归分析 以局部复发(有局部复发=1,无局部复发=0)、无病生存(有复发转移=1,无复发转移=0)、总生存(死亡=1,生存=0)为因变量,年龄(≤35岁=1,>35岁=0)、pT分期(T2=1,T1=0)、分子分型[Luminal A型=0,Luminal B(HER-2阴性)型=1,三阴型=2]为自变量进行多因素Cox回归分析,结果表明,年龄≤35岁、pT2分期和三阴型是影响LRR的独立不良预后因素。年龄≤35岁和三阴型是影响DFS和OS的独立不良预后因素,见表3。
3 讨论
对于乳腺癌根治术后是否所有的T1~2N1M0期患者均需要放疗目前尚存争议,且不同时间段的不同研究报道的LRR具有一定的差异[9-10]。McBride等[3]分析了MD Anderson癌症中心的数据表明接受乳房切除术和全身治疗的乳腺癌患者发生局部复发的风险与治疗的年代高度相关,近年来可能由于大多数乳腺癌切除术后患者采用现代辅助全身治疗从而使得未行PMRT患者的LRR明显降低。随着近年来全身治疗的不断规范和进步,乳腺癌术后患者的10年LRR已由上世纪80年代的12%~30%降低到目前的5%~10%,因此,在特定的人群中放疗带来的长期生存获益可能减少。那么,随着患者LRR逐渐降低,PMRT可能不会使所有1~3个ALNs阳性患者受益。同时由于pT1~2N1M0期乳腺癌患者存在异质性,部分低危患者的局部区域复发率<10%,这部分患者行PMRT的长期获益很低,可能不需要放疗。

Tab.2 Distribution of clinicopathologic characteristics in patients with different molecular subtypes表2 不同分子分型患者的临床病理特征分布 例(%)

Fig.1 Survival curves of patients with different molecular subtypes图1 不同分子分型患者的生存曲线
既往有研究报道分子分型可预测乳腺癌的复发和存活率[11-13]。不同分子分型乳腺癌的生物特性不同,预后也存在差异。有很多研究报道了单个分子标志物(ER,PR,HER-2和Ki-67等)评估预后的价值,但结果大都不一致,因此单个分子标志物可能无法准确反映肿瘤之间的内在生物学差异[14]。Moo等[15]开展的一项针对1~3个ALNs阳性的T1~2乳腺癌患者的大型队列研究显示分子分型与LRR无关,但与无局部复发生存率(LRFS)和OS相关,因此得出结论,分子分型不是LRR的独立预测因子,无法预测可受益于PMRT的患者。但Wen等[16]的研究表明分子分型与5年LRR和5年LRFS有关,分子分型可用来预测局部复发风险。因此1~3个腋窝淋巴结阳性的早期乳腺癌患者的分子分型与LRR及预后的关系值得讨论。在Lai等[13]的报道中,三阴型乳腺癌患者的LRR更高。而在本研究中发现三阴型乳腺癌的5年LRR更高,三阴型乳腺癌的局部复发风险比LuminalA型高2.97倍,因此分子分型有助于个体化区别1~3个腋窝淋巴结转移的早期乳腺癌患者的局部复发风险。笔者建议对局部复发风险较高的三阴型乳腺癌术后行PMRT以减少局部复发风险改善预后,但三阴型乳腺癌仍是一个挑战,并且需要进一步研究以确定有助于改善该亚组患者生存结局的机制。

Tab.3 Multivariate Cox regression analysis of factors affecting local recurrence,disease-free survival and overall survival of patients表3 影响患者局部复发、无病生存及总生存的多因素Cox回归分析
关于局部复发危险因素,本研究还发现年龄≤35岁及pT2期是影响LRR的独立危险因素。既往的研究发现年轻患者比老年患者复发的风险更高,年轻患者的高复发风险可能与肿瘤更具侵袭性,分化程度更差,S期细胞比例较高,淋巴血管侵犯的风险更高,ER阴性比例更高等有关[17]。Wen等[16]发现,≤35岁的乳腺癌患者的LRR风险比>35岁患者高。Yin等[18]报道,年龄<40岁与无PMRT的T1~2N1期患者的LRR风险较高有关。李明等[19]发现T2期乳腺癌患者的10年LRR高于T1期患者。这与本研究结果相一致。
本研究是一项回顾性分析,具有一定的局限性,可能存在选择偏倚,本研究的中位随访时间较短,尽管大多数局部复发事件发生在治疗后的前5年内,仍需要进一步扩大样本量和延长随访时间,这些因素可能在一定程度上也影响了结果,本研究结果仍将有助于确定可能受益于PMRT的N1早期高风险乳腺癌患者。
总之,使用分子分型有助于个体化区别1~3个腋窝淋巴结转移的pT1~2N1M0乳腺癌患者的局部复发风险。年龄≤35岁、pT2分期及三阴型乳腺癌是影响1~3个ALNs转移术后未行PMRT的早期乳腺癌患者LRR独立不良预后因素,因此建议对年龄≤35岁、pT2分期及三阴型乳腺癌患者行PMRT,从而降低局部复发风险并改善预后,以实现个体化、精准化的治疗。
