重组猪α干扰素的活性测定
2019-08-14鲍恩东
赵 莉 赵 帅 柯 浩 鲍恩东
(1.瑞普(天津)动物药业有限公司,天津 300300;2.南京农业大学,江苏南京 210095;3.丹阳市农业委员会,江苏丹阳 212300)
干扰素(Interferon,IFN)是在特定的抗原刺激下由细胞分泌的一类具有抗病毒、抗肿瘤和免疫调节功能等生物活性的糖蛋白,是发现最早,研究最多的细胞因子。根据IFN的细胞来源和结合受体不同,将IFN分为Ⅰ型和Ⅱ型。Ⅰ型IFN主要有α、β两个亚型,分别主要由淋巴细胞和成纤维细胞产生,它们作用于同一受体,可抑制病毒DNA复制和蛋白质合成,活化NK细胞,促进MHCⅠ类分子提呈抗原。Ⅱ型IFN为γ-干扰素,主要由T细胞和NK细胞产生[1]。猪α干扰素全基因为570bp,编码189个氨基酸,其中前23个Aa为信号肽,后166个Aa为成熟活性蛋白。国内外研究表明,PoIFN-α在抑制猪流行性腹泻病毒,蓝耳病病毒和非洲猪瘟病毒的试验中均取得了良好效果[2]。
目前,猪干扰素的来源有2种:提取猪血液中的白细胞诱导产生的白细胞干扰素和通过基因工程的方法发酵表达。从猪血液提取的白细胞干扰素是一种多种成份混合物,其抗病毒效价较低、生产成本高,而且存在潜在病原污染的问题;目前人类临床上应用的干扰素全部是通过基因工程的方法生产的,其产品活性高、质量标准容易控制。随着生物工程技术的迅猛发展,应用基因工程方法进行微生物发酵生产猪干扰素的生产成本大大降低,可以应用到养猪业,具有良好的应用前景。为此,本研究旨在探索重组毕赤酵母表达的重组猪α干扰素的体内外抗病毒活性,从而为猪病防治提供有效手段,减少病毒疾病的爆发给养猪业带来的巨大损失。
1 材料和方法
1.1 材料
重组猪α干扰素(rPoIFN-α)冻干制品,由瑞普(天津)动物药业有限公司制备;MDBK细胞由中国农科院哈尔滨兽医研究所人畜共患病实验室保存;DMEM培养基购于Invitrogen公司;表达绿色荧光蛋白报告基因的重组水疱性口炎病毒VSV *GFP由中国农科院哈尔滨兽医研究所人畜共患病实验室构建、滴定并保存。
1.2 重组猪α干扰素抗病毒活性测定
1.2.1 待检测样品的准备
在重组猪α干扰素冻干制品中加入1ml DMEM,彻底溶解后,吸取100μl至900μl DMEM中,再依次进行10倍梯度稀释直至10-8,待用。
1.2.2 细胞制备
将细胞培养瓶中生长状态良好的MDBK细胞用0.25%胰酶消化后,用含5%胎牛血清的DMEM(不含双抗)将细胞密度调整为2×105个细胞/ml,待用。
1.2.3 抗病毒活性测定
采用VSV*GFP-MDBK细胞系统,细胞病变抑制法测定重组猪α干扰素抗病毒活性。先在96孔板中加入10倍梯度稀释的重组猪α干扰素样品,每孔100μl,再将稀释好的MDBK细胞铺于 96孔板,每孔100μl,37℃温箱放置24 h后,每孔加入100μl(3×104PFU)VSV*GFP感染MDBK细胞,1h后换DMEM完全培养液,37℃温箱放置17 h后,置荧光显微镜下观察结果,并以Microplate Fluorescence Reader FLx 800(BIO-TEKINSTRUMENTS.INC)读取荧光数量。以能抑制50%细胞病变(即不加重组猪α干扰素的对照孔荧光数量的一半)的重组猪α干扰素最高稀释度定义为1个单位(IU)。另设不加重组猪α干扰素孔为空白对照[3]。
2 结果
2.1 荧光显微镜观察结果
利用VSV*GFP-MDBK细胞病变抑制法测定重组猪α干扰素抗病毒活性。以不同浓度重组猪α干扰素作用MDBK细胞24h后,感染VSV*GFP,17h后荧光显微镜观察结果。1×104倍稀释的重组猪α干扰素可以完全抑制VSV*GFP在MDBK细胞上的复制,荧光信号呈阴性(图1-A),1×105和1×106倍稀释的重组猪α干扰素可部分抑制VSV*GFP的复制(图1-B,1-C),未加重组猪α干扰素空白对照孔出现大量荧光(图1-D)。定义荧光亮度为空白对照孔50%的最高稀释度为一个单位,故重组猪α干扰素活性为1×105IU/0.1ml。
2.2 以Microplate Fluorescence Reader FLx 800读取荧光蛋白GFP荧光数量
空白对照孔的荧光数量均值为1600,则CPE50为800;重组猪α干扰素样品检测孔荧光数量均值:105倍稀释孔为620,106倍稀释孔为1522;则按照Reed-Muench法计算如下:
距离比例=(800-620)/(1522-620)=0.2lgCPE50=-5+0.2×(-1)=-5.2,则重组猪α干扰素样品CPE50=10-5.2IU/0.1ml。即将该干扰素样品作105.2稀释后,0.1ml即能抑制50%病毒对细胞的感染作用。定义荧光亮度为空白对照孔50%的最高稀释度为一个单位,则重组猪α干扰素样品的活性单位为1×105.2IU/0.1ml。
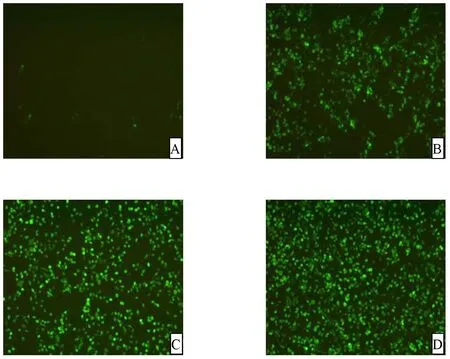
图1 利用VSV*GFP-MDBK系统测定rPoIFN-α抗病毒活性
3 讨论
α-干扰素具有较强的抗病毒、抗肿瘤和免疫调节等生物学活性,人α-干扰素在临床疾病的防治中早有应用,动物α-干扰素作为抗病毒生物制剂或疫苗佐剂也具有较好的应用前景,许多国家已经将动物细胞因子的开发利用作为研究重点。α-干扰素基因在正常情况下处于抑制状态,只有在某些刺激因子的刺激下才能表达,产量低、纯化困难、成本比较高,难以大量制备,随着基因工程技术的迅速发展,可以利用该技术大量制备α-干扰素。
传统的干扰素抗病毒活性是利用细胞病变抑制法测定,通过噬斑的数量而确定其活性单位,本研究采用的重组VSV*GFP可以在宿主细胞内复制,并表达绿色荧光蛋白,通过观察荧光强度和数量,即可确定其感染和复制情况。因此使用VSV*GFP作为攻击病毒,在MDBK细胞上测定重组猪α干扰素抗病毒活性时,采用测定荧光强度或数量代替传统的噬斑数量计数而确定其活性单位,使得干扰素抗病毒活性的测定更加准确和简便。
