不同生态型拟南芥耐铵毒害差异的生理机制
2019-08-14韩庆芬陈海飞张振华
韩庆芬,陈海飞,张振华
(湖南农业大学资源环境学院/南方粮油作物协同创新中心,湖南长沙 410128)
氮是植物体内重要化合物氨基酸、蛋白质、核酸等的重要组成元素。随着人类对粮食需求的剧增,农民普遍大量使用氮肥[1]。另外,铵态氮的大量施用导致水体以及大气铵浓度不断增加,通过灌溉进入土壤,大气中的铵沉降再进入水体和土壤,造成植物铵毒害以及环境污染。研究指出全世界土壤中的铵态氮浓度在2~10 mmol/L范围内变化[2],引发了生态环境危机,如森林退化、藻类灭绝、生物多样性降低,甚至更为严重的生态危机。有报道认为自然界中植物生物多样性的锐减甚至部分物种的灭绝与大气铵沉降有关[3-7]。另外在南方长期的稻油轮作体系下由于低pH以及土壤渍水造成油菜铵毒害,氮素利用效率下降等农业生产问题[8]。植物对氮的响应取决于其基因型和外界环境条件,外界环境包括氮的形态、氮的浓度等[9-10],研究表明高氮反而降低作物的氮素利用效率,低氮提高作物的氮素利用效率,另外拟南芥等十字花科作物对铵较敏感,因此本文采用1 mmol/L硫酸铵处理95份拟南芥生态型群体,依据其对环境的适应性差异以及氮素利用效率的不同,来研究其在耐铵毒害机制方面的差异。
铵毒害主要症状是抑制地上部生长、胞质pH紊乱、光合作用下降、碳水化合物缺乏、碳氮代谢失衡、氮代谢缺少碳骨架,从而造成铵毒害。水培试验研究发现番茄铵毒害与光合能力下降有关,但是也有不同观点[11-12]。铵离子导致介质或者体内pH平衡被破坏[13-15],但是很多情况下毒害也会在pH缓冲体系中产生[16]。碳水化合物的缺乏可能是氨毒害产生的原因,因为铵离子的同化必须在根部进行,造成了局部碳缺乏,但是外源添加碳源仅仅能够减轻部分植物的毒害症状[17]。阳离子不平衡也被认为是氨毒害产生的原因之一,长期处于铵离子条件下,植物组织中的一些重要离子,如K+、Ca2+和Mg2+等会减少[18-20],但是这可能是一种长期的营养不平衡导致的。还有研究表明铵毒害是由于无效的NH4+/NH3跨膜导致的能量损耗,铵在进入根系过程中会有很大一部分又跨膜排出,这种无效的铵转运造成了能量消耗[20-21]。Li等研究发现铵毒害使拟南芥地上部产生大量乙烯,导致衰老[23],但是这些都是铵毒害发生后的一些表型。除此之外,研究人员通过筛选铵敏感相关突变体,利用遗传突变体来剖析植物铵耐性机制,并发现了一些与植物铵敏感相关的基因[22-25],但是这些基因都位于氨毒害下游,不能从根本上解释植物铵累积的发生机制。油菜和拟南芥同属十字花科植物,在长期铵毒下其地上部铵大量累积,并且拟南芥与油菜GS1同源基因较多,各有5个基因亚族[26-27]。因此本文通过研究拟南芥生理指标以及各指标间相关性分析,筛选极端材料解析氨毒害的发生机制,为后续挖掘耐性基因提供生理基础,并为稻田油菜耐铵毒害的遗传改良提供理论指导。
1 材料与方法
1.1 试验材料
试验所用植物材料为95份不同生态型拟南芥[28]。
1.2 植物培养条件
试验所用拟南芥种子经75%乙醇灭菌15 min,无菌水清洗三次,放置4℃冰箱浸种四天,播于蛭石、珍珠岩 (3∶1) 混合而成的土中。移苗前,80℃的烘箱中烘人工土两小时,用正常水培营养液浸湿,保鲜膜密封,于温室培养三天后揭掉保鲜膜,7天后移苗至水培,挑选长势一致的壮苗,用海绵包裹植株根部,移栽至55 cm × 37 cm × 8 cm的水培盒中,每盆104株,盆外围用黑色胶带包裹以避光,约4天换一次植物培养液。正常水培培养液成分为:1 mmol/L KNO3、0.625 mmol/L KH2PO4、0.5 mmol/L MgSO4、0.5 mmol/L Ca(NO3)2、0.025 mmol/L Fe-Na2-EDTA、70 mmol/L H3BO3、14 mmol/L MnCl2、1 mmol/L ZnSO4;0.2 mmol/L NaMoO4、10 mmol/L NaCl、0.01 mmol/L CoCl2、0.5 mmol/L CuSO4以及2.5 mmol/L MES (用来缓冲营养液pH),pH用KOH调至5.8左右。正常水培营养液中含2 mmol/L硝态氮。
温室培养条件:相对湿度保持在70%左右,温度控制 22~24℃,光强 80~200 μmol/(m2·s),光照周期为16 h/8 h (长日照)。
1.3 试验处理
移苗后培养8天后,一半的拟南芥幼苗继续在原营养液中 (硝态氮处理) 培养,一半进行铵态氮处理。采用含1 mmol/L硫酸铵处理的营养液进行培养,其成分为:1 mmol/L (NH4)2SO4、0.625 mmol/L KH2PO4、0.5 mmol/L CaCl2、1 mmol/L KCl、0.5 mmol/L MgSO4、0.025 mmol/L Fe-Na2-EDTA、70 mmol/L H3BO3、14 mmol/L MnCl2、1 mmol/L ZnSO4、0.2 mmol/L NaMoO4、10 mmol/L NaCl、0.01 mmol/L CoCl2、0.5 mmol/L CuSO4。此液中含2 mmol/L 铵态氮。培养3天时,取样分析植株根部铵态氮转运蛋白基因表达量;处理8天后取样分析植株全氮量,地上部游离铵含量,以及谷氨酰胺合成酶活性;各试验处理设置4次生物学重复。
1.4 测定项目与方法
1.4.1 游离铵含量的测定采用靛酚蓝比色法测定[29]
取铵处理8天的拟南芥幼苗地上部,用蒸馏水冲洗3~4次,用滤纸擦干表面水分,称重后装入5 mL离心管,放入液氮冷冻一小会儿于组织研磨仪上打碎,用5 mL 0.1%稀盐酸提取半小时,过滤后吸取上清液200 μL用0.1%稀盐酸稀释至4 mL,依次加入0.5 mL苯酚溶液 (苯酚5 g、亚硝基铁氰化钠50 mg定容至500 mL) 和次氯酸钠碱性溶液 (氢氧化钠5 g,磷酸氢二钠3.53 g,磷酸钠15.9 g,量取次氯酸钠[ω(NaClO)=5.25%,即含有效氯5%的漂白剂溶液]溶液5 mL,溶解后转移至500 mL容量瓶后定容),摇匀后37℃水浴30分钟,在625 nm波长处进行比色。
1.4.2 谷氨酰胺合成酶 (GS) 活性的测定 铵处理8天后,植株地上地下部分开取样,剪碎入提前置于低温冰箱冰冻30 min的研钵中,置于冰浴中加少量石英砂及Tris-HCl缓冲液3 mL,研磨匀浆,置于4℃、10000 r/min下离心10 min,上清液即为粗酶提取液。反应液的组成如下:0.6 mL咪唑-盐酸缓冲液(0.25 mol/L,pH 7.0),0.4 mL 0.3 mol/L谷氨酸钠,0.4 mL 0.3 mmol/L ATP二钠盐溶液,0.2 mL 0.5 mol/L MgSO4,1.2 mL酶液。反应液在25℃水溶液中保温5分钟,加入0.2 mL羟胺试剂,以开始反应,在25℃水浴中再保温15 min,加入1 mL FeCl3试剂终止反应。混合液在10000 r/min下离心10 min,上清液在540 nm处测定吸光度,空白加酶液前加入FeCl3试剂[30]。
1.4.3 植株全氮 采用H2SO4-H2O2消煮法及连续流动分析仪AA3测定[31]。铵处理8天后整株取样装在小信封袋内于105℃杀青半小时后65℃烘干至恒重,采用千分之一天平称重后装于150 mL细口三角瓶,用H2SO4-H2O2消煮至透明清亮,转移至50 mL容量瓶中,定容、过滤后用连续流动分析仪AA3进行分析 (Autoanalyzer 3,SEAL,Germany)。
1.4.4 RT-PCR 铵处理3天后取根部于液氮中,总RNA提取用TRIzol(Invitrogen,美国),用等体积的异丙醇沉淀,用75%乙醇洗涤,并溶于不含RNase的水中。cDNAs合成采用PrimeScriptTMRT Kit with gDNA Eraser (Perfect Real Time,TAKARA日本) 试剂盒,操作步骤依照试剂盒的操作说明进行。使用SYBR Premix Ex-Taq(TAKARA) 试剂和Applied BiosystemsStepOneTM仪器进行RT-qPCR。
采用表1的目标基因和参考基因的引物序列进行qPCR扩增,测定AtAMT1;1和AtAMT1;2的相对表达量。
1.4.515N示踪分析 为了测定1 mmol/L硫酸铵处理下铵的吸收,拟南芥幼苗移苗后在正常培养液中培养8天,进行15N标记。将根部置于1 mmol/L CaSO4中冲洗1 min,然后转移至1 mmol/L丰度为5%的 (15NH4)2SO4中培养,分别在处理3 h、6 h和24 h取样,取样前将根部置于1 mmol/L CaSO4中冲洗1 min,取地上部于80℃烘干至恒重,用组织研磨仪打碎至粉末状,称2 mg用于同位素分析[32]。
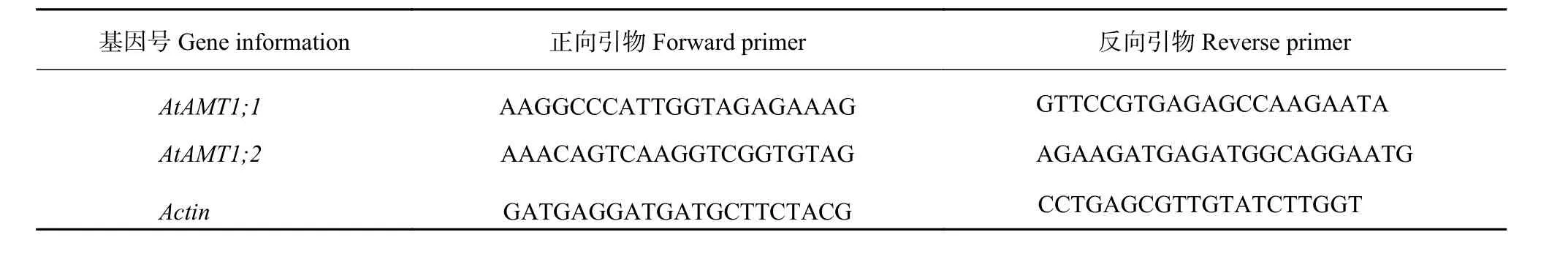
表1 拟南芥qRT-PCR引物序列表Table 1 Sequences of qRT-PCR primer for Arabidopsis thaliana
1.5 数据分析与处理
试验所得数据用Microsoft Excel 2010软件计算并作图,用DPS 7.05和IBM SPSS_Statistics软件统计分析。
2 结果与分析
2.1 硝态氮和铵态氮条件下不同生态型拟南芥中游离铵含量差异分析
经过2 mmol/L铵态氮处理8天后,除了Tscha-1低于对照,ukID48与对照相比无差异,各生态型拟南芥铵含量显著高于对照2 mmol/L硝态氮处理 (图1)。其中,uk-2硝态氮处理下铵含量为2.17 μmol/g,铵态氮处理下铵含量为3.21 μmol/g,是对照的1.5倍;1187-G7硝态氮处理下铵含量为1.8 μmol/g,铵态氮处理下铵含量为 18.18 μmol/g;Si-0、fab-4、Ba-0、Dralv1-f铵态氮下铵含量是硝态氮下的10倍以上,这表明铵态氮条件下不同生态型拟南芥体内铵大量累积。
2.2 拟南芥群体游离铵含量与铵耐受性间的相关性
为了研究95种不同生态型拟南芥群体在长期低铵环境下的耐受性差异,分别测定了其在两种不同氮形态下地上部游离铵的含量,分析了其生长状况与游离铵含量的关系。在硝态氮和铵态氮条件下,地上部铵含量与其生物量呈对数函数关系,随着铵含量的增加其生物量递减(图2-a、b),说明地上部铵含量越高的生态型其氮素利用效率越低。由图2-b可见,大多数生态型都是铵依赖型的,说明铵含量越高,其耐铵性越差,部分是非铵依赖型的,其地上部铵含量都比较高,但有耐铵和不耐铵的生态型。因此,本文以拟南芥群体组织内游离铵的浓度为主因子,筛选出铵依赖生态型中的耐铵和铵敏感两组拟南芥生态型各三个,其中Or-1、Ta-0、HSM为耐铵型;Rak-2、Lpv-18、Hi-0为铵敏感型。
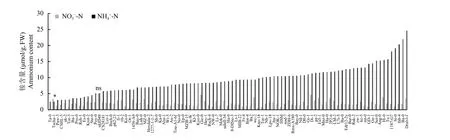
图1 2 mmol/L硝态氮和铵态氮条件下不同生态型拟南芥游离铵含量差异Fig. 1 Differences of ammonium contents in different ecotypes of Arabidopsis under 2 mmol/L NHN and NON conditions
2.3 不同生态型拟南芥对铵毒害的响应
已筛选拟南芥铵处理8天后,整株取样,如图3所示,耐铵拟南芥的单株生物量下降的比例显著低于铵敏感生态型。由于拟南芥根部生物量较小,因此只测定了地上部铵含量。图4表明在硝态氮下,耐铵生态型Or-1、Ta-0、HSM的铵含量分别为0.74、0.39、1.06 μmol/g,铵敏感生态型 Rak-2、Lpv-18、Hi-0的铵含量分别为1.76、2.59、3.98 μmol/g;在铵态氮下,耐铵生态型Or-1、Ta-0、HSM的铵含量分别为6.44、2.63、8.83 μmol/g,铵敏感生态型Rak-2、Lpv-18、Hi-0的铵含量分别为13.08、20.83、15.55 μmol/g。两种氮形态下耐铵型拟南芥地上部铵含量均显著低于铵敏感生态型,表明2 mmol/L铵态氮胁迫下,耐铵型生态型拟南芥长势更好,具有更高的氮素利用效率,铵毒害较轻。
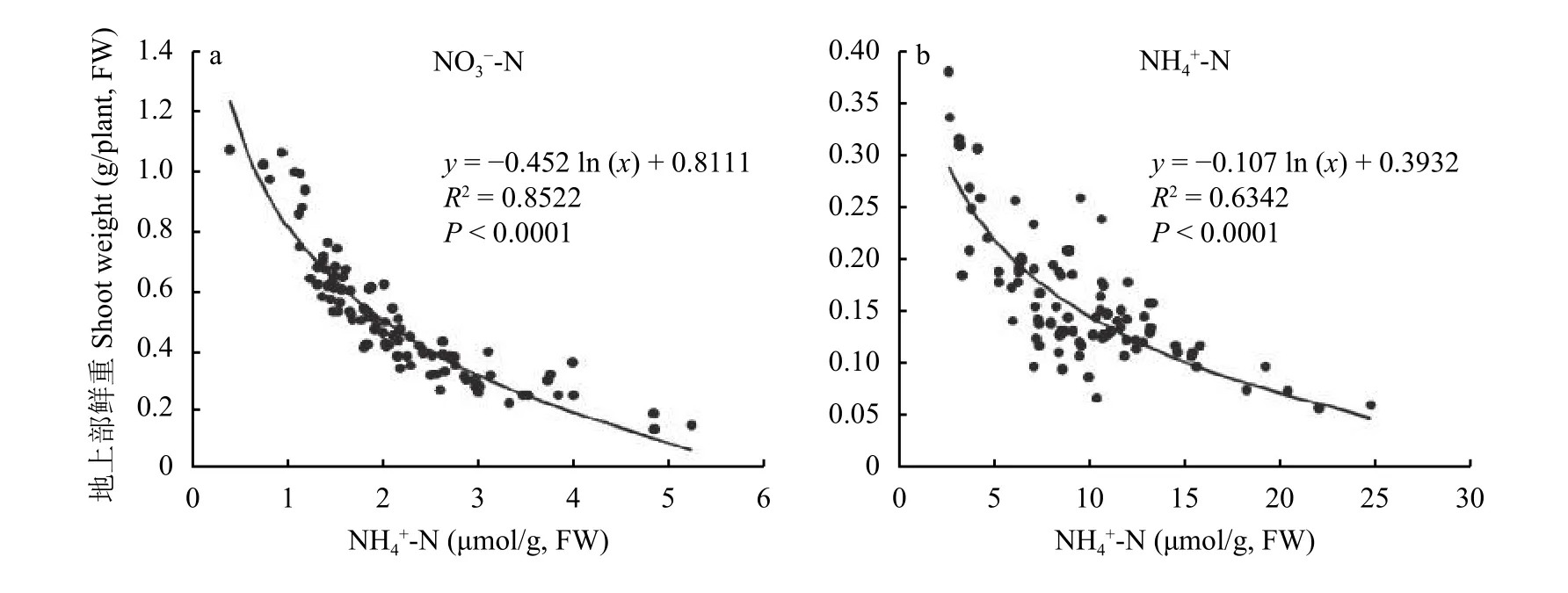
图2 铵态氮和硝态氮处理下拟南芥群体体内游离铵浓度与地上部生物量的关系Fig. 2 Correlation between shoot weight and free ammonium concentration in Arabidopsis population

图3 两组生态型拟南芥在硝态氮与铵态氮下总生物量下降的百分比Fig. 3 Percentage of reduction in total biomass of the tolerant and sensitive ecotypes of Arabidopsis under NOand NH treatments

图4 硝态氮和铵态氮处理拟南芥地上部铵含量Fig. 4 Ammonium contents in the shoot of Arabidopsis under NOand NH treatments
2.4 不同生态型拟南芥铵吸收差异分析
铵胁迫主要使拟南芥地上部发生毒害。由图5-a可知,耐铵生态型氮吸收总量显著高于铵敏感生态型。图5-b同位素示踪结果表明,处理3 h、6 h和24 h下耐铵生态型15N累积量均显著高于铵敏感生态型,结合图4地上部铵含量结果,说明耐铵能力强的品种,铵的同化能力较强,所以植株体内铵离子浓度较低。
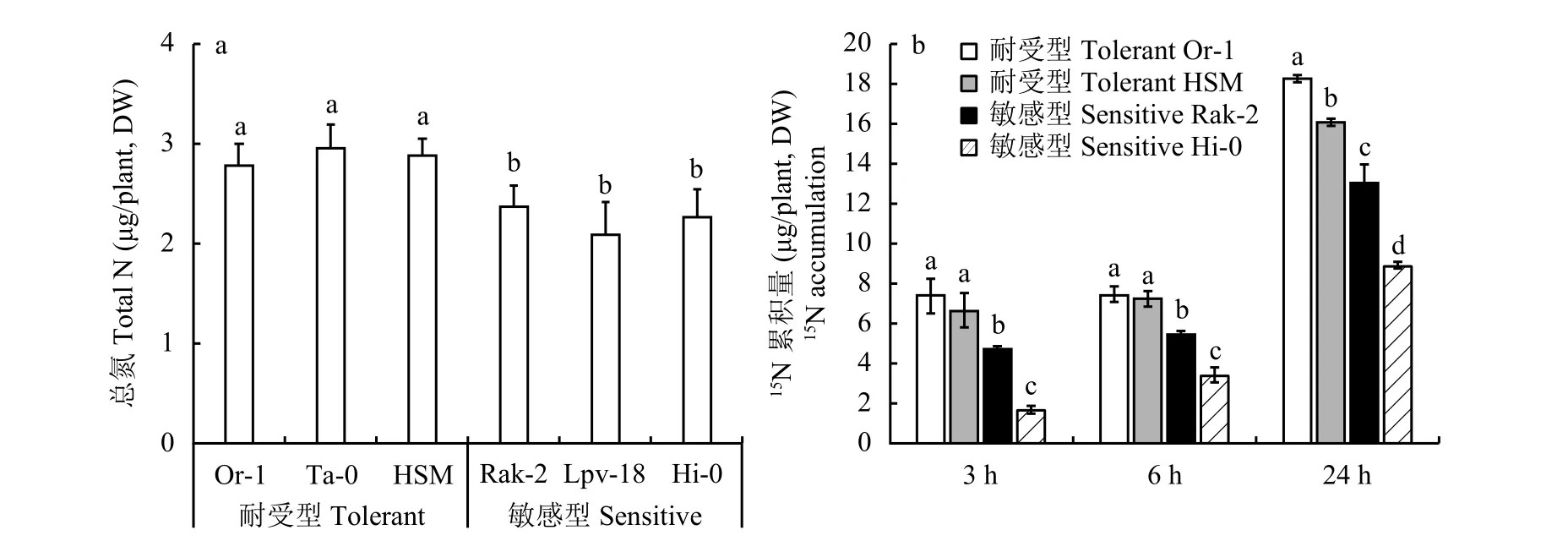
图5 拟南芥植株总氮吸收量及15NH4+-N不同处理时间下地上部15N累积量Fig. 5 Plant total N and 15N accumulation in shoots of Arabidopsis after different treating hours with 15NHN
图6结果表明,2 mmol/L铵态氮处理72 h后,耐铵型拟南芥根系铵转运蛋白基因AMT1;1和AMT1;2的表达水平显著高于铵敏感型,说明在低浓度铵胁迫下耐铵生态型拟南芥对铵的吸收能力更强,并且地上部的铵含量显著低于铵敏感型,所以才具有更高的氮素利用效率且受铵毒害较轻。
2.5 不同生态型拟南芥铵同化能力差异分析
谷氨酰胺合成酶 (GS) 的高低代表着铵态氮的同化能力。耐铵生态型Or-1、Ta-0、HSM在硝态氮下其地上部 GS 活性分别为 3.91、4.01 和 4.74 μg/(g∙h),铵敏感生态型Rak-2、Lpv-18、Hi-0 GS活性分别为3.41、2.65、3.03 μg/(g·h),硝态氮条件下耐铵生态型地上部GS活性显著高于铵敏感生态型 (图7-a)。耐铵生态型Or-1、Ta-0、HSM在铵态氮条件下其地上部 GS 活性分别为 6.45、6.18、5.97 μg/(g∙h),铵敏感生态型Rak-2、Lpv-18、Hi-0 GS活性分别为4.99、4.68、4.18 μg/(g∙h),耐铵生态型地上部 GS 活性同样显著高于铵敏感生态型 (图7-b)。在硝态氮下,耐铵生态型Or-1、Ta-0、HSM的根系GS活性依次为22.83、30.93、25.04 μg/(g∙h),铵敏感生态型 Rak-2、Lpv-18、Hi-0 GS活性分别为18.89、21.89、20.38 μg/(g∙h) (图7-c),在铵态氮下,耐铵生态型Or-1、Ta-0、HSM根系的GS活性分别为29.99、33.19、28.46 μg/(g∙h),铵敏感生态型 Rak-2、Lpv-18、Hi-0根系 GS 活性分别为 20.60、23.46、25.43 μg/(g∙h),(图7-d),耐铵型生态型根系GS活性在硝态氮和铵态氮条件下均显著高于铵敏感生态型。结合图4结果,耐铵生态型的铵含量显著低于敏感生态型,表明耐铵型生态型高效的同化速率降低了拟南芥体内的游离铵含量,从而缓解了铵毒害。
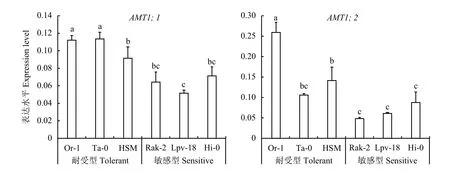
图6 不同生态型拟南芥铵转运基因的表达水平Fig. 6 Expression levels of ammonium transport genes in different ecotypes of Arabidopsis thaliana
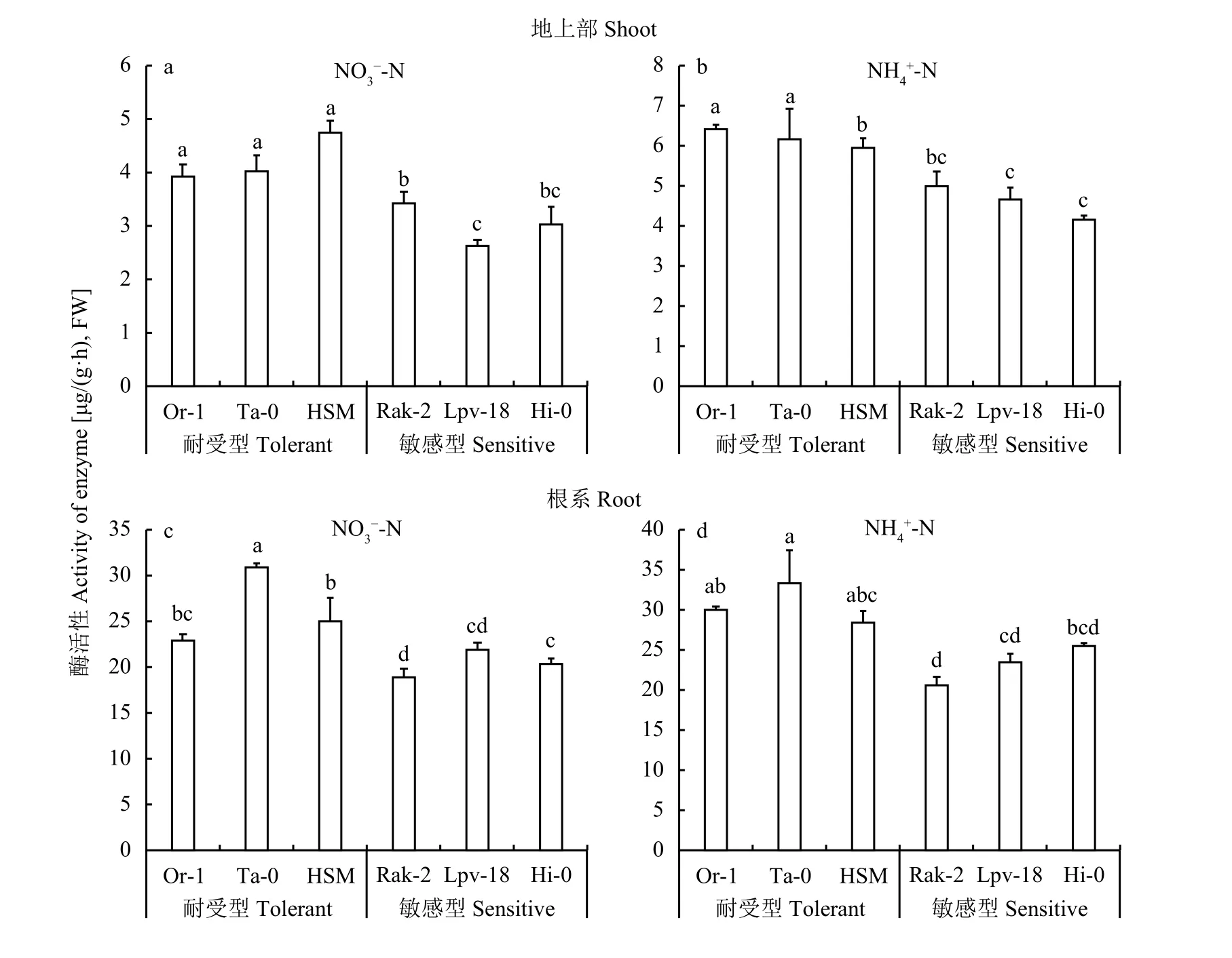
图7 铵态氮和硝态氮处理下铵耐受型和敏感型拟南芥谷氨酰胺合成酶 (GS) 活性Fig. 7 Glutamine synthetase activity in shoot and root of ammonium tolerant and sensitive ecotypes of Arabidopsis thaliana
3 讨论
植物对氮的响应由其基因型和外界环境因子决定,外界环境因子有氮的形态、氮的浓度等。研究表明高浓度氮反而降低氮素利用效率,因此培育一些低氮适应性且高效品种是非常重要的。目前对植物利用硝态氮的生理分子机制研究得较多,但是植物对铵态氮响应上游的机制并不太清楚,另外,植物体内氮的同化主要分为硝态氮和铵态氮同化,其中首先需要依次在细胞质和叶绿体或根中经过硝酸还原酶 (NR) 和亚硝酸还原酶(NiR) 还原为后,才能进一步经过的同化途径谷氨酰胺合成酶 (GS) 和谷氨酸合成酶 (GOGAT)途径同化[33-34]为植物体可利用的有机态氮,因此植物体内铵态氮的同化是植物氮同化中最为重要的。因此本文通过研究95份不同生态型拟南芥对2 mmol/L铵耐性差异的机制,从吸收代谢揭示耐铵生态型拟南芥主要是具有较强的铵吸收能力及同化能力,从而降低了拟南芥体内游离铵的含量,缓解了铵毒害。
3.1 铵的累积对不同生态型拟南芥生长的影响
大量铵累积会使植物发生毒害,导致叶片黄化,生物量和净光合速率显著下降[35]。而不同遗传背景的生态型拟南芥对铵的响应各有不同,如图1所示,不同生态型在硝态氮和铵态氮培养下其体内游离铵的含量各不相同,Tscha-1和ukID48对铵不敏感,而大多数生态型对铵较敏感,尤其是1187-G7、Si-0、fab-4、Ba-0、Dralv1-f对2 mmol/L铵很敏感,因此本研究结果表明不同基因型对铵的适应性各不同。Sarasketa等研究了47份不同生态型拟南芥,结果表明在硝态氮培养下其体内游离氨含量与生物量呈显著负相关[36],本研究图2-a结果同样表明两者呈显著负相关性,图2-b结果表明铵态氮培养下其体内游离氨含量与生物量呈显著负相关,可能相比外源铵,植物对内源铵的响应更为重要,在硝态氮下耐铵的品种在铵态氮下同样耐铵,氮素利用效率更高,并且不同的生态型对铵的吸收和同化能力可能有差异。
3.2 不同生态型拟南芥对铵吸收代谢能力差异的影响
氮素利用效率由吸收和同化两个途径决定,植物主要通过铵态氮转运蛋白 (AMTs) 从外界环境中吸收进入根部[37],进而通过谷氨酰胺合成酶 (GS) 和谷氨酸合成酶 (GOGAT) 途径同化。前人用GS抑制剂处理水稻根部,发现木质部和地上部15NH4+显著下降,说明铵的同化大部分在根中进行,但仍有一定数量的NH4+通过木质部向上运输[38-39],这部分NH4+进一步通过地上部的GS被同化或以NH3的形式损失[22]。铵同化酶GS主要有两种同工酶,分别是GS1和GS2,拟南芥中编码GS1的有5个同源基因,主要在氮的再利用中发挥作用,GS2主要在硝酸盐还原为铵以及光呼吸产生铵的同化中起作用,所以具有高活性GS的植物对铵的耐受性更强[40]。15N示踪试验 (图5) 结果表明,根部未被同化的NH4+进一步被转运到地上部进而被GS同化,并且耐铵生态型通过加强地下部铵的同化,及减少往地上部的转运从而减轻铵毒害。另外,前人研究发现AtAMT1;1转录水平与根部谷氨酰胺浓度成反比,因此抑制AtAMT1;1基因转录的关键因子不是而是的下游同化产物谷氨酰胺[41]。本研究发现在直接供铵的条件下耐铵生态型吸收更多的铵(图6-a,b),在根部被大量同化 (图7-c,d),15N标记试验结果表明耐铵生态型地上部NH4+含量显著低于铵敏感生态型,说明有更少的铵被转移到地上部,并且进一步被同化 (图7-a,b),所以铵毒害较轻。因此,在2 mmol/L铵态氮条件下耐铵生态型具有较高的铵态氮同化能力,而不是抑制铵态氮的吸收。
目前关于植物铵毒害的原因有很多种,但是并没有从基因水平真正说明其毒害原因,已发现的几个与铵相关的基因都位于铵毒害的下游,因此本文解释了耐铵生态型拟南芥耐铵毒害的生理机制,为后续挖掘耐铵基因提供生理基础,以及为湖南省长期稻油轮作下油菜的遗传改良提供理论指导。
4 结论
2 mmol/L铵显著抑制不同生态型拟南芥地上部的生长,且铵大量累积于地上部,铵含量是硝态氮下的1.5倍以上,其中有5个生态型达到了10倍以上。耐铵型拟南芥是通过根部铵转运蛋白从外界吸收更多的铵,同时耐铵生态型拟南芥GS活性是铵敏感拟南芥的1.2倍,在较高GS活性下被同化,从而降低了根部游离铵含量,并且耐铵生态型拟南芥全氮和地上部15N的累积较敏感型拟南芥高,地上部GS活性较敏感型显著提高,说明耐铵能力强的品种,铵的同化能力较强,减少了植株体内的铵含量,从而减轻铵对拟南芥地上部的毒害。
