多组分氯盐体系镁锂分离规律初探
2019-08-14刘香环易美桂
刘香环,易美桂 ,向 兰
(1.四川大学化学工程学院,四川成都610065;2.清华大学化学工程系)
中国盐湖锂资源占锂总储量为85%,但盐湖锂盐产品仅7%左右,制约因素之一是镁锂分离。如何在除镁同时避免锂损失,是目前亟待解决的问题[1-2]。
含锂盐卤溶液一般采用沉淀法分离镁锂,通过加入无机碱或碳酸盐,使镁形成氢氧化镁或碳酸镁沉淀除去。氢氧化镁粒径细小,易形成难过滤胶体,固液分离困难[3-5]。碳酸镁盐应用较广,前人的研究表明:MgCl2+Na2CO3体系中,0~50℃形成针状 MgCO3·3H2O,60 ℃以上形成团聚颗粒状 Mg5(CO3)4(OH)2·4H2O,均易过滤分离[6-12]。但目前碳酸镁盐法的研究多专注单一镁盐溶液,而实际盐湖卤水一般为多组分、高浓度的复杂体系,至今针对这一复杂体系的镁锂分离报道仍然不多。
为此,笔者以多组分(Mg-Na-Li)高浓度氯盐体系为研究对象,考察了温度和总碳与总镁之比对镁锂分离的影响,初步探索出镁锂分离最佳工艺。
1 实验方法
1.1 实验原料
无水氯化镁(分析纯,天津市光复精细化工研究所);无水氯化锂(分析纯,上海韶远试剂有限公司);氯化钠(分析纯,北京市通广精细化工公司);无水碳酸钠(分析纯,西陇科学股份有限公司);超纯水(18.2 MΩ)。
1.2 实验方法
量取50mL混合溶液(组成:0.6molMgCl2、1.1mol LiCl、3.2 mol NaCl)于 150 mL 三角瓶中,置于恒温磁力搅拌(300 r/min)水浴锅(±1℃),溶液升温至设定温度后加入(0.5 mL/min)碳酸钠溶液,加料完毕后继续反应90min,过滤分离,记录固液分离时间,用250 mL超纯水洗涤多次,再置于65℃烘箱烘干10.0 h。
1.3 分析检测
使用CIC-D300型液相色谱仪测定溶液及沉淀物中Mg2+和Li+的浓度;采用粉末D8 Advanced型X射线衍射仪(XRD)分析沉淀物晶体结构;使用STA 449F3型同步热分析仪(DSC/DTA-TG)测定样品失重曲线;利用JSM 7401F型扫描电子显微镜(SEM)观察沉淀物形貌。
2 结果与讨论
2.1 温度对沉淀物组成的影响
图 1 为总 C 和总 Mg 物质的量比[n(CT)/n(MgT)]为1时,25~80℃下沉淀物的 XRD谱图(a)与质量损失曲线(b)。由图1可见,25℃下沉淀物XRD谱图对应MgCO3·3H2O的标准谱图,2段质量损失曲线反映脱水和脱二氧化碳过程;40~80℃时沉淀物XRD 衍射谱图对应 Mg5(CO3)4(OH)2·4H2O 标准谱图,3段质量损失曲线反映脱水、脱羟基及脱二氧化碳过程。由于Li+也会与CO32-生成Li2CO3析出,而Li2CO3的衍射峰在谱图中不能明显辨出[图例♣标记 Li2CO3主峰位置,与 Mg5(CO3)4(OH)2·4H2O 衍射峰重叠],下文2.4节会对沉淀物中是否析出碳酸锂作详细讨论。
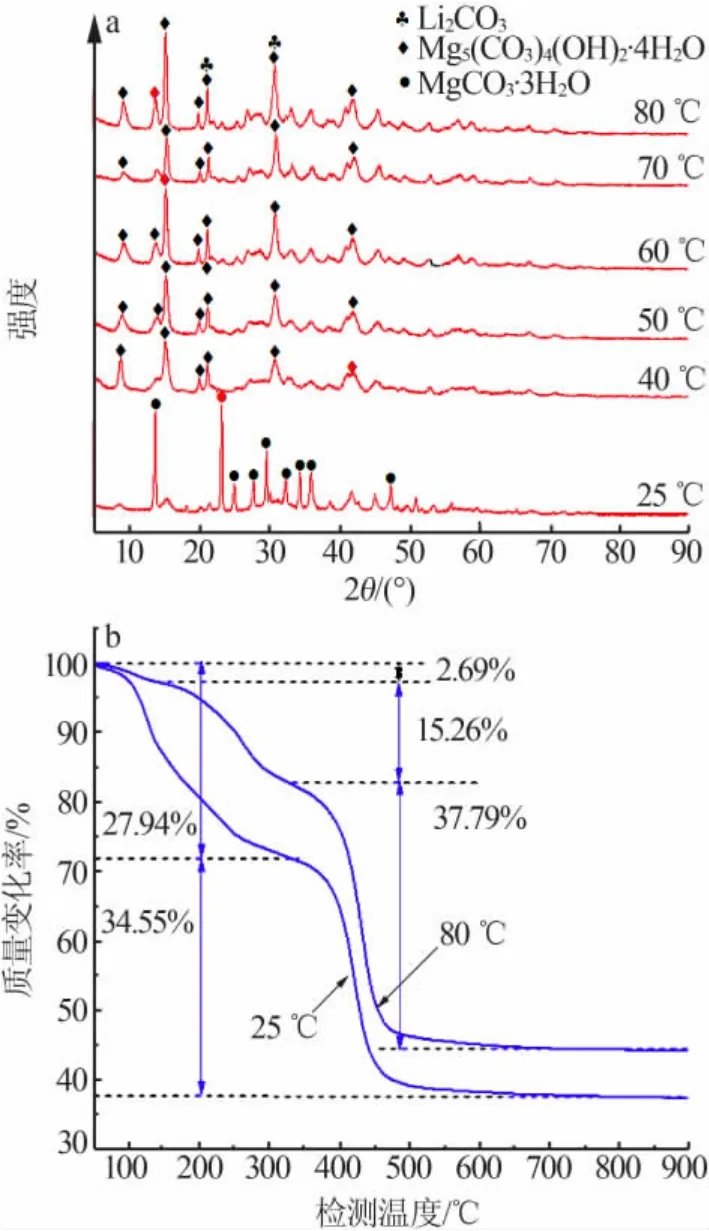
图1 沉淀物XRD谱图(a)与质量损失曲线(b)

图2 沉淀物的SEM形貌照片
2.2 温度对沉淀物形貌影响
图 2 为n(CT)/n(MgT)=1.0 时 25~80℃下形成的沉淀物形貌。由图2可见,在25℃下得到直径为1.0μm、长为 10 μm 左右的针状 MgCO3·3H2O(图 2a),较易过滤;40~50 ℃下形成不规则片状 Mg5(CO3)4(OH)2·4H2O(图 2b~2c),粒径较小(<1.0 μm)且有部分团聚,反应溶液稠滞呈胶状,过滤时间为25℃时过滤时间的3倍以上,固液分离困难,这与文献[6]报道的在MgCl2+Na2CO3体系于40~50℃形成针状MgCO3·3H2O有所不同,原因可能与多组分体系中离子间相互作用有关,使 MgCO3·3H2O更易转化为Mg5(CO3)4(OH)2·4H2O[13],降低相变转化温度。 60~80 ℃,温度越高 Mg5(CO3)4(OH)2·4H2O 片状颗粒团聚微球直径越大,70~80℃时团聚颗粒直径达10 μm以上,过滤时间仅为25℃时的1/4,较25℃得到的针状MgCO3·3H2O更易进行固液分离。
实验条件下,n(CT)/n(MgT)=0.8~1.1 时,沉淀物组成和形貌只与温度有关,与n(CT)/n(MgT)无关。
2.3 温度与 n(CT)/n(MgT)对沉镁率的影响
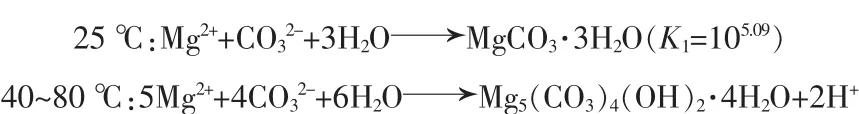
图 3a 为n(CT)/n(MgT)和温度对沉镁率的影响。由图 3a 可见,温度一定时,n(CT)/n(MgT)越大,沉镁率越高,n(CT)/n(MgT)≥1.0 时,在 25 ℃和 70~80 ℃条件下,沉镁率>98%,进一步增大n(CT)/n(MgT),则沉镁率增加不显著。沉镁率在40℃时最低,这可能与沉淀物相变有关:
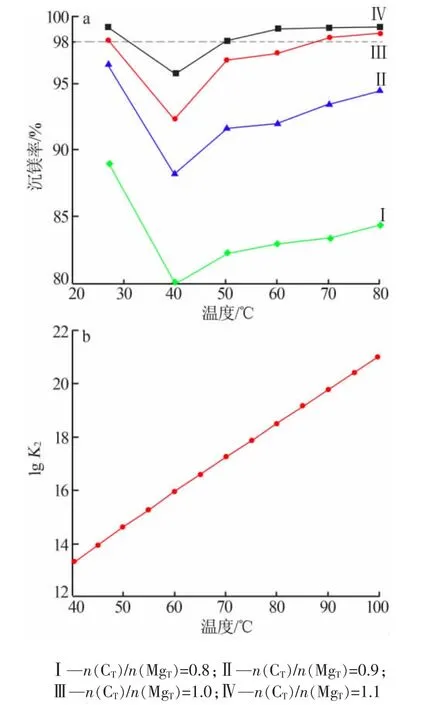
图3 沉镁率(a)与平衡常数K2(b)随温度变化
对应平衡常数(K2)随温度增加而增加(图3b),有利于形成 Mg5(CO3)4(OH)2·4H2O。 平衡常数K由热力学软件HSC6.0 Reaction Equations模块计算得到。
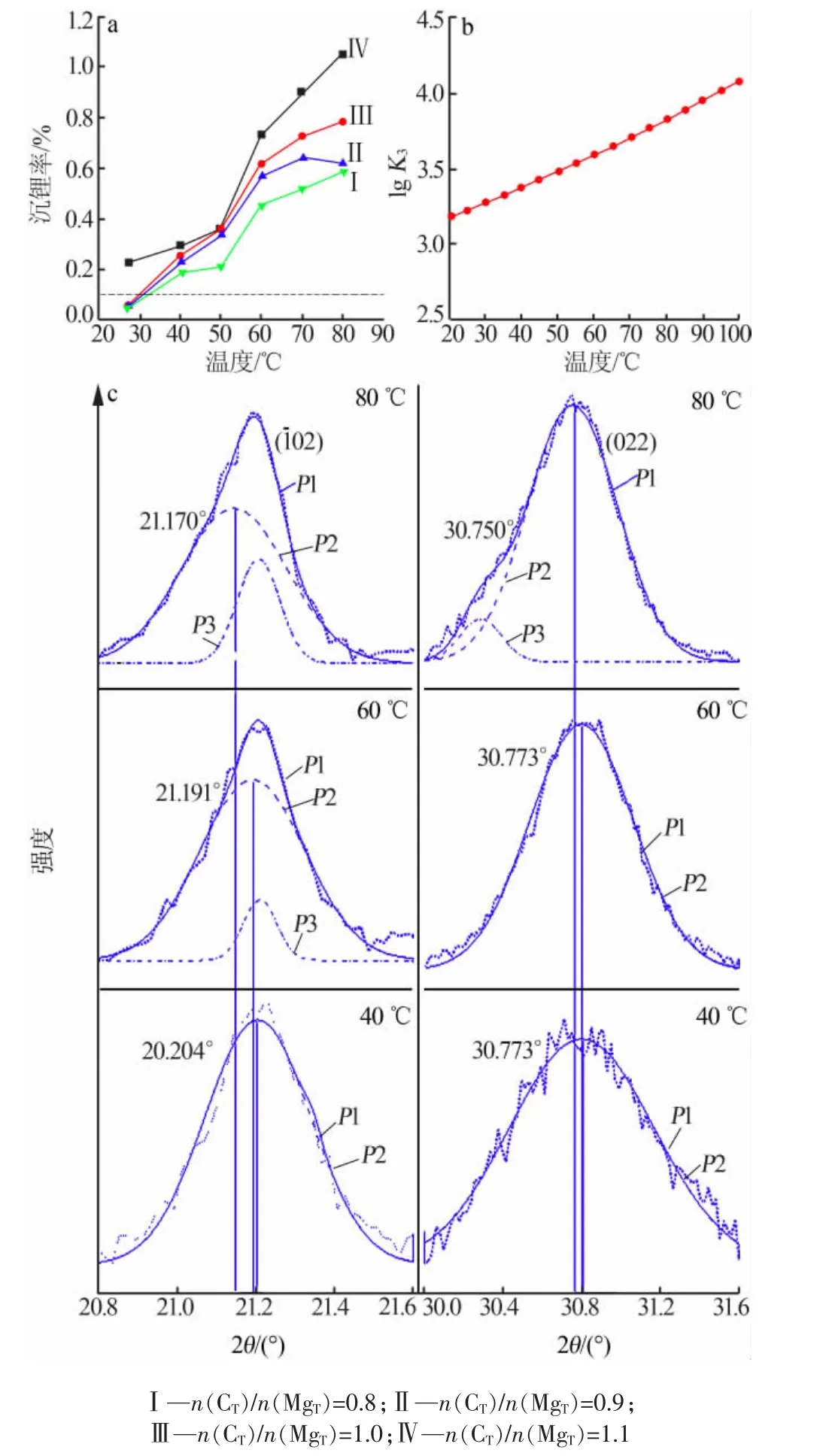
图4 沉锂率(a)与平衡常数 K3(b)随温度变化,及XRD分峰图(c)
2.4 温度与 n(CT)/n(MgT)对沉锂率的影响
图 4a 为温度与n(CT)/n(MgT)对沉锂率的影响。由图 4a 可见,温度一定时,n(CT)/n(MgT)增大,沉锂率增加;25 ℃条件下,n(CT)/n(MgT)≤1.0,沉锂率小于 0.1%。 在n(CT)/n(MgT)相同条件下,沉锂率随温度升高明显增加,这可归因于碳酸锂的生成平衡常数K3随温度的升高而增大(图4b)。因Li2CO3与Mg5(CO3)4(OH)2·4H2O 的衍射峰重叠较多,无法直接判定Li2CO3的存在,因而对XRD衍射谱图[n(CT)/n(MgT)=1.0,40~80 ℃]进行分峰拟合,结果见图 4c,由图4c可知,在60~80℃出现了Li2CO3拟合峰p3[(2θ=21.224°(110)和 2θ=30.284°(102)],且随着温度升高Li2CO3峰强度增加,说明沉淀物中Li2CO3含量增加,这与温度升高沉锂率增加相吻合。
实验条件下,25 ℃、n(CT)/n(MgT)=1.0,既能使沉镁率达到98%以上,同时确保Li2CO3不析出,可确定为最佳的锂镁分离条件。
3 结论
多组分氯盐混合体系(0.6molMgCl2+1.1molLiCl+3.2 mol NaCl)中,以 Na2CO3为沉淀剂,在 25~80 ℃,总 C 与总 Mg 物质的量比[n(CT)/n(MgT)]为 0.8~1.1的条件下,25℃形成针状MgCO3·3H2O,40℃以上形成 Mg5(CO3)4(OH)2·4H2O 不规则片状团聚微球,其中40~50℃形成的沉淀物粒径较小而不利于固液分离。
40℃时沉镁率最低。温度越高,Li2CO3越易形成,沉锂率越大。n(CT)/n(MgT)越大沉镁率和沉锂率越高。 室温(25 ℃)、n(CT)/n(MgT)=1.0 时,沉镁率达98%以上,且沉锂率<0.1%,镁锂分离效果最好。
