1种快速检测小麦籽粒中脱落酸和生长素的方法
2019-08-13李超李诚李春艳
李超 李诚 李春艳
摘要:拟建立小麦籽粒中脱落酸、生长素的快速提取方法和高效液相色谱(HPLC)法检测2种激素的试验体系。经试验对比,采用异丙醇、水、浓盐酸体积比=2 ∶ 1 ∶ 0.002的混合溶液作为提取液,以二氯甲烷作为萃取溶剂,简化了提取过程,提高了提取效率。HPLC的分离采用ZORBAXSB-C18(150 mm×4.6 mm,5 μm)反相色谱柱,柱温为 26 ℃,检测器波长为262 nm,流动相为甲醇、乙酸水溶液(乙酸的体积分数为0.2%),其中甲醇、乙酸体积比=38 ∶ 62,流速为1 mL/min。结果表明,小麦籽粒中2种激素的分离效果较好,加标回收率达95.8%~96.6%,标准偏差在1.14%~1.59%之间。由此可见,该提取方法和检测体系的建立为快速提取和检测小麦籽粒中的脱落酸和生长素提供了可靠的方法。
关键词:小麦;脱落酸;生长素;高效液相色谱
中图分类号: S512.101 文献标志码: A 文章编号:1002-1302(2019)02-0194-03
植物激素在植物生长发育及应对生物和非生物胁迫的反应中起着关键的作用[1-3]。小麦是我国重要的粮食作物,内源性激素对小麦灌浆期籽粒的发育影响很大,会直接影响小麦的产量和品质[4-5]。因此,研究小麦内源激素的变化,对于通过人工干预措施调控小麦生产具有重要的实践价值。现有的检测植物内源性激素的方法有生物鉴定法[6]、生物传感器法、酶联免疫法、光谱和色谱法,其中色谱法包括气相色谱法(GC)或与质谱联用(GC-MS)法、高效液相色谱法(HPLC)或与质谱联用(HPLC-MS)法、超高效液相色谱法等。生物鉴定法、光谱法和生物传感器法因其专一性和局限性限制在近年来鲜有报道。间接酶联免疫法因其使用方便、成本低、速度快而使其使用较为普遍,但灵敏度低,不能较好地满足实际检测需要[7]。气相色谱法因大部分植物激素含有极性基团,不易挥发,需要进行衍生化处理才能测定[8]。高效液相色谱法不需要对激素进行衍生化处理,可直接进行测定,且准确性、灵敏度和重现性都比较好,是目前最常见的测定植物内源性激素的方法。现阶段分析仪器已达到了较高的水平,相对于激素的检测来说,样品的前处理是整个检测过程中的关键,冗长而复杂的前处理常常会造成样品提取率低、杂质干扰太大,从而导致试验失败。近年来,有较多学者对植物内源性激素的提取做了研究,目前主要的提取方法是用80%甲醇过夜浸提[9],但是提取时间过长(需要12 h以上),后续纯化步骤过于繁琐且需要大量的溶剂,成本较高。因此,改良前处理方法对植物内源性激素的测定显得尤为重要。本研究拟对比2种提取脱落酸和生长素的方法,优化样品前处理过程,以期为小麦籽粒内源性激素的提取、测定提供一种简便、高效、可行的前处理方法。
1 材料与方法
1.1 材料
本研究选择新疆主栽冬小麦品种新冬22号为试验材料,种子由石河子大学冬小麦课题组提供。试验于2016—2017年在石河子大学农学院试验站(44°17N,86°03E,海拔461 m)进行。抽穗当天挂牌标记,开花当天选取同天开花、长势一致的麦穗挂牌标记。分别于小麦开花后10、20、30 d取穗中上部籽粒,立即置于液氮中速冻5 min,再置于-80 ℃冰箱中保存备用。
主要试验仪器:高效液相色谱仪(Agilent Technologies,Agilent 1260,USA);冷冻离心机(Eppendorf,Centrifuge 5424,Germany);氮吹仪(Organomation,N-EVAP-45,USA);台式恒温摇床(NEW BRUNSWICK,Innova 40 R,UK);紫外分光光度计(HITACHI,U-5100,Japan);电子天平(Sartorius,BS 210 s,Germany)。
生长素(IAA)、脱落酸(ABA)标准品,均购于Sigma公司;甲醇(流动相)为色谱纯,购于Fisher公司(美国);色谱纯冰乙酸,购于天津光复精细化工研究所;甲醇(提取液)、石油醚、乙酸乙酯为国产分析纯;超纯水为笔者所在实验室自制。
1.2 激素提取方法的建立
方法1:激素的提取参考Wu等的方法[10]并作适当修改后进行:准确称取4 g用液氮研磨的小麦籽粒粉末,加入 16 mL 提取缓冲液(样品与提取缓冲液体积比保持1 ∶ 4,以体积比为2 ∶ 1 ∶ 0.002的异丙醇、水、浓盐酸溶液为提取缓冲液,以0.001 mol/L丁基化羟基甲苯作为抗氧化剂),于4 ℃、200 r/min振荡30 min。再加入32 mL(提取緩冲液体积的2倍)二氯甲烷,于4 ℃、200 r/min振荡30 min。之后于4 ℃、 12 000 r/min 离心10 min,取下清液,在避光条件下用氮气吹干,加甲醇定容至2 mL,过0.45 μm微孔滤膜,上HPLC分析。
方法2:准确称取4 g用液氮研磨后的小麦籽粒粉末,加入10 mL预冷的80%甲醇溶液,振荡摇匀后置于4 ℃冰箱过夜;浸提过夜后于4 ℃、8 000 r/min离心10 min得上清液,将残渣加入10 mL 80%甲醇中浸提3 h,该步骤重复2次后合并上清液。将合并后的上清液用氮吹仪浓缩至原体积的1/3,加入30 mL石油醚萃取脱色3次,弃上清。再用20 mL乙酸乙酯对水相溶液萃取3次,合并酯相后用氮吹仪吹干。用pH值为3.5的乙酸水溶液溶解,溶液过预处理后的Sep-Pak C18小柱纯化,用甲醇洗脱(之后发现二氯甲烷的洗脱效率更高,遂改为二氯甲烷洗脱)。将洗脱液在避光条件下用氮气吹干,用甲醇定容至2 mL,过0.45 μm微孔滤膜,上机分析[9]。
1.3 色谱条件
色谱柱为ZORBAXSB-C18(150 mm×4.6 nm,5 μm,Agilent公司),流动相A为甲醇,B为乙酸水溶液。流速为 1 mL/min,柱温为26 ℃,检测器波长为262 nm,进样量为10 μL。
1.4 标准溶液的配制
用甲醇(色谱纯)将生长素、脱落酸标准品配制成浓度为 1 mg/mL 的母液,根据出峰情况逐级稀释作标准曲线。
1.5 样品加标回收率的测定
取小麦籽粒(花后20 d)并用液氮研磨,将研磨后的小麦粉分为4份,每份4 g;取2份小麦籽粒样品,其中1份加入 5 000 ng 标准样品,同时用第1.2节中的方法1进行激素的提取;对于剩余的2份样品按照第1.2节中的方法2进行样品的加标回收率测定,试验重复3次。
2 结果与分析
2.1 检测波长
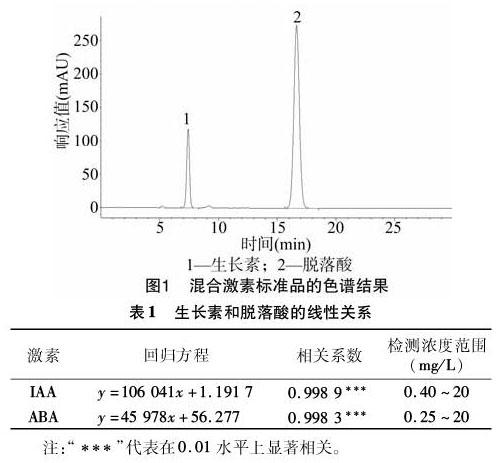
用紫外分光光度计对激素混合标准品溶液进行扫描,同时兼顾2种激素的分离效果。分析发现,溶液在262 nm处有最大吸收波长,且2种激素在262 nm检测波长下均有较好的峰形,故选择在262 nm波长下对样品的标准品溶液进行测定。
2.2 流动相配比
参考前人以甲醇、水作为流动相进行的激素分离研究,分别以体积分数为60%、50%、40%、30%、20%的甲醇作为流动相对标准品进行分析。结果发现,当甲醇含量为40%、30%时,2种激素能够与杂质分离。随即进行微调,发现当甲醇含量为38%时,2种激素的分离效果显著。
2.3 流动相pH值
由于目标激素均为弱酸性样品,因此通过调节流动相pH值可以抑制样品的解离,以增加样品组分在固定相上的保留时间,改善峰形。分别在水相(总体积为1 L)中加入0.5、1.0、1.5、2.0、2.5、3.0、5.0 mL冰乙酸,发现当加入2 mL冰乙酸时,2种激素峰形尖锐且各组分的分离效果较好。因此,采用体积分数为0.2%的乙酸水溶液作为流动相。
2.4 流速和柱温
分别检测不同流速(0.4、0.7、1.0、1.3、1.5、2.0 mL/min)下2种激素的分离效果,发现流速过大时,各激素峰分离差,容易出现肩峰;流速过小时,整个分离过程的时间大大增加。综合考虑,选用1.0 mL/min的流速。试验还发现,柱温对整个检测过程的影响较小,故选择室温为26 ℃。
选择最优色谱条件,对2种激素的混合标样进行检测。从图1可以看出,2种激素的分离和检测结果良好。
2.5 标准曲线及其线性范围
在“1.3”节的色谱条件下,以峰值面积为纵坐标、标品质量浓度为横坐标绘制标准曲线,计算各激素的回归方程、相关系数、线性范围。表1结果显示,激素标准品浓度与峰面积的线性相关性均达到极显著水平。
2.6 实际样品测定和样品加标回收率
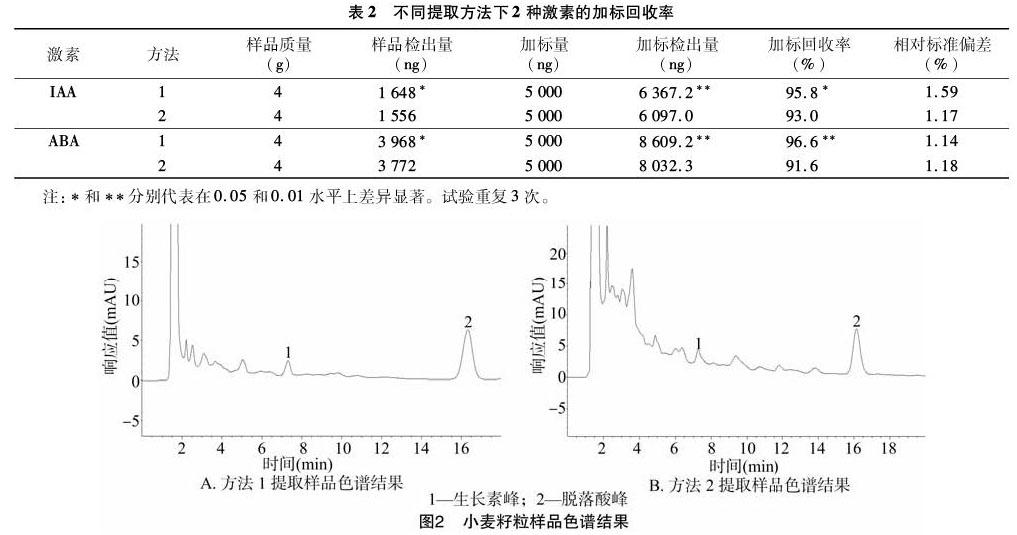
如表2所示,在样品加标回收率测定中,使用方法1提取得到的样品含量极显著高于方法2得到的样品含量,方法1的样品加标回收率也显著高于方法2的样品加标回收率。激素的提取通常使用的是相似相溶原理,现阶段常用的激素提取方法是用80%甲醇于4 ℃过夜浸提[11-13],如简利茹等用乙腈和水按一定比例混合后提取菌液中的植物激素[14],刘同祥等用纯乙腈提取辣椒幼苗中的植物激素[15],马宏棋等用一定比例的甲醇、乙酸乙酯和甲酸提取草莓中的脱落酸[16]。这些方法虽然能够从植物组织中有效地提取出植物激素,但是后续步骤过于繁琐,需要大量的时间和溶剂,且成本较高。本研究通过不断试验,以异丙醇、水、浓盐酸溶液(异丙醇、水、浓盐酸体积比为 2 ∶ 1 ∶ 0.002)作为提取液并加入丁基化羟基甲苯作为抗氧化剂防止激素氧化分解,经过短时间的振荡后用二氯甲烷萃取就可以得到目标激素,大大节省了时间和成本。通过2种提取方法的对比,本研究采用的方法在提取率上优于将80%甲醇作为脱落酸和生长素的提取方法,此方法简化了后续处理步骤,大大减少了目标激素的损失。
2.7 小麦籽粒不同发育时期的激素含量
如图2所示,小麦籽粒中的2种激素得到良好的分离,与方法2相比, 用方法1提取的样品杂质峰相对较少。采用方法1建立的快速提取方法及第1.3节的色谱条件测定小麦花后10、20、30 d籽粒中的激素含量。检测结果显示,花后10、20、30 d籽粒中IAA的鲜质量含量分别为1 382、412、267 ng/g,ABA的鲜质量含量分别为283、922、475 ng/g。IAA是高等植物体内主要的细胞分裂素之一,花后10 d左右是小麦胚乳细胞增殖时期,这个时期较高含量的IAA有助于胚乳细胞快速增殖,以增加籽粒的库容量[17];花后20 d是小麦籽粒灌浆的高峰时期,这个时期ABA含量比较高,这是由于籽粒中的ABA能够控制籽粒的成熟,提高籽粒灌浆速率[4,18]。
3 结论
通过2种激素提取方法的比较,本研究建立了1种简单、快速、高效提取小麦籽粒中脱落酸、生长素的方法和HPLC檢测条件。本研究建立的提取方法,能够满足对小麦籽粒中脱落酸和生长素定量分析的要求,为进一步研究脱落酸和生长素对小麦籽粒发育的影响提供了基础,也为其他植物样品激素的提取提供了参考。
参考文献:
[1]Davies P J. The plant hormones:their nature,occurrence,and functions[M]//Plant hormones physiology biochemistry & molecular biology. Netherlands:Springer,1995:1-11.
[2]Bari R,Jones J D. Role of plant hormones in plant defence responses[J]. Plant Molecular Biology,2009,69(4):473-488.
[3]Nemhauser J L,Hong F X,Chory J. Different plant hormones regulate similar processes through largely nonoverlapping transcriptional responses[J]. Cell,2006,126(3):467-475.
[4]Yang J,Zhang J,Liu K,et al. Abscisic acid and ethylene interact in wheat grains in response to soil drying during grain filling[J]. New Phytologist,2006,171(2):293-303.
[5]杨卫兵,王振林,尹燕枰,等. 外源ABA和GA对小麦籽粒内源激素含量及其灌浆进程的影响[J]. 中国农业科学,2011,44(13):2673-2682.
[6]马建义. 除草剂和植物生长调节剂的几种生物筛选方法的比较研究[J]. 世界农药,2001,23(1):47-50.
[7]Lai Y,Feldman K L,Clark R S. Enzyme-linked immunosorbent assays (ELISAs)[J]. Critical Care Medicine,2005,33(12):433-434.
[8]金幼菊. 气相色谱-质谱联用技术在植物激素分析中的应用[J]. 植物生理学报,1992(1):72-77.
[9]张玉琼,仲延龙,高翠云,等. 高效液相色谱法分离和测定小麦中的5种内源激素[J]. 色谱,2013,31(8):800-803.
[10]Wu J X,Xu Z L,Zhang Y J,et al. An integrative analysis of the transcriptome and proteome of the pulp of a spontaneous late-ripening sweet orange mutant and its wild type improves our understanding of fruit ripening in citrus[J]. Journal of Experimental Botany,2014,65(6):1651-1671.
[11]王 斌,褚君強,史发猛,等. 橡胶树胶乳中几种植物激素的提取及其高效液相色谱测定法[J]. 热带作物学报,2012,33(1):148-152.
[12]黄 靖,刘艳芝,刘国伟,等. 高效液相色谱法测定植物内源激素研究进展[J]. 山东农业科学,2011(8):101-103.
[13]张占畅,孙志红,郑小能,等. 高效液相色谱法测定库尔勒香梨幼果中的4种内源激素[J]. 新疆农业科学,2017,54(5):886-892.
[14]简利茹,李哲斐,韩青梅,等. 固相萃取-HPLC测定外生菌根真菌产生植物激素IAA和GA3[J]. 西北农业学报,2011,20(9):165-168.
[15]刘同祥,张艳平. HPLC法测定辣椒苗中ABA含量研究[J]. 广东农业科学,2010,37(8):249-250.
[16]马宏棋,陈敏氡,朱海生,等. 草莓ABA的快速提取方法及超高效液相色谱分析[J]. 园艺学报,2014,41(3):577-584.
[17]王瑞英,于振文,潘庆民,等. 小麦籽粒发育过程中激素含量变化[J]. 作物学报,1999,25(2):227-231.
[18]李向阳,马溶慧,朱云集,等. 不同冠温特征小麦的籽粒灌浆特性及内源激素的变化[J]. 麦类作物学报,2005,25(5):32-37.
