应用计算机辅助精液分析系统对梅山猪公猪精子运动特征的研究
2019-08-13郭苹吴庆陈永霞
郭苹 吴庆 陈永霞
摘要:为定量检测梅山猪公猪精子动态学参数,丰富梅山猪种质特性研究基础。采用计算机辅助精液分析系统对国家级梅山猪保种场6头成年种公猪精液进行实时检测。结果显示:梅山猪公猪精液中快速精子占74.69%,前向性运动精子占61.45%,a级精子占47.30%;根据精子前向性运动分级标准,梅山猪公猪精子曲线速度(VCL)、直线运动速度(VSL)、平均路径速度(VAP)、线性指数(LIN)、直线指数(STR)、头部侧向运动平均振幅(ALH)、鞭打频率(BCF)分别为(63.23±0.26) μm/s、(18.88±0.13) μm/s、(33.89±0.15) μm/s、29.86%、55.71%、(3.16±0.013) μm、(6.13±0.028) Hz;在运动速度分级标准、世界卫生组织(WHO)分级标准、前向运动判断标准这3种分类标准中,除LIN、STR和振动指数(WOB),上述其他指标均呈极显著差异(P<0.01)。研究首次及时准确地定量分析了梅山猪公猪精子的动态学参数,丰富了梅山猪的研究素材。
关键词:梅山猪;CASA系统;精子活力;VCL;STR
中图分类号: S828.8+13 文献标志码: A 文章编号:1002-1302(2019)02-0165-04
梅山猪是我国著名的地方品种,以高繁殖力而为世人熟知,曾先后出口日本、法国、美国等国家,为世界种猪育种作出巨大贡献[1]。为此,国内外许多科技工作者对梅山猪独特的生殖生理特性进行了大量的研究报道,无论是在细胞水平还是分子水平,认为梅山猪高繁殖力可能与母猪排卵数、胚胎死亡率、激素水平、子宫容积、耐低营养水平、基因多态性等因素有关[2-5]。但这些因素无疑都是从母本角度考虑,而关于父本方面的研究[6]少之又少,相比于人类男性的研究,一方面是由于公猪的饲养数量少、饲养成本高、淘汰率高、更新快等,另一方面是由于传统的精液品质检查存在检测时间长、准确性不高、检测指标少等问题[7]。随着计算机技术的飞速发展,计算机辅助精液分析技术(CASA)也越来越普及,特别是在人类精液质量分析检测中[8-11],CASA系统可对公猪精液品质进行快速、客观的分析[12]。
本研究利用CASA系统,以梅山猪公猪为研究对象,检测梅山猪公猪精子运动参数,定量分析梅山猪公猪精子活力、运动能力和运动方式等,以期进一步丰富梅山猪种质特性的研究素材,为梅山猪高繁殖力生理机制的研究奠定一定理论基础。
1 材料与方法
1.1 试验动物
本试验的梅山种公猪均来自江苏农林职业技术学院国家级梅山猪种猪场,共6头成年种公猪(28~38月龄),每头种公猪每周采精2次,固定采精时间和采精员,所有公猪的营养水平、日粮配方、管理方式、环境条件等都相同。试验时间:2016年11月至2017年7月。试验地点:江苏农林职业技术学院种猪场实验室。
1.2 精液采集和指标测定
公猪精液的采集用手握法进行;在采精过程中,弃去前、后段精清,收集中段富含精子的部分,用4层灭菌纱布过滤精液,采完精后,立即吸取10 μL精液,放入2 μL计数池(标准计数板,8个计数池。每个计数池容积22 μL,池高20 μm),置于负相差显微镜(放大倍数为100)倍下进行观察和检测。
采用西班牙CASA系统进行精液质量分析。测定的主要精子运动指标如下[13]:
VCL(curvilinear velocity,即曲线速度),是精子头沿其实际行走曲线的运动速度,μm/s。
VSL[straight-line (rectilinear) velocity,即直线运动速度],是精子頭从开始检测时的位置至最后所处位置之间的直线运动的平均速度,μm/s。
VAP(average path velocity,即平均路径速度),是精子头沿其空间平均轨迹的运动速度,μm/s。这种速度是计算机CASA仪器中的算法将精子运动的实际轨迹平均后计算得出的。
LIN(linearity,即线性指数或线性度),是精子运动曲线的直线分离度,计算公式为LIN=VSL/VCL×100%。
STR(straightness,即直线指数),或前向性,是精子运动平均路径的直线分离度,计算公式为STR=VSL/VAP×100%。
WOB(wobble,即振动指数),是精子头沿其实际轨迹的空间平均路径摆动的尺度,计算公式为WOB=VAP/VCL×100%。
ALH(amplitude of lateral head displacement,即头部侧向运动平均振幅),是精子头部实际运动轨迹对平均路径的侧摆幅度,μm。
BCF(beat-cross frequency,即鞭打频率),是精子头部跨越其平均路径的频率,Hz。
检测时,要求精子总数不低于500个。
1.3 猪的精子分级判断标准和数据统计
1.3.1 运动速度分级标准 快速,VCL≥45 μm/s;中速,25 μm/s≤VCL<45 μm/s;慢速,10 μm/s 1.3.2 世界卫生组织(WHO)分级标准 a级,VCL≥45 μm/s,且STR≥45%;b级,VCL≥45 μm/s,且STR<45%;或VCL≥25 μm/s,且STR≥45%;c级,VCL≥25 μm/s,且STR<45%;或VCL>10 μm/s;d级,VCL≤10 μm/s。 1.3.3 前向运动判断标准 VCL≥25 μm/s,且STR≥45%,判为前向运动,否则为非前向运动。 1.3.4 超级精子(hyperactive) 判断标准为ALH>2.5 μm,且 STR>85%。
1.4 数据统计
采用SPSS 19.0软件进行统计分析,数据用平均数±标准误表示。
2 结果与分析
2.1 梅山猪公猪精子分级
按照精子运动速度分级,可分为快速、中速、慢速和不动,梅山猪公猪8 969个精子中,快速精子数量为6 699个,比例为74.69%,中速的为1 824个,占20.34%,慢速的为427个,占4.76%。根据精子前向性运动分级标准,可分为前向性运动、非前向性运动和不动精子,梅山猪公猪前向运动的精子数量为5 511个,比例为61.45%,非前向运动的有3 439个,比例为 38.34%。根据WHO分级标准,分为a、b、c、d级4个级别,a级要求最高,梅山猪公猪中a级精子数量为4 242个,占 47.30%,b级占41.54%(表1、图1、图2、图3)。梅山猪公猪 8 969 个精子中,超级精子344个,占3.84%。
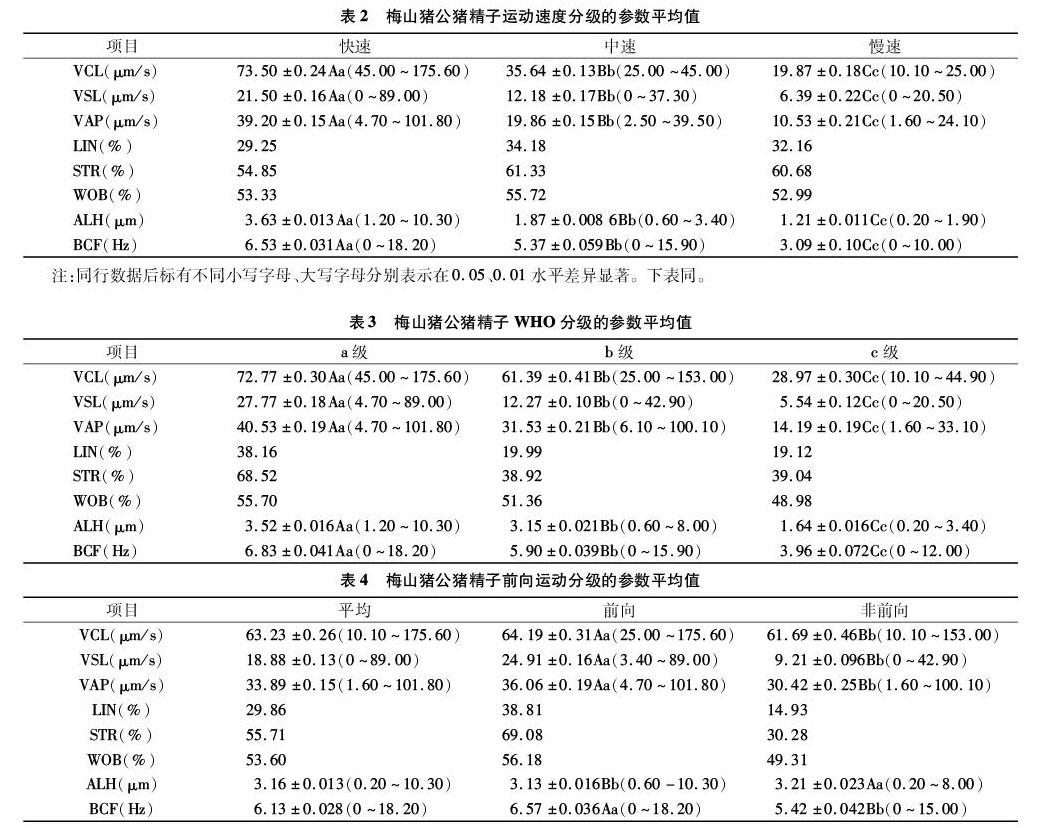
2.2 梅山猪公猪精子运动速度分级的运动参数
梅山猪公猪精子运动速度分级的参数平均值如表2所示。梅山猪公猪精子运动速度分级是依据VCL而分的,其他指标结果如下:在VSL方面,快速组平均值最高,为(21.50±0.16) μm/s,最高值为89.00 μm/s,慢速组最低,仅为(6.39±0.22) μm/s,差异极显著(P<0.01);在VAP方面,快速组平均值最高,为(39.20±0.15) μm/s,最高值为 101.80 μm/s,慢速组最低,仅为(10.53±0.21) μm/s,差异极显著(P<0.01);在LIN、STR和WOB方面,均表现为中速组最高,快速组和慢速组随机波动;在ALH和BCF方面,表现为快速组>中速组>慢速组,且不同组间差异极显著(P<0.01)。
2.3 梅山猪公猪精子WHO分级的运动参数
由表3可知,梅山猪公猪精子按照WHO分类标准,在VCL方面,a级平均值最高,为(72.77±0.30) μm/s,c级最低,为(28.97±0.30) μm/s;在VSL方面,a级平均值最高,为(27.77±0.18) μm/s,c级最低,为(5.54±0.12) μm/s;在VAP方面,a级平均值最高,为(40.53±0.19) μm/s,c级最低,为(14.19±0.19) μm/s。以上三者均表现出相同趋势:a级>b级>c级,且差异均达到极显著水平(P<0.01)。在LIN、STR和WOB方面, 均表现为a级最高, b级和c级随机波动。在ALH和BCF方面,与VCL、VSL和VAP表现出相同的趋势,各组间差异极显著(P<0.01)。
2.4 梅山猪公猪精子前向性运动参数
由表4可知,梅山猪公猪精子平均VCL为(63.23±0.26) μm/s,最高为175.60 μm/s,平均VSL为(18.88±0.13) μm/s,最高为89.00 μm/s,平均LIN为29.86%,平均STR为 55.71%,平均ALH为(3.16±0.013) μm,最高为10.30 μm,平均BCF为(6.13±0.028) Hz。前向性运动精子中,平均VCL为(64.19±0.31) μm/s,平均VSL为(24.91±0.16) μm/s,平均VAP为(36.06±0.19) μm/s,平均LIN为38.81%,平均STR为69.08%,平均WOB为56.18%。前向运动和非前向运动2组间,除未对LIN、STR和WOB指标进行差异显著性检验外,其他指标间差异均达到极显著水平(P<0.01)。
3 讨论
3.1 关于CASA系统
传统的精液品質检测和评价方法是人工分析法,是按照GB 23238—2009《种猪常温精液》和GB/T 25172—2010《猪常温精液生产与保存技术规范》对猪常温精液检测的各项指标作出评价。人工分析法常受实验室条件、检测人员技术水平和经验的制约,具有主观性强、准确性差、速度慢等缺陷,且检测过程费时费力[7]。但随着CASA系统的出现和应用,精子活力、密度等参数能被更加准确及时的定量分析。
CASA系统采用计算机技术和先进的图像处理技术,利用相差显微镜识别和捕捉精子,一般是识别精子头,记录精子形态和运动轨迹,模拟计算精子的形态学参数和动态学参数,根据各种动物的参数设置,自动完成数据的整理和分析[14-17],因此,CASA系统更能客观地定量测定精子活力、畸形率、精子密度等指标。目前,CASA系统已被广泛应用于人类男性不育患者精子活力检测中,在大鼠、小鼠、鸡、鹅、猪、牛、鱼等中也有应用[7,12,15-17]。在人类精子活力检测中,利用正相差显微镜识别和捕捉精子,而猪和其他动物则是利用负相差显微镜。
3.2 关于参数设置
不同的动物具有不同的速度分级标准。可以根据VCL和VAP进行分级,但因为VAP是计算机将精子运动的实际轨迹平均后计算出来的,可因不同型号的仪器而有所改变,所以,一般而言,大多数动物采用VCL分级,VCL分级的最低阈值为10 μm/s,低于10 μm/s均判为不动。因为不同的动物精子运动速率存在一定差异性,那么快速、中速、慢速和不动的阈值不同的动物是不一致的。如对于人的快速与中速、中速与慢速的阈值分别为35、15 μm/s[13],公牛为50、25 μm/s,公羊为75、45 μm/s,狗为100、65 μm/s,马为90、45 μm/s,啮齿类为45、15 μm/s,鱼为100、45 μm/s,鸡为100、50 μm/s。本试验中,猪的阈值分别为45、25 μm/s。
在WHO分级方面,是根据VCL和STR进行的,分为a级、b级、c级和d级,不同动物的WHO分级标准是参照各个物种的速度分级标准中的VCL阈值和前向性运动分级标准中的STR阈值而定的。
在前进性运动分级方面,只存在快速前向运动和中速前向运动,判断标准在不同动物中也是不一致的,人的 STR≥80%[13],公牛的STR≥70%,公羊的STR≥80%,狗的STR≥75%,马的STR≥75%,啮齿类的STR≥50%,鱼的 STR≥80%,鸡的STR≥70%。本试验中,猪的STR≥45%。
3.3 关于3种评价标准
运动能力是精子独有的特征,不仅能够直观地反映精子质量,还能够间接地反映精子的受精能力[17-18]。运动能力包括运动速度和运动方式[17]。速度标准中注重精子的运动速度,忽略了精子的运动方式,并不能反映精子的有效运动或真实的迁移力;而在前向运动分级标准和WHO分级标准中,既注重精子运动速度,又能保证精子运动的直线性,这样才能保证少数精子穿过生殖道栅栏到达受精部位,等待卵子,并需要穿透卵丘和透明带完成受精过程[19]。
在运动速度分级标准、前向运动判断标准、WHO分级标准三者之间的关系方面,速度标准中的“快速”包括快速前向运动和快速非前向运动类型(前向运动分级),快速前向运动评为a级,快速非前向运动评为b级;“中速”包括中速前向运动和中速非前向运动,中速前向运动评为b级,中速非前向运动评为c级;“慢速”均为慢速非前向运动或c级;“不动”均为d级。快速前向运动和中速前向运动均为前向运动,快速非前向运动、中速非前向运动和慢速非前向运动均为非前向运动。速度标准中的“不动”、前进运动标准中的“不动”和WHO分级标准中的“d级”是一致的。
在上述3种评价标准中,许多研究实践表明,前进性运动分级标准更能客观地反映精子的运动速度和运动方式,是评价精子活力和受精率的一个重要体系[9-11,14,17]。
参考文献:
[1]国家畜禽遗传资源委员会. 中国畜禽遗传资源志(猪志) [M]. 北京:中国农业出版社,2011.
[2]Driancourt M A,Quesnel H,Meduri G,et al. Luteinization and proteolysis in ovarian follicles of Meishan and Large White gilts during the preovulatory period[J]. Journal of Reproduction and Fertility,1998,114(2):287-297.
[3]Rivera R M,Youngs C R,Ford S P. A comparison of the number of inner cell mass and trophectoderm cells of preimplantation Meishan and Yorkshire pig embryos at similar developtal stages[J]. Journal of Reproduction and Fertility,1996,106(1):111-116.
[4]Casellas J,Tomás A,Sánchez A,et al. Using haplotype probabilities in categorical survival analysis:a case study with three candidate genes in an Iberian × Meishan F2 population of newborn piglets[J]. Journal of Animal Breeding and Genetics,2008,125(1):5-12.
[5]頡孝贤,王起山,何 侃,等. 影响梅山猪繁殖性能的生理结构及遗传因素研究进展[J]. 畜牧兽医学报,2012,43(3):329-335.
[6]甄林青,王立蕊,付杰丽,等. 家畜精液质量相关生物标记的研究进展[J]. 畜牧兽医学报,2016,47(4):645-651.
[7]刘胜军,周瑞进,季 华,等. 利用计算机辅助精液质量分析方法分析鹅精子运动参数[J]. 中国家禽,2017,39(3):66-67.
[8]Davis R O,Katz D F. Standardization and comparability of CASA instruments[J]. Andrology,1992,13(1):81-86.
[9]Hirano Y,Shibahara H,Obara H,et al. Andrology:relationships between sperm motility characteristics assessed by the computer-aided sperm analysis(CASA)and fertilization rates in vitro[J]. Journal of Assisted Reproduction and Genetics,2001,18(4):215-220.
[10]Boryshpolets S,Kowalski R K,Dietrich G J,et al. Different computer-assisted sperm analysis (CASA) systems highly influence sperm motility parameters[J]. Theriogenology,2013,80(7):758-765.
[11]Amann R P,Waberski D. Computer-assisted sperm analysis (CASA):capabilities and potential developments[J]. Theriogenology,2014,81(1):5-17.
[12]Vizcarra J A,Ford J J. Validation of the sperm mobility assay in boars and stallions[J]. Theriogenology,2006,66(5):1091-1097.
[13]世界卫生组织. 人类精液检查与处理实验室手册[M]. 5版.谷翊群,译. 北京:人民卫生出版社,2011.
[14]焦瑞宝,姚余有,唐吉斌,等. 弱精子症患者精子运动参数及DNA碎片化指数的检测与分析[J]. 检验医学,2015,30(5):442-445.
[15]王 坤,蒋 隽,易康乐,等. 精子质量检测系统在鸡精子密度测定中的应用[J]. 黑龙江畜牧兽医,2015,8(15):106-108.
[16]赵 鹏,施 亮,张晓霞,等. 应用精子分析系统进行牛冷冻精液检测的研究[J]. 中国奶牛,2010(1):34-35.
[17]李 诺,任雪丹,吕中明,等. DEHP亚慢性暴露对大鼠精子运动参数影响[J]. 中国公共卫生,2017,33(4):611-613.
[18]韦凌娅,吕中明,王民生. 计算机辅助精子分析系统在大鼠精子运动能力测定中的应用[J]. 环境与职业医学,2007,24(6):596-598.
[19]刘锦宏,杨红梅,李 娜. 936例男性精子动态参数分析[J]. 长治医学院学报,2009,23(1):16-17.
