改良手辅助腹腔镜与传统开腹胃癌根治术的疗效对照研究
2019-08-13揭志刚李正荣蒋蒙蒙张国阳熊建波
肖 伟,揭志刚,李正荣,曹 毅,蒋蒙蒙,张国阳,高 攀,熊建波,刘 逸
(南昌大学第一附属医院,江西 南昌,330006)
随着科技的发展及对微创外科认知的加深,腹腔镜胃癌根治术在临床得到广泛发展。近年,手辅助腹腔镜手术(hand-assisted laparoscopic surgery,HALS)得到一定开展[1-5],因其增加了一只手在腹腔内协助操作,具有降低手术难度、缩短手术时间、减少中转开腹等优点。但手辅助腹腔镜胃癌根治术国内外报道较少。现将我们对改良手辅助腹腔镜与传统开腹胃癌根治术的临床对照研究结果报道如下。
1 资料与方法
1.1 临床资料 选取2013年6月至2014年12月南昌大学第一附属医院胃肠外科笔者所在治疗组手术治疗的102例胃癌患者,其中手辅助组51例,男32例,女19例,平均(57.6±12.3)岁;开腹组51例,男34例,女17例,平均(58.5±12.2)岁。选取标准:术前经胃镜检查、活检确诊为胃癌,行全腹部CT、胸部X线或胸部CT等检查排除肝、肺等远处转移;由同一组高年资手术医生按照日本《胃癌治疗指南》(第3版)行标准胃癌根治术。排除标准:姑息性手术、存在远处转移及全身情况差不能耐受手术的患者。两组患者临床资料见表1。
1.2 手术方法
1.2.1 开腹组 参照日本《胃癌治疗指南》(第3版)进行胃周区域淋巴结清扫,行胃癌根治术,远端胃癌根治术行毕Ⅰ或毕Ⅱ式吻合,全胃均行食管空肠Roux-en-Y吻合。用温蒸馏水反复冲洗术野,整理腹腔,检查无渗血后放置引流,关腹。
1.2.2 手辅助组 改良手辅助腹腔镜胃癌根治术的具体手术步骤参照我们先前的报道[6]。经过临床的不断实践,目前除明显偏瘦患者继续如图1a放置Trocar,其他患者均如图1b放置Trocar,即主操作孔选在左侧肋缘下腹直肌外侧缘,观察孔选在左肋缘下腋前线上。
1.3 观察指标及术后随访 比较两组手术切口、术中出血量、手术时间、术后首次肛门排气时间、术后病理检获淋巴结数量、术后住院时间、术后并发症及死亡率、术后3年总生存率(根据出院后至末次随访或死亡的时间计算生存率,主要终止事件为患者死亡或随访结束,次要终止事件为患者失访)。两组患者均通过门诊或电话进行随访,确认有无复发、转移或死亡、失访,末次随访时间为2017年12月。
1.4 统计学处理 采用SPSS 22.0软件进行数据分析,计量资料以均数±标准差表示,采用t检验;计数资料采用χ2检验。根据Kaplan-Meier方法建立概率曲线并与对数秩检验结果进行比较,P<0.05为差异有统计学意义。
2 结 果
2.1 术中及术后恢复情况 手辅助组均成功完成根治性胃切除术,无中转开腹、围手术期死亡病例。手辅助组切口长度、术中出血量、术后肛门排气时间、术后住院时间优于开腹组,差异有统计学意义(P<0.05);两组淋巴结清扫数量、手术时间差异无统计学意义(P>0.05)。见表2。术后两组患者均痊愈出院,改良手辅助组与开腹组术后3年总生存率分别为56.86%与52.94%,差异无统计学意义(P>0.05),见图2。
2.2 术后并发症 手辅助组术后发生5例(9.8%)并发症,开腹组发生6例(11.76%),均经积极对症保守治疗后痊愈,术后并发症发生率差异无统计学意义(P>0.75)。见表3。术后患者均获随访,随访时间≥36个月。
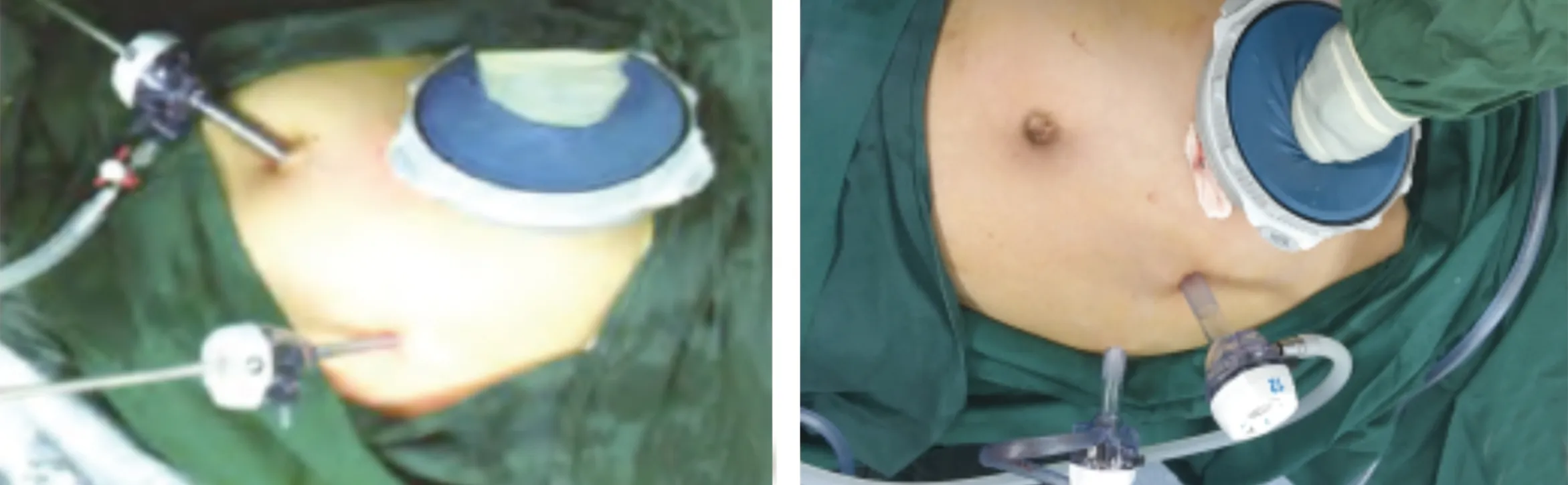
图1 手辅助装置及Trocar位置(a:明显偏瘦患者;b:一般患者)
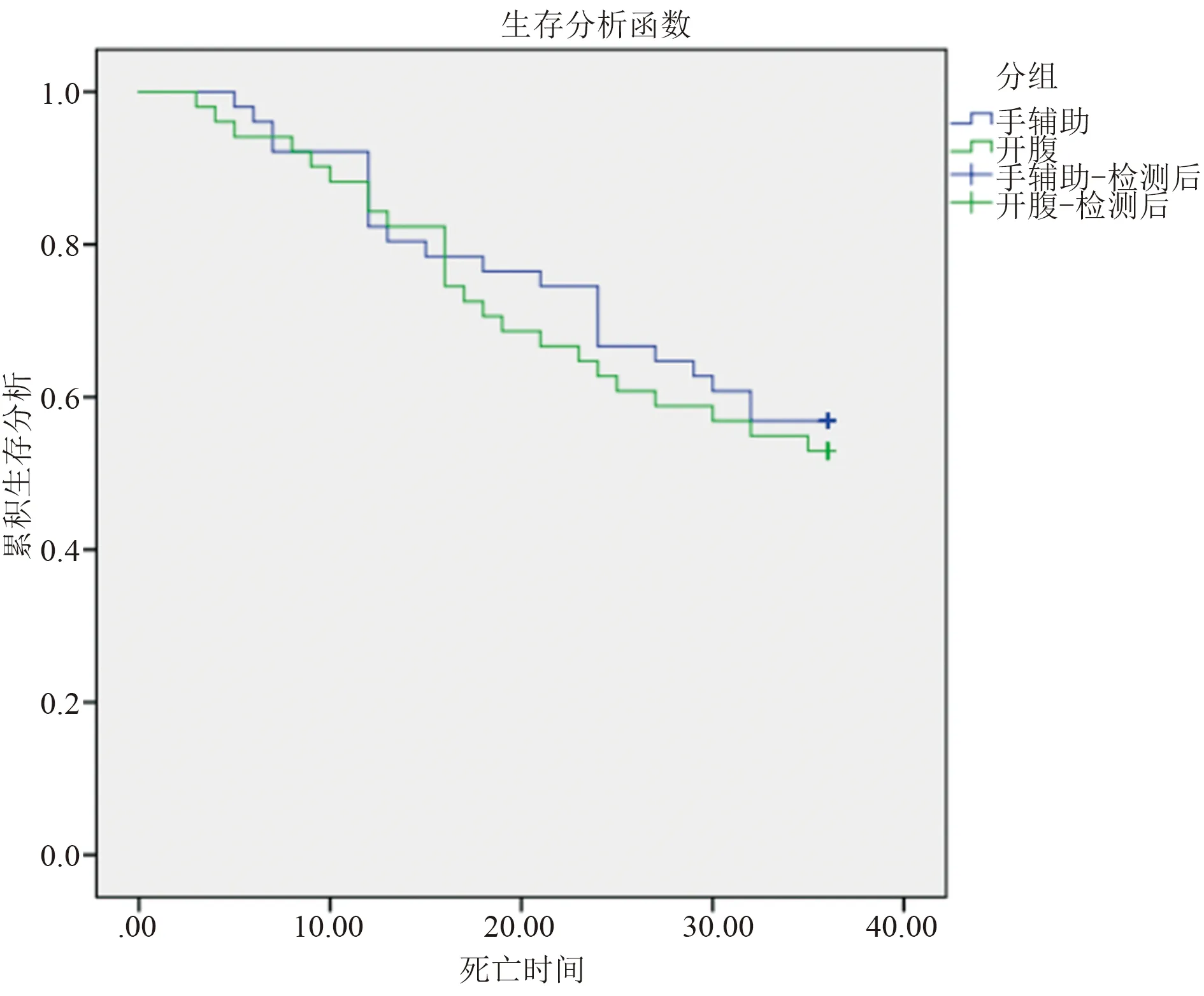
图2 两组患者的Kaplan-Meier生存曲线
3 讨 论
1999年Ohki等[7]采用经右下腹壁切口插入术者左手与腹壁悬吊的方法,成功完成1例手辅助腹腔镜胃癌远端胃切除术。2003年Usui等[8]报道了5例早期胃癌的手辅助腹腔镜全胃切除术。学者们认为,腹腔内辅助手在完成D2淋巴结清扫、荷包钳的置放、吻合器的使用等方面均具有意义,使广泛的淋巴结清扫、体腔内吻合变得更加可行、容易。正如Kim等[9]、Wong等[10]所述,因为更易于手眼协调,手辅助腹腔镜是外科医师增加腹腔镜手术经验的理想手段、发展全腹腔镜技术的桥梁。
本研究结果显示,手辅助组较开腹组可明显缩短腹部切口长度[(7.8±0.6)cm vs. (17.3±2.3)cm],HALS在剑突与脐之间做切口放置手辅助器,其长度与术者手部大小有关,而且此切口可用于标本取出、消化道重建。手辅助组术中出血量[(180.0±109.0)mL vs. (261.8±174.0)mL]少于开腹组,可能与术中超声刀的使用有关,Gong等[11]开腹手术时常规使用超声刀,发现手辅助组与开腹组在失血量方面差异无统计学意义。手辅助组术后肛门首次排气时间[(3.6±0.7)d vs. (5.3±1.8)d]、术后住院时间[(8.3±2.0)d vs. (12.3±7.3)d]均较开腹组缩短。一般认为,开腹切口较大,对腹膜、肠管造成的应激及直接损伤几率增加,可能造成术后切口感染率增加,肠管暴露于空气中的面积及时间多,可能导致术后肠功能恢复减慢[12]。两组手术时间、淋巴结清扫数量、术后并发症发生率差异均无统计学意义。恶性肿瘤的根治要求主要包括足够的手术切缘、淋巴结清扫范围与数量,HALS采用血管根部结扎切断、切除肿瘤两端足够距离的胃、十二指肠球部、食管及大网膜、横结肠系膜等并清扫周围淋巴结,并不改变传统开腹手术的方式,因此两者淋巴结清扫数量并无明显差异。手辅助组术后出现5例并发症,开腹组6例,均经积极对症保守治疗加支持治疗后痊愈出院,如服用益生菌使胃肠道功能恢复及促进排气,使用一段时间抗生素消除患者的肺部感染、腹腔感染,使用止血药物减少消化道出血等。并发症的发生从反面告诉我们,手术的精细、精确,术中减少出血、保留残胃的血供,不必要的创伤,手术前后的营养对症支持治疗,同样影响手术质量。本研究中,两组3年总生存率分别为56.86%与52.94%,差异无统计学意义。文献报道,手辅助腹腔镜胃癌根治术不仅具有腹腔镜辅助胃癌根治术相似的近期疗效及更好的安全性[13-15],而且其淋巴结清扫程度、肿瘤切除范围均能达到与开腹手术相当的水平,并具有创伤小、出血少、术后康复快等优点[16-18]。

组别性别(n)男女年龄(岁)TNM分期(n)Ⅰ期Ⅱ期ⅢA期ⅢB期ⅢC期手辅助组321957.6±12.3101212107开腹组341758.5±12.281511116t/χ2值0.172 0.3710.724 P值0.679 0.7110.948
续表1

组别 肿瘤分级(n) 低分化中分化高分化手术方式(n)全胃切除远端胃切除 术后化疗(n)手辅助组1930 2123920开腹组18321153618t/χ2值 0.4250.4530.168P值0.8090.5010.682
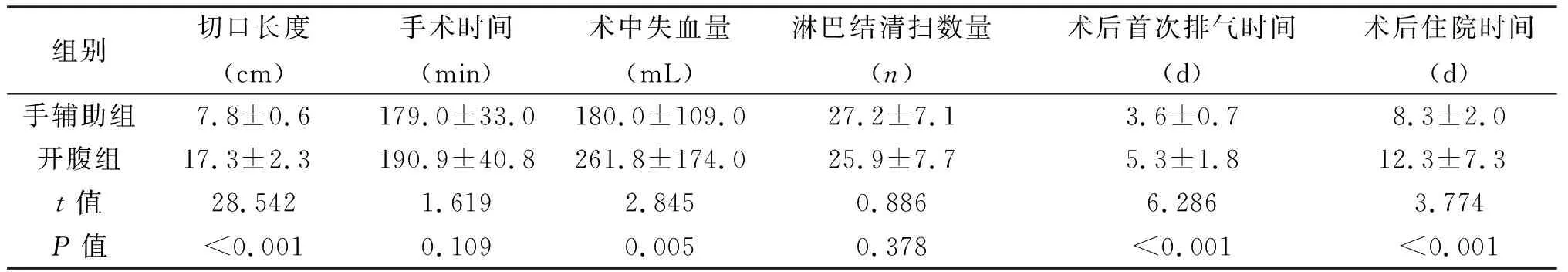
组别切口长度(cm)手术时间(min)术中失血量(mL)淋巴结清扫数量(n)术后首次排气时间(d)术后住院时间(d)手辅助组7.8±0.6179.0±33.0180.0±109.027.2±7.13.6±0.78.3±2.0开腹组17.3±2.3190.9±40.8261.8±174.025.9±7.75.3±1.812.3±7.3t值28.5421.6192.8450.8866.2863.774P值<0.0010.1090.0050.378<0.001<0.001
表3 两组患者术后并发症的比较[n(%)]

组别胃瘫胃排空延迟胃肠道功能紊乱腹腔感染肺部感染消化道出血总计手辅助组01(1.96)2(3.92)1(1.96)1(1.96)05(9.80)开腹组1(1.96)1(1.96)1(1.96)1(1.96)1(1.96)1(1.96)6(11.76)χ2值0.102P值0.750
行手辅助腹腔镜胃癌根治术的过程中,术者可根据患者的BMI灵活决定行开放或腹腔镜手术。对于BMI低的患者,腹腔镜下只需完成横结肠脾曲大网膜的切除及第4组淋巴结的清扫,可明显缩短手术时间。根治性全胃切除术的患者,采用反穿刺技术(图3),切断食管后将胃向右下方翻转牵拉,更利于第7、8、9、12组淋巴结的清扫。因左上腹空间较好,加之腹腔镜的放大效应,手辅助腹腔镜在行脾门淋巴结清扫时较开放手术更便利、省时(图4)。此外,在胃血管显露、贲门周围解剖等方面的优势也十分明显(图5),可有效降低手术操作难度。然而我们也认识到,手辅助腹腔镜行远端胃癌根治术在清扫第9组淋巴结时,还存在一定困难,可通过上腹部小切口先直视下切除肝胃韧带,打开右侧膈肌脚,再清扫第9组淋巴结,以充分发挥手辅助腹腔镜胃癌根治术开放与微创的优点。

图3 食管反穿刺
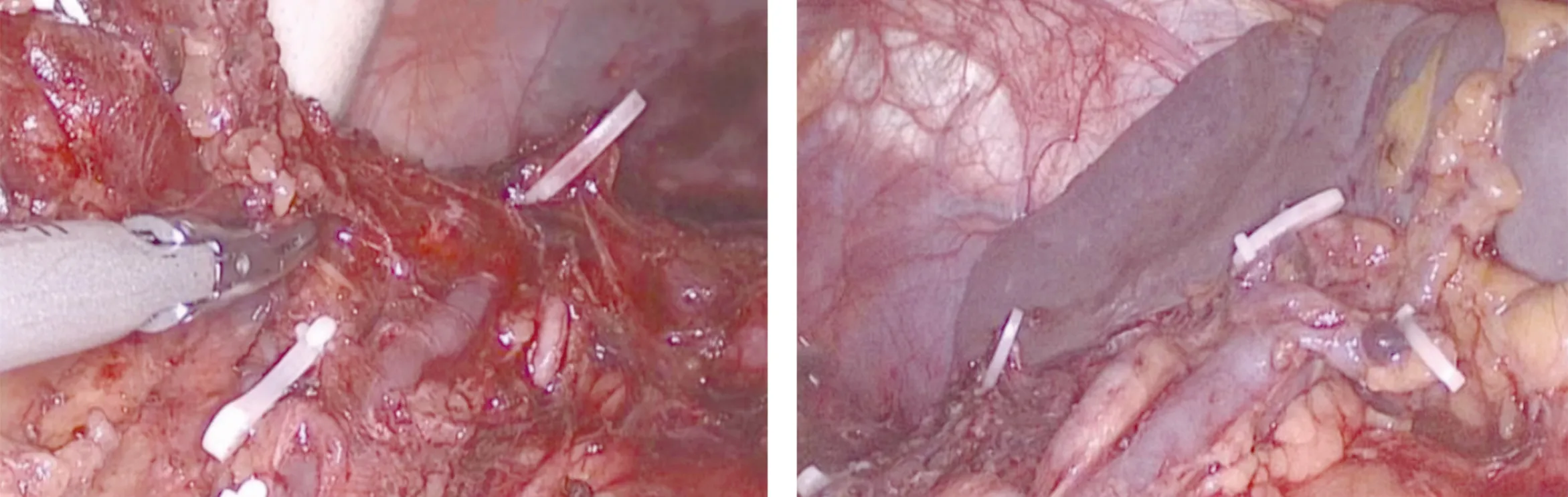
图4 脾门淋巴结清扫

图5 胃网膜左动脉、胃左动脉的裸化及离断
早期HALS技术因手辅助装置密封性差及手术切口过大,加之HALS往往被看作是开放手术向腹腔镜辅助手术的过渡术式,使得HALS发展不如腹腔镜辅助手术。且手辅助腹腔镜对胃癌根治术的应用文献目前相对较少,鲜有设计良好的随机对照研究,因此对于HALS与开腹手术、传统腹腔镜手术的优劣难以作出准确的循证学评价。但对比腹腔镜手术的难度大、学习曲线长,及传统开腹手术创伤大、术后康复慢的缺点,改良手辅助腹腔镜胃癌根治术值得临床推广。
