南瓜热激蛋白相关基因CmHSP70-5的 克隆和高温胁迫下的表达分析
2019-08-13胡艳平廖道龙朱白婢黄文枫云天海
胡艳平 周 扬 杨 春 廖道龙 朱白婢 王 敏 黄文枫 张 文 云天海*
(1 海南省农业科学院蔬菜研究所,海南省蔬菜生物学重点实验室,海南省瓜菜育种工程技术研究中心,海南海口571100;2 海南大学园艺学院,海南海口570228;3 海南省农业科学院,海南海口571100)
海南省具有得天独厚的生态优势和气候条件,蔬菜栽培由来已久,是我国最主要的南菜北运基地。随着人民生活和消费水平的不断提高,迫切要求各种蔬菜作物实现周年生产和供应。但蔬菜作物在生长发育过程中常常会受到各种非生物胁迫的影响,其中高温胁迫是影响其生长发育和产量的重要因子之一。蔬菜作物对于高温胁迫的响应并非完全是被动的,其体内会产生相应的适应机制来降低胁迫造成的危害(韩笑冰 等,1997;叶陈亮 等,1997),以维持基本的代谢过程,甚至通过开启某些基因或者酶的表达来缓解高温带来的危害(秦俊 等,2001;田婧和郭世荣,2012;闫圆圆 等,2016)。因此,通过研究蔬菜作物的耐热机理,可以有助于人们培育出耐高温的蔬菜新品种。
植物在进化过程中形成了许多应对高温逆境的机制,包括基础耐热性和获得耐热性。当植物受到高温胁迫时,一些基因被激活,从而导致一些代谢物和蛋白的含量增加,这些基因中有些可能会保护植物免受高温胁迫的伤害,有些可能会激活某些特定基因的表达从而增强植物的耐热性。目前已经克隆的与植物耐热性有关的基因主要分为热激蛋白(HSPs,heat shock proteins)、热激转录因子(HSFs,heat stress transcription factors)、与膜稳定性、抗氧化和激素相关的基因等。热激蛋白(HSPs)被认为是热胁迫诱导的一类蛋白,其中包括:HSP100、HSP90、HSP70、HSP60、HSP40 和 small HSP(sHSP)(方丽平和李进步,2007)。Katiyar-Agarwal 等(2003)将拟南芥的hsp101 基因导入水稻,发现转基因株系的耐热性有一定程度的提高且产量稳定。将玉米ZmHSP22 基因转化到拟南芥中,发现转基因株系生育期缩短,同时耐热性增强(Rhoads et al.,2005)。在拟南芥中过量表达菊花HSP70 基因可以增强植株对高温胁迫的耐受性(Song et al.,2014)。将番茄热激蛋白基因Lehsp100 反义敲除后,转反义链的株系和对照相比耐热性下降(Yang et al.,2006)。对海带Sjhsp70 基因在温度胁迫下的表达变化分析表明,高温对Sjhsp70 的表达量具有显著影响(袁艳敏 等,2018)。
南瓜起源于中、南美洲,包括30 个种,其中有5 个栽培种:中国南瓜(Cucurbita moschata)、美洲南瓜(C. pepo)、印度南瓜(C. maxima)、灰籽南瓜(C. mixta)以及黑籽南瓜(C. f icifolia)。不同南瓜品种的耐热性差异较大,不耐热品种在高温季节及温室栽培下容易受到高温伤害。一般认为,中国南瓜广泛种植于热带和亚热带地区,生长发育的适宜温度一般为18~32 ℃,具有较好的高温适应性,但温度超过35 ℃时,雄花易变为两性花。海南地处热带边缘,夏季太阳辐射强,平均气温在25 ℃以上,极端最高气温超过38 ℃,高温严重制约着海南南瓜产业的发展。因此,开展南瓜对高温胁迫的机理研究,对于筛选培育出耐热的南瓜品种,丰富海南南瓜品种资源具有深远意义。本试验基于南瓜基因组的数据,从南瓜中分离1 个热激蛋白相关基因CmHSP70-5,对其在高温胁迫下的表达进行分析研究,以期为深入探讨南瓜耐热机理提供理论指导。
1 材料与方法
1.1 试验材料及处理
于2018 年11 月选用海南地区广泛种植的蜜本南瓜(Cucurbita moschata),将种子播种在装满基质(泥炭土∶蛭石=1 V∶1 V)的花盆中,放置在培养箱中生长,待长出3 片真叶后,进行37 ℃和42 ℃持续高温处理,分别在高温处理后0、3、6、12、24、48 h 取南瓜幼苗的根、茎、叶,用超纯水清洗,然后用液氮速冻后立即放入-80 ℃保存以备提取RNA。整个试验均在海南省瓜菜育种工程技术研究中心完成。
1.2 RNA 提取及反转录
采用天根生化科技(北京)有限公司的RNA提取试剂盒(RNAprep Pure Plant Kit,目录号:DP441)提取南瓜幼苗的RNA,采用宝生物工程(大连)有限公司的反转录试剂盒〔PrimeScript RT reagent kit with gDNA Eraser(Perfect Real Time),目录号:DRR047A〕进行反转录,具体操作步骤参照说明书。
1.3 基因克隆
从南瓜基因组数据库(https://www.ncbi.nlm.nih.gov/genome/?term=Cucurbita+moschata) 中 获得CmHSP70-5 基 因 的 序 列, 用Primer Premier 5.0 软件设计引物,引物序列为HSP70-5-F:5′-ATGGCAGCGAAAACTGAAG-3′,HSP70-5-R: 5′-TCAATCAACCTCCTCGATCTTC-3′。以 南 瓜cDNA 为模板,采用Vazyme 公司的2×Taq Master Mix(目录号:P112)扩增,扩增产物经纯化后连接到pEASY-T1(北京全式金生物技术有限公司,目录号:CT101-01)载体上,挑取阳性克隆送往上海生工生物工程有限公司测序。
1.4 实时荧光定量PCR
用Primer Premier 5.0 软 件 设 计 南 瓜CmHSP70-5 基因的荧光定量引物,内标基因选用文献报道中的Actin 基因(王安君 等,2016)。 引物由上海生工生物工程有限公司 合 成, 引 物 序 列 为:CmHSP70-qRT-F:5′-CGTTGCTTATGGTGCTGCTGT-3′,CmHSP70-qRT-R:5′-CTGTTCTTTCTTTGTTGGGATTGTT-3′;CmActin-F:5′-CGGCCATTGAGAAAAGCTACGAA CT-3′,CmActin-R:5′-CCCACCACTGAGGACGAT GTTACCA-3′。用未经高温处理的根、茎、叶反转录得到的cDNA 为模板进行荧光定量PCR,研究CmHSP70-5 基因在不同组织中的表达差异;以高温处理后不同时间的根、茎、叶cDNA 为模板进行荧光定量PCR,研究CmHSP70-5 基因在高温胁迫下的表达模式。荧光定量PCR 采用TaKaRa 公司SYBR Premix Ex Taq II(Tli RNaseH Plus)试剂盒(目录号:DRR820A),在ABI 7900HT Fast Real-Time PCR System 仪器上运行,Real-Time PCR 反应体系参照说明书进行。实时荧光定量PCR 反应条件:95 ℃预变性30 s;94 ℃变性5 s,60 ℃退火延伸30 s,45 个循环;结束后读取荧光信号:95 ℃ 15 s,60 ℃ 15 s,95 ℃ 15 s,进行熔解曲线分析。
采用比较CT 法来计算目的基因的相对表达量,目的基因的相对表达量=2-△△Ct,其中△△Ct=(Ct目的基因-Ct内标基因)实验组-(Ct目的基因-Ct内标基因)对照。试验结果设3 个重复,取平均值进行作图分析。
2 结果与分析
2.1 南瓜幼苗RNA 提取及反转录
将南瓜幼苗经过37 ℃和42 ℃高温处理,分别在0、3、6、12、24、48 h 取其根、茎和叶片,用RNA 提取试剂盒提取各样品的总RNA,经1.5%琼脂糖凝胶电泳检测发现RNA 质量较好,28S 和18S 较完整,且量较大(图1)。按照说明书的操作方法取适量的样品进行反转录,得到的cDNA 用南瓜内标基因Actin 进行PCR 检测,从图2 中可以看出,内标基因的扩增产物条带单一,无杂带,且亮度基本一致,说明cDNA 质量较好,可以进行后续试验。
图1 42 ℃高温处理下根中的RNA

图2 42 ℃处理下根中的cDNA 扩增产物
2.2 CmHSP70-5 基因克隆
从南瓜基因组数据库中获得CmHSP70-5基因(XM_023065965)的序列,将反转录的cDNA 混合作为模板,设计基因全长引物,扩增CmHSP70-5 基因,产物经琼脂糖凝胶电泳检测,得到大小约为2 000 bp 的片段(图3),将PCR 产物连接到T 载体后,筛选阳性克隆送往上海生工生物工程有限公司测序,确定CmHSP70-5 基因全长1 953 bp,测序结果与南瓜基因组数据库中查到的序列完全符合,说明目的基因扩增正确。
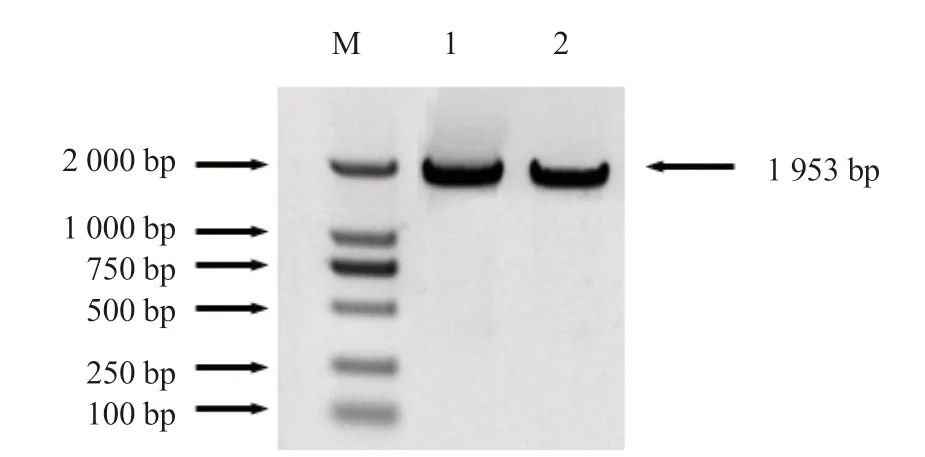
图3 CmHSP70-5 基因的克隆
利用MEGA7.0 软件将CmHSP70-5 基因编码的氨基酸序列与拟南芥HSP70 蛋白家族成员进行进化关系分析,发现CmHSP70-5 蛋白与拟南芥AtHSP70-5 的亲缘关系更近(图4)。
2.3 CmHSP70-5 基因在不同组织中的表达分析
提取未经高温处理的南瓜幼苗根、茎和叶中的总RNA,采用荧光定量PCR 的方法研究这3 个组织中CmHSP70-5 基因的表达量。结果发现,CmHSP70-5 基因在根中表达量最高,叶片中的表达量次之,约为根中表达量的42%;茎中表达量最少,约为根中表达量的11%(图5)。
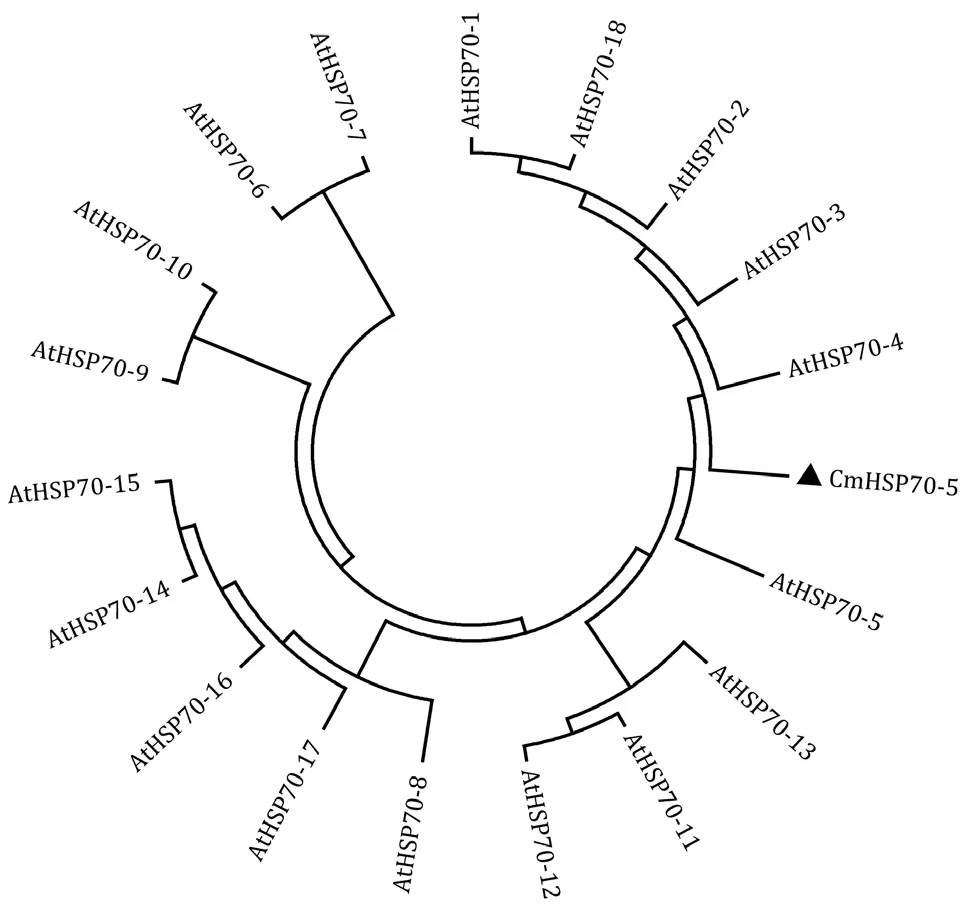
图4 CmHSP70-5 与拟南芥HSP70 家族蛋白的进化分析
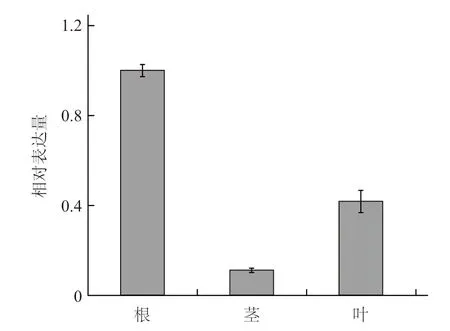
图5 CmHSP70-5 基因在南瓜幼苗不同组织中的表达
2.4 不同温度胁迫下CmHSP70-5 基因在不同组织中的表达分析
2.4.1 不同温度胁迫下根中CmHSP70-5 基因的表达模式分析 根中CmHSP70-5 基因在高温胁迫下上调表达,处理后3 h 表达量达到最高,37 ℃处理3 h 后的表达量约为起始表达量的10 倍,42 ℃处理3 h 后的表达量约为起始表达量的16 倍,此后表达量降低,逐渐恢复到起始水平(图6)。
2.4.2 不同温度胁迫下茎中CmHSP70-5 基因的表达模式分析 虽然茎中CmHSP70-5 基因的起始表达量较低(图7),但在高温处理后,茎中CmHSP70-5 基因受高温诱导上调表达,从图7 中可以看出,处理3 h 后基因的表达量达到最大,且在高温处理后0~24 h 内42 ℃处理的CmHSP70-5基因表达量要高于37 ℃同时期的基因表 达量。
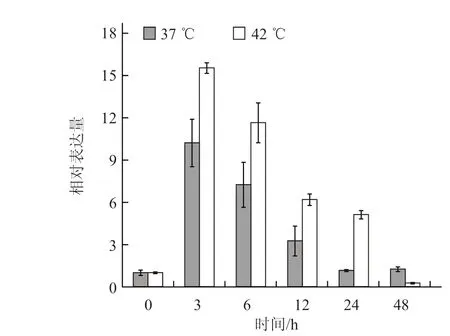
图6 根中CmHSP70-5 基因在不同温度胁迫下的表达

图7 茎中CmHSP70-5 基因在不同温度胁迫下的表达
2.4.3 不同温度胁迫下叶中CmHSP70-5 基因的表达模式分析 与茎中基因表达量相似,叶片中CmHSP70-5 基因在高温处理3 h 后的表达量达最高,分别为起始表达量的1 800 倍(37 ℃)和2 860 倍(42 ℃)(图8),说明叶片中CmHSP70-5基因的表达是一种高温诱导模式。
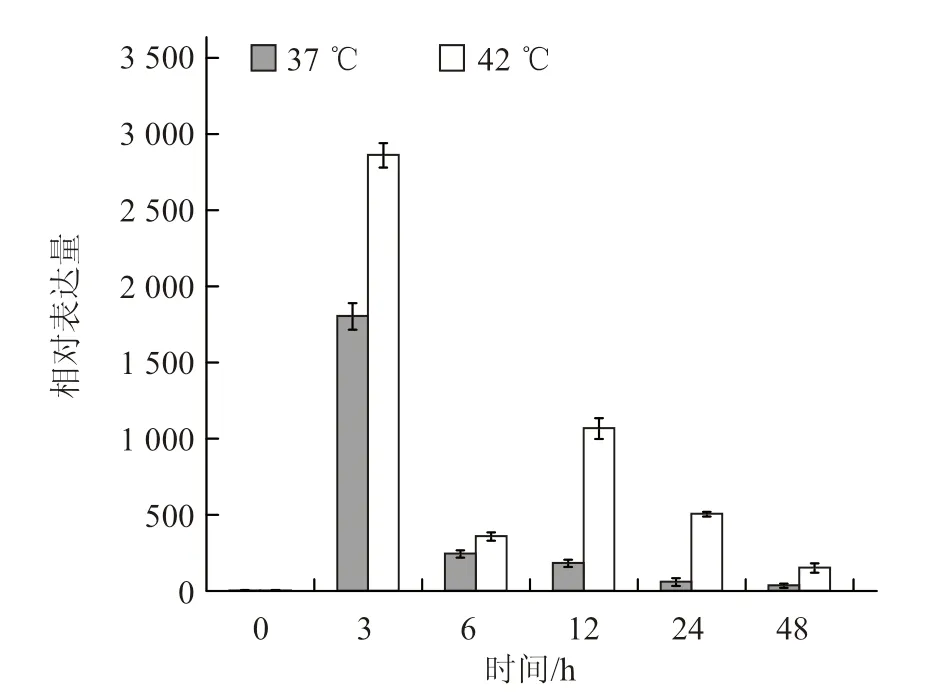
图8 叶中CmHSP70-5 基因在不同温度胁迫下的表达
3 结论与讨论
植物生长过程中,高温是影响其生长发育的一种重要非生物胁迫,而且温室效应导致全球气温升高,园艺植物生产面临着严峻挑战(范双喜 等,2003)。因此研究植物耐热性,培育耐热植物新品种已经成为一项亟待解决的工作。植物的耐热性是一个复杂的生理现象,是一个由多基因控制的数量性状,包括热激蛋白HSPs、热激转录因子HSFs、抗氧化和激素相关基因等。在高温胁迫下,植物细胞中会表达和积累大量的HSPs,从而避免或减轻植物受到热损伤,HSPs 的积累量是由HSFs 控制的,并在植物热激反应中发挥重要作用(Wang et al.,2004)。在所有的HSPs 中,HSP70家族蛋白是生物体内分布最广和研究最多的一类。研究发现,HSP70 在植物生长发育和各类植物胁迫响应中至关重要(Sung et al.,2001;Swindell et al.,2007;Cho & Choi,2009;Zou et al.,2012;Kim et al.,2014)。拟南芥HSP70-1 定位于细胞质和细胞核中,与植物的耐热性相关(Sung et al.,2001;Cazale et al.,2009);缺 失HSP70-15 基 因的拟南芥突变体植株矮小、耐热性下降(Jungkunz et al.,2011);高粱HSP70 蛋白参与了其雄性不育系在不同温度下的育性转换(Chen et al.,1998);叶用莴苣LsHsp70-2711 属于Hsp70 基因家族,与叶用莴苣耐热性相关(李雅博 等,2017);蜡梅HSP70-1 基因在42 ℃高温处理后1 h 表达量达到最高,说明其参与了高温胁迫响应过程(阮文进, 2015)。
本试验从南瓜中克隆到1 个HSP70 基因,系统进化树分析发现其编码的蛋白与拟南芥AtHSP70-5 蛋白的亲缘关系较近,因此命名为CmHSP70-5。CmHSP70-5 基因在南瓜幼苗的各部位均有表达,运用荧光定量PCR 技术研究发现,CmHSP70-5 基因的表达受到高温胁迫诱导,在一段时间内,温度越高,表达量越高,这与其他植物中HSP70 基因的表达模式相似(Sung et al.,2001;Jungkunz et al.,2011;陈二龙 等,2018)。本试验结果对开展南瓜耐热机制研究以及耐热南瓜的选育有积极意义。
