优先离断直肠在低位直肠癌中的应用研究
2019-08-12张慧嫦李君久熊秋华黎东伟
张慧嫦 李君久 熊秋华 黎东伟
广东省东莞东华医院普外科,广东东莞 523110
在临床中结肠癌是常见且多发的一种疾病,属于恶性肿瘤的范围[1],大部分直肠癌患者属于中低位直肠癌[2]。辅助化疗等治疗手段虽然提高了保肛的几率,但是治疗直肠癌仍以手术为主[3]。低位直肠癌主要是指位于肛管直肠环至腹膜反折平面,距离肛缘7 ~8cm 下,属于恶性肿瘤的范围,伴随着人们生活水平的提升,人们对术后生活质量也有了更高的要求,因此低位直肠癌保肛手术逐渐在临床兴起,且被认可[4]。手术一般先进行腹部手术再进行会阴部手术。病变直肠优先处理具有极大的优势。现回顾性分析2015 年1月~2016 年11 月接受腹腔镜腹会阴联合直肠癌根治术32 例患者的临床资料,根据病变直肠的先后处理分为改良手术组和对照手术组,现报道如下。
1 资料与方法
1.1 一般资料
选择2013 年1 月~2016 年11 月同一手术主刀医生的腹腔镜腹会阴联合切除术的低位直肠癌患者32 例。根据对病变直肠处理的先后顺序分给对照组和改良组。其中对照组16 例,改良组16例。对照组男10 例、女6 例;年龄39 ~65 岁,平均(52.7±7.1)岁。改良组男11 例、女5 例。年龄37 ~67 岁,平均(52.6±8.7)岁。两组患者一般资料比较,差异均无统计学意义(P >0.05)。具有可比性。
1.2 手术方式
术前准备同常规腹腔镜直肠癌手术,麻醉采用气管插管全麻。
1.2.1 改良组 在麻醉药物起效后采取俯卧折刀位,常规消毒铺巾,暴露出会阴,肛门闭锁时采用7号丝线。将肛门作为中线,切口在尾骨尖直至会阴中点部且两侧至坐骨结节内侧缘侧,切口形状为梭形。将肛周附近的脂肪组织去除掉,在没有受到肿瘤侵犯时不需要将尾骨去除,将两侧肛提肌切断,自盆筋膜脏层至Denonvilliers 筋膜层锐性剥离全直肠系膜,在直视的状态下将两侧韧带切除,剥离至直肠腹膜返折下方(男性以精囊腺上方、女性以阴道后穹窿上方为界),见图1。经会阴将直肠拖出,直线切割闭合器于腹膜返折下方切断、闭合肠管,病变直肠离体,见图2。在没有出血时采用碘伏与蒸馏水对创面进行清洗,清创完成后放置骶前引流管自会阴部引出并固定。缝合切口,见图3。患者采取仰卧位并将双腿分开,对铺巾进行消毒,在脐上部位将穿刺鞘置入其中,然后建立气腹,将气腹压力维持在12mm Hg 气腹。利用腹腔镜进行探查。在腹腔镜下将三个穿刺鞘置入,同时将抓钳和各种操作器械置入。左侧腹壁穿刺孔位置作为术前选取的造瘘口位置。对乙状结肠系膜进行游离,离断肠系膜下动脉根部后对其外侧离断肠系膜下静脉,同时在下方对输尿管与生殖血管进行游离,从而进入Toldt 间隙。将乙状结肠、直肠,与会阴组会师进行游离,见图4,将肠管残端提出骨盆后利用蒸馏水对盆腔进行彻底的冲洗,见图5,在盆底没有活动性出血的症状之后,对盆底腹膜进行缝合,缝合时采用3-0 可吸收线。在左下腹穿刺孔部位做切口,切口的大小约3cm,在逐层进入腹膜之前,先在腹壁部位作一条隧道进入腹腔中,将直肠断端提出,在确定造口外露肠管长度后利用3-0 可吸收线间断缝合腹膜及乙状结肠浆肌层,逐层将乙状结肠间断缝合固定于腹直肌前鞘、皮下组织、皮肤,一期开放造口。
1.2.2 对照组 麻醉成功后患者取仰卧截石位,对铺巾进行消毒后在脐上部位将穿刺鞘(10mm)置入其中,同时建立气腹,将气腹压力维持在12mmHg。将腹腔镜进行探查。利用腹腔镜将三个穿刺鞘置入,然后将抓钳与各操作器械置入。在下腹穿刺鞘的部位作为术前选好的造瘘口。将乙状结肠系膜提起,然后利用超声刀离断肠系膜下动脉根部,然后在其外侧对肠系膜下静脉进行离断,同时对输尿管及生殖血管进行游离,然后进入Toldt 间隙。对乙状结肠、直肠至肛提肌平面进行游离。常规消毒阴部,缝合肛门闭锁,使用的是7 号丝线,将肛门作为中心,切口位于尾骨尖直至会阴中点部且两侧至坐骨结节内侧缘部位,切口的形状为梭形。清除肛周脂肪组织,在没有肿瘤侵犯不必去除尾骨,切断两侧肛提肌,自盆筋膜脏层至Denonvilliers 筋膜层锐性剥离全直肠系膜,与腹腔组会师。用保护套套扎远端肠管及肿瘤后回纳腹腔内。蒸馏水冲洗盆腔及会阴部,确定无活动性出血后,放置骶前引流管从会阴部引出、固定,用3-0 可吸收线连续缝合盆底腹膜。逐层关闭会阴部切口。与改良组手术同法开放一期造口。
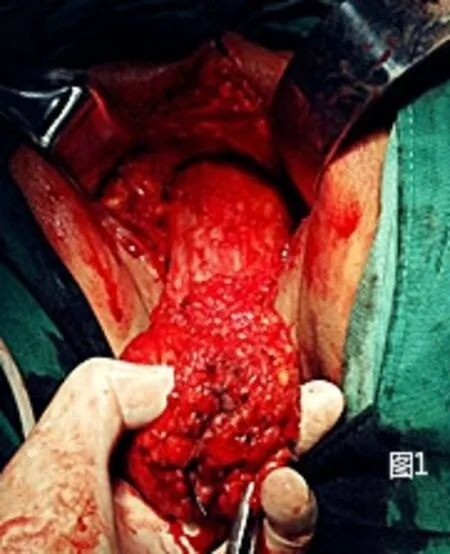
图1 折刀位下游离直肠下段和肛管
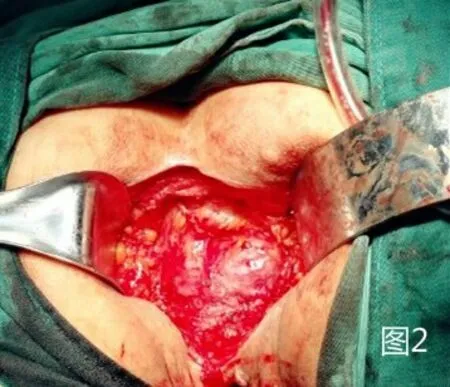
图2 于腹膜返折下方离断直肠
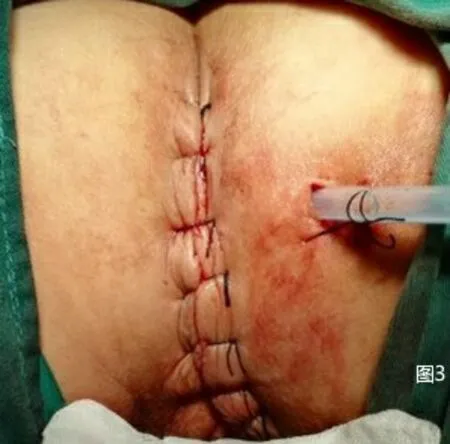
图3 放置骶前引流管和缝合会阴部
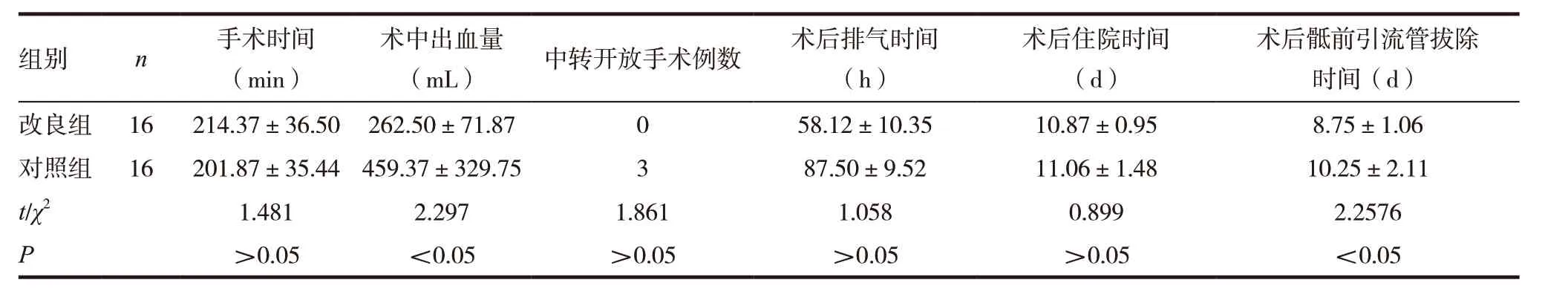
表1 两组患者术中、术后情况分析比较

表2 改良组与对照组术后并发症分析比较
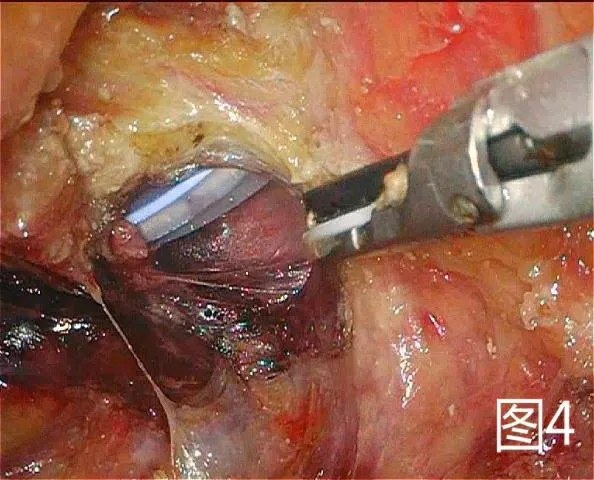
图4 游离直肠与会阴组会师
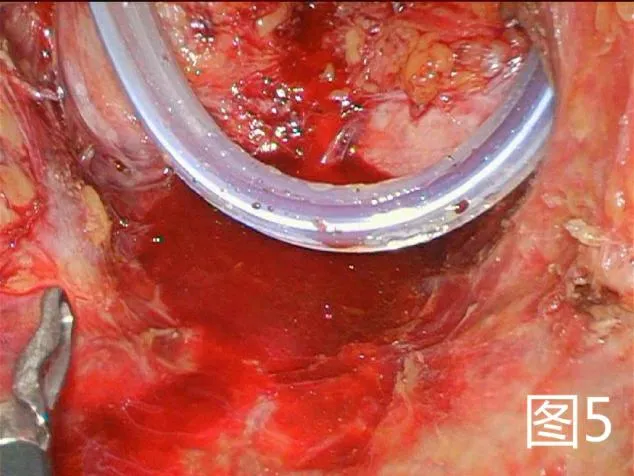
图5 检查盆底情况
1.3 观察指标
比较分析两组患者手术时间、出血量、中转开腹手术率、排气时间、术后住院时间、会阴部切口感染、局部复发率的差异。
1.4 统计学处理
所有数据经SPSS19.0 统计软件进行研究,计量资料以()表示,采用t 检验,计数资料以百分数表示,采用χ2检验,P <0.05 为差异有统计学意义。
2 结果
2.1 两组患者术中、术后情况比较
两组患者手术时间内、中转开放手术例数、术后排气时间、术后住院时间比较,差异无统计学意义(P >0.05);改良组患者术中出血量与术后骶前引流管拔除时间具比对照组患者少,差异有统计学意义(P <0.05)。见表1。
2.2 两组患者术后并发症比较
两组患者勃起功能障碍、局部复发发生例数比较,差异无统计学意义(P >0.05);改良组患者尿潴留、会阴部切口感染发生例数低于对照组患者,差异有统计学意义(P <0.05)。见表2。
2.3 两组患者随访结果比较
术后随访6 个月~5 年,未出现失访的现象,且无死亡病例。
3 讨论
腹会阴联合直肠癌根治术具有创伤大的特点,因此术后极易发生性功能障碍与排尿功能障碍,另外永久性的伤口更是威胁着患者的生活质量,可造成精神心理负担[5]。目前腹部手术组方式已逐渐规范[6],然而在会阴手术组中仍有一些问题,如暴露困难等,在进行手术的过程中极易出现直肠穿孔、出血、切口感染等并发症,不利于术后的康复[7]。因此,如何促进术后恢复、减少术中出血和术后并发症具有重要意义。既往腹腔镜直肠癌根治术多采取先游离乙状结肠和直肠。此方法对于中高位直肠癌等情况是安全可行的,但对于进展期低位直肠癌,常由于肿瘤可能侵犯临近脏器而导致游离困难或骶前难以控制的出血而需中转开腹。此报道改良了手术步骤及方式,主要特点为:(1)手术顺序不同:手术先行离断直肠和移除肿瘤[8];(2)体位不同:折刀位行会阴部手术暴露良好;(3)切除范围不同:改良组要求切除提肛肌[9-10]。
鲍杨等[11]提出折刀位下处理会阴组手术,可改善暴露不良的问题,减少术中出血和神经、邻近器官损伤等并发症。此报道先从会阴组直视下处理,减少手术的难度和缩短手术时间。本文研究组手术出血量明显少于对照组,分析其原因主要是由于在折刀位下直视下游离直肠至精囊腺/阴道后穹隆上方,可减少损伤和出血。其次,术中先切断、移除肿瘤及病变肠管,对肿瘤不会产生任何不良影响,因不需要进行反复的牵拉,更是防止了肿瘤出现转移的现象。会阴组手术方式具有一定的污染性,需要对直肠至腹膜反折下方进行游离,所以不能与腹腔相通,在移除直肠后会阴部空间相对较大,止血更确切[12];缝合会阴部前大量碘伏水及蒸馏水冲洗,能减少腹腔感染机会;在腹膜返折下方切除下段直肠,亦可减少术中把直肠拖拽进入腹腔后导致腹腔感染的因素[13];在对会阴进行关闭之前将直肠切断,使操作变得更简单,缝合的也比较彻底,降低了发生不良反应,故会阴部感染率低[14]。研究中两组患者勃起功能障碍、局部复发发生例数比较无明显差异,但是改良组患者尿潴留、会阴部切口感染发生例数低于对照组患者,便进一步证实了改良后手术方式是明显优于会阴组手术方式,减少了污染性,降低尿潴留、会阴部切口感染发生率。再者,使用病变直肠优先处理的方法可以减少中转开放手术,因折刀位下游离直肠后壁可减少骶前静脉丛的损伤所致不可控制的出血。虽然报道中改良组和对照组的手术时间无明显差异,主要考虑为反复改变体位所致,但整体操作时间是明显缩短的。由研究证实,改良后的手术方式具有操作简单、安全性高等优势[15],更利于患者术后的康复,此外通过长达5 年的随访证实,未出现死亡的案例,说明治疗效果的质量有很大的保障。
综上所述,优先离断直肠在腹腔镜腹会阴联合直肠癌根治术中有明显的优势,可降低手术难度、减少出血、减少术后骶前引流管留置时间和切口感染率。值得注意的是此次研究选取的例数有限,因此受到一定的限制,需要长期随访。
