弓形虫RH株ROP16I/III基因缺陷虫株感染BALB/c鼠的致病性研究
2019-08-08
刚地弓形虫(T.gondii)是一种专性有核细胞内寄生的原虫,其存在广泛的中间宿主群,包括人类。猫科动物为其终宿主。全球已经有30%的人口被弓形虫感染,欧美部分国家甚至高达40%[2],我国某些地区人群血清学阳性率约7%[3]。此外,弓形虫病给畜牧业生产带来巨大的损失。弓形虫感染多为隐性感染期,免疫力正常的感染者无临床表现,或呈轻度一过性临床症状。但是免疫功能低下的感染者,可出现严重症状,例如弓形虫脑炎、肺炎、脉络膜视网膜炎等,甚至致死[4]。已知弓形虫棒状体分泌的可溶性蛋白(ROP)参与虫体侵袭、增殖、播散及免疫逃逸等。ROP在不同的基因型虫株具有多态性。I型和III型弓形虫的具有激酶活性的ROP16I/III可磷酸化State 3/6,早期感染驱动巨噬细胞向M2极化,可使虫体在宿主细胞内大量繁殖,易导致虫体在全身播散甚至致宿主死亡[5]。研究表明,我国的弓形虫的优势基因型为Chinese 1,WH3株和WH6株是毒力截然不同的二个虫株,感染Chinese 1 型WH3株的ROP16缺陷株可以活化Th1和Th17细胞,颠覆母-胎界面以Th2优势应答为主的免疫偏移,引起滋养层细胞凋亡,可导致不良妊娠[6]。研究发现,I型ROP16基因敲除株导致弓形虫在巨噬细胞内的增殖速度高于野生株,但是感染小鼠的死亡率并没有降低,提示ROP16并非是早期致死小鼠的关键毒力因子[7]。本课题组前期利用CRISPR-Cas9 技术,成功获得稳转RH株ROP16I/III基因缺陷虫株[7]。在此基础上,本研究将体外培养的ROP16I/III基因缺陷虫株腹腔接种BALB/c小鼠,动态观察感染小鼠的急性期临床发病、脑等组织切片病理及检测脾细胞炎性因子水平,旨在深入研究效应分子ROP16I/III在急性期致病中的作用。
1 材料与方法
1.1 材 料
1.1.1弓形虫type I型RH株及RHΔROP16株 由本实验室传代保存,复苏后腹腔接种小鼠。
1.1.2实验动物 雌性6~8周龄SPF级BALB/c小鼠(20~25 g),由济南朋悦实验动物繁育有限公司提供。
1.1.3实验试剂 诺唯赞 SYBR Green Master Mix荧光定量试剂盒、 Hi Script ‖QRT Super Mix for q PCR均购于合肥飒英斯生物公司。氯仿、异丙醇、无水乙醇、4%多聚甲醛均购于安徽欣乐生物有限公司。
1.2 实验方法
1.2.1BALB/c小鼠速殖子接种 分别收集RH野生型和RHΔROP16速殖子,显微镜下计数并稀释至1 000个/mL,每组20只小鼠,每只腹腔注射400 μL,观察并记录小鼠出现竖毛、弓背、腹水及活动迟缓的先后顺序及死亡时间。分别在感染后3 d、5 d和7 d,麻醉状态下,剖杀小鼠取脾脏组织,-80 ℃冰箱保存、备用。
1.2.2脑组织和肺组织HE染色 分别于感染后3 d、5 d和7 d,每组随机取5只小鼠,无痛麻醉下眼球取血后脱颈处死,分别取脑组织和肺组织,置4%多聚甲醛固定24 h后,石蜡包埋,3 μm切片。切片置于65 ℃烤箱过夜,次日置于二甲苯脱蜡、梯度酒精脱水,置于苏木精染液3 min,1%盐酸乙醇分化后水洗,梯度酒精脱水,二甲苯透明,中性树胶封片。
1.2.3脾组织总RNA提取 从-80 ℃冰箱取出脾组织,用剪刀剪碎后加入 300 μL Trizol用匀浆机硏磨后再加入700 μL Trizol,提取RNA并测定浓度及纯度。按照Hi Script QRT Super Mix for qPCR说明书逆转录为cDNA备用。
1.2.4细胞因子引物的设计 根据GenBank中Arg-1、IL-10、IL-12p40、IFN-γ和TNF-α的序列,用Premier 3设计引物,上海生工生物工程有限公司合成。
Target Primer sequence(5′-3′)
Arg-1 F: CAGAAGAATGGAAGAGTCAG
R: CAGATATGCAGGGAGTCACC
IFN-γ F: GGTCAACAACCCACAGGTCC
R: CGACTCCTTTTCCGCTTCC
IL-10 F: GCTCCTAGAGCTGCGGACT
R: TGTTGTCCAGCTGGTCCTTT
TNF-α F: ACGGCATGGATCTCAAAGAC
R: GTGGGTGAGGAGCACGTAGT
IL-12 F: GATGTCACCTGCCCAACTG
R: TGGTTTGATGATGTCCCTGA
GAPDH F: CAACTTTGGCATTGTGGAAGG
R: ACACATTGGGGGTAGGAACAC
1.2.5细胞因子测定 按照SYBR Green Master Mix荧光定量试剂盒说明书20 μL体系,利用罗氏LC96 SW 1.1相对定量检测脾脏细胞因子变化。
1.3野生型RH和RHΔrop16株在小鼠体内增殖测定
取6只8周雌性小鼠,每组3只,分别腹腔注射1 200个虫株,于第5 d无痛脱颈处死,腹腔灌洗计数虫株数量。
1.4统计学处理 实验数据用Graph Pad Prism 6.02软件进行统计分析,采用t检验方法分析,检验水平为α=0.05。
2 结 果
2.1野生型RH株和RHΔrop16感染小鼠临床表现 通过腹腔注射相同数量的速殖子建立RHΔrop16和野生型感染鼠模型,动态观察二组鼠于感染3 d、5 d、6 d、7 d、8 d小鼠发病(见表1)。
表1 RHΔrop16小鼠和RH小鼠弓形虫病症状
Tab.1 Mice infected with wild-type RH strain and RHΔrop16strain checked for clinical signs of toxoplasmosis

Group(n=3)Daysafterinjectionoftachyzoites3d5d6d7d8dcontrolNoobvioussymptomsNoobvioussymptomsNoobvioussymptomsNoobvioussymptomsNoobvioussymptomsRHNoobvioussymptomskyphosis,piloerec-tion,asmallamountofasciteskyphosis,piloerec-tion,scites,deathkyphosis,piloerec-tion,scites,deathAlldeathΔROP16Noobvioussymptomskyphosis,piloerec-tion,asmallamountofasciteskyphosis,piloerec-tion,asmallamountofasciteskyphosis,piloerec-tion,scites,deathAlldeath
2.2RHΔrop16和野生型RH株感染小鼠存活率 两组动物存活率无差异。 野生型RH感染组第6 d开始出现死亡,RHΔROP16感染组小鼠第7 d开始出现死亡,但两组均在第8 d死亡,统计学分析两组小鼠存活率之间无统计学差异(P>0.05)(见图1)。
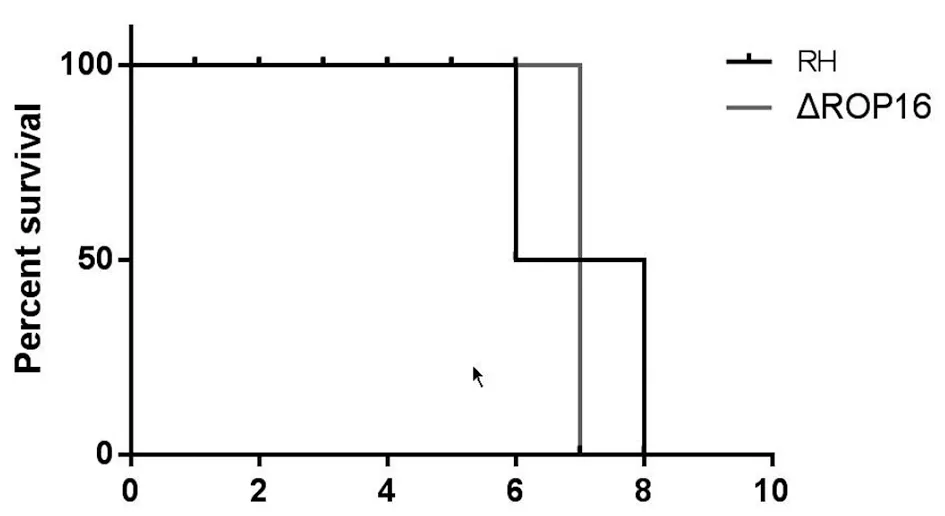
图1 感染野生型RH虫株和RHΔrop16虫株小鼠的存活率无统计学差异(P>0.05)Fig.1 Survival curve of mice infected wild-type RH strains and RHΔrop16 strains(P>0.05)
2.3野生型RH株和RHΔrop16感染小鼠组织病理检查
2.3.1肺组织切片HE染色显示感染后3 d可见炎性细胞广泛浸润、间质细胞轻度增生,部分肺泡内可见淤血。感染后第5 d可见广泛炎性细胞浸润、肺毛细血管充血明显,肺间质细胞明显增生、肺泡壁增厚,部分肺泡腔闭塞,重度肺水肿、肺泡间隔破裂,感染7 d肺严重淤血、水肿,两者未见明显差异(见图2)。
2.3.2脑组织切片HE染色显示两组小鼠感染后3 d脑间质均表现轻度疏松、水肿;随着感染时间的延长,脑组织间质疏松、水肿渐趋严重,可见胶质细胞变性及坏死。感染后第7 d,野生型RH感染小鼠脑组织局部可见大量小细胞增生浸润(见图3),而同期RHΔrop16感染小鼠未见异常增生,感染野生虫株的宿主脑组织病变更严重。
2.4野生型RH株和RHΔrop16在小鼠体内增殖RHΔrop16和野生型RH株在小鼠体内增殖无统计学差异(t=2.449,P>0.05)(见图4)。
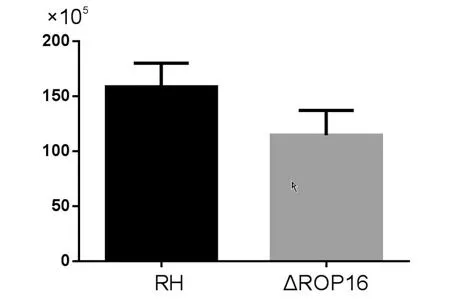
图4 野生型和ROP16缺陷型虫株在小鼠体内增殖无统计学差异(P>0.05)Fig.4 Tachyzoite proliferation rate in penitoneal cavity of mice infected with wild-type RH strain and RHΔrop16 strain in vivo(P>0.05)
2.5野生型RH株和RHΔrop16感染小鼠脾脏Arg-1、IL-10、IL-12和TNF-α mRNA表达 为研究ROP16I/III基因缺陷虫株感染宿主体内炎性免疫应答的特征,qRT-PCR检测脾细胞炎性因子及抑炎因子水平。结果表明, RHΔrop16株感染鼠脾脏Arg-1 mRNA水平明显低于野生型RH株感染鼠(t3d=2.417,t5d=3.525,t7d=4.863,P均<0.05)。两株弓形虫感染鼠脾脏IL-10、IL-12和TNF-α mRNA水平差异无统计学意义(IL-10:t3d=2.319,t5d=1.481,t7d=0.911;IL-12:t3d=0.200,t5d=0.589,t7d=1.315;TNF-α:t3d=1.833,t5d=1.313,t7d=1.969;IFN-γ:t3d=0.669,t5d=1.473,t7d=1.664;P均>0.05)(见图5)。
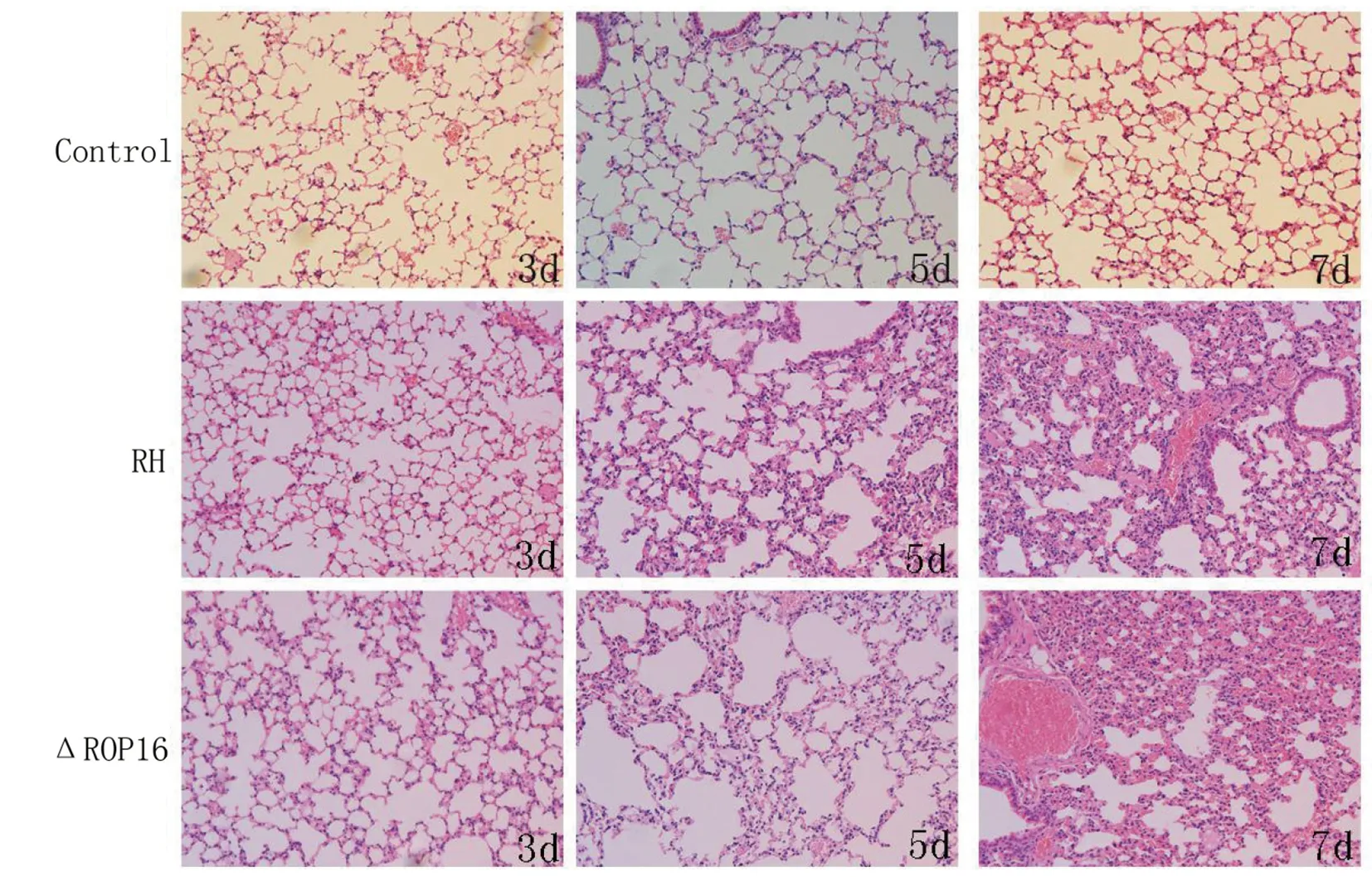
图2 感染野生型RH株和RHΔrop16株小鼠肺部组织病理学改变Fig.2 Histopathological lesions in the lung of mice infected with wild-type RH strain and RHΔrop16 strain with H&E staining(×200)
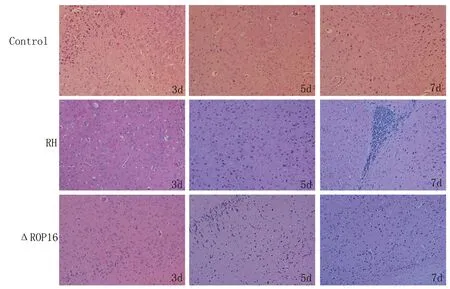
图3 感染野生型RH株和ROP16缺陷虫株小鼠脑部组织病理学改变Fig.3 Histopathological changes in the brain of mice infected with wild-type RH strain and RHΔrop16 strain with H&E staining(×200)
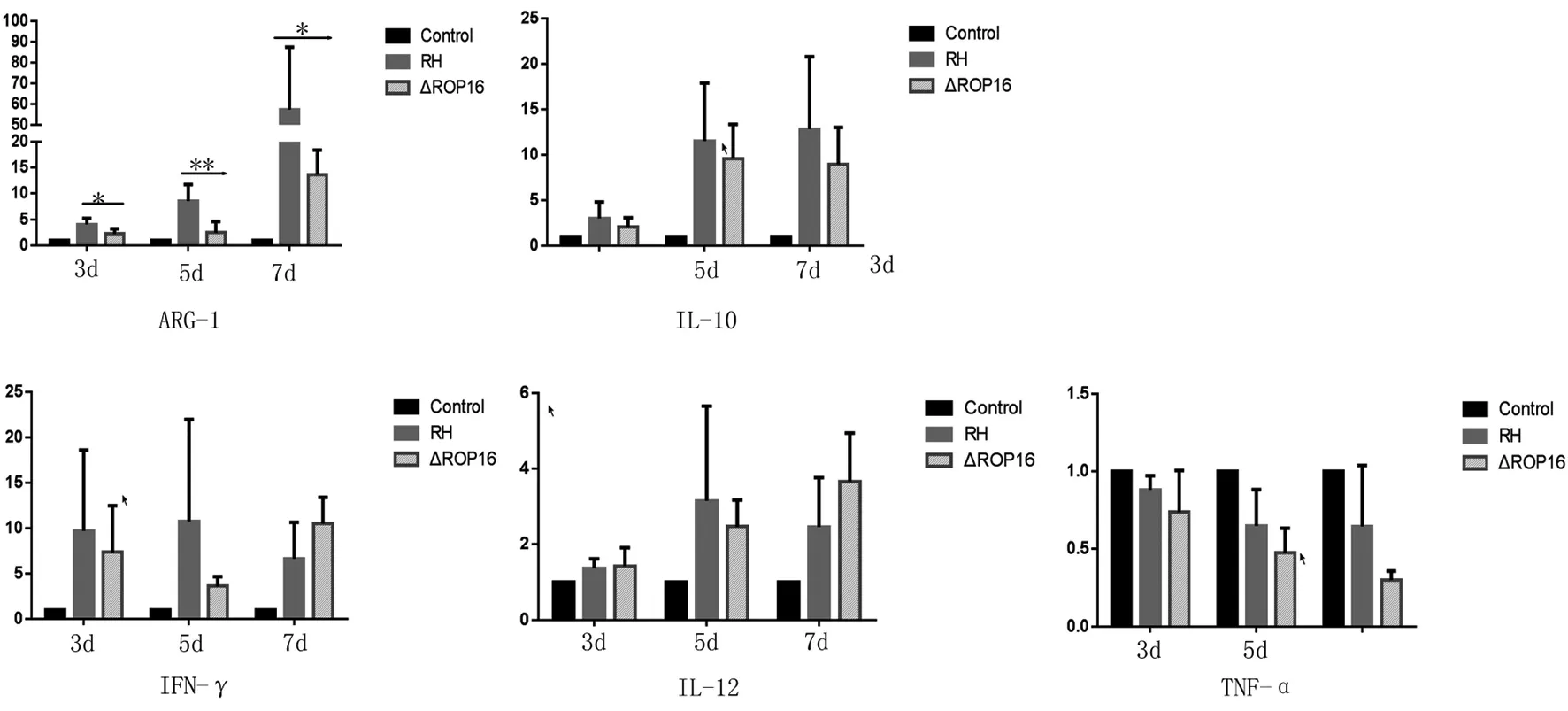
图5 野生型虫株感染的小鼠ARG-1明显高于敲除株(P<0.05);IL-10、IFN-γ、IL-12、TNF-α无统计学差异(P>0.05)Fig.5 Levels of Arg-1,IL-10,IFN-γ,IL-12 and TNF-α mRNA detected by qRT-PCR. Mice (n=3/ group) infected with wild-type RH strain and RHΔrop16 strain
3 讨 论
刚地弓形虫是一种重要的人兽共患性寄生虫。已知世界流行的弓形虫主要分为I、 II和 III型。本实验室报道,中国大陆人兽间流行的弓形虫基因型为Chinese 1型(代表虫株Wh3、Wh6)等[7]。弓形虫的毒力与某些棒状体蛋白有关。I型和III型虫株的ROP为ROPI/III(L503);而II型虫株为ROPII(S503)。ROPI/III直接磷酸化Stat3/6信号通路,在感染早期驱动巨噬细胞向M2极化,有利于虫体的大量增殖,导致宿主体内全身播散甚至导死亡[9]。小鼠在感染急性期死亡;而ROPII则无此活性[10]。相反,另一虫源性效应分子GRA15I/III无激酶活性,但GRA15II则可活化NF-Κb,诱导巨噬细胞向M1极化,诱导早期的固有免疫应答发挥抗虫作用。我国的Chinese 1基因型虫株同时携带ROPI/III和GRA15II[11],提示其具有独特的毒力和致病机制。
为了证实I型以及Chinese 1型虫株ROP16I/III与虫株致病性关系,本课题建立ROP16I/III基因缺陷虫株感染BALB/c小鼠模型,体内实验研究发现,RHΔrop16虫株较野生型虫株感染的小鼠,M2极化的标志分子Arg-1明显减少,提示ROP16I/III促进了Arg-1的表达,但是虫株对小鼠的毒力并未见明显减弱,表现为小鼠弓背、竖毛、腹水等弓形虫病症状、生存率及宿主体内增殖无统计学差异。此外,RHΔrop16组小鼠IL-10表达量未见显著变化,可能在体内弓形虫不仅感染巨噬细胞,还可感染DC、Th0、以及NK细胞等其他免疫相关细胞,这些免疫细胞均可分泌IL-10。以上结果提示,I型以及Chinese 1型虫株的ROP16I/III虽然参与负向调控宿主巨噬细胞并促进虫体在巨噬细胞内增殖,但其并非唯一的毒力因子。不同基因型弓形虫及其毒力/效应分子在弓形虫病发病机制中的作用,尚待深入研究。
利益冲突:无
引用本文格式:何佳丽,陈守斌,崔雯,等.弓形虫RH株ROP16I/III基因缺陷虫株感染BALB/c鼠的致病性研究[J].中国人兽共患病学报,2019,35(7):620-625. DOI:10.3969/j.issn.1002-2694.2019.00.61
