整合微生物组菌剂的提出、研发与应用
2019-08-08刘波陈倩倩王阶平阮传清陈燕萍夏江平车建美陈峥潘志针文笑朱育菁张海峰郑雪芳
刘波,陈倩倩,王阶平,阮传清,陈燕萍,夏江平,车建美,陈峥,潘志针,文笑,朱育菁,张海峰,郑雪芳
(1福建省农业科学院农业生物资源研究所,福州 350003;2厦门江平生物基质技术股份有限公司,福建厦门 361009)
0 引言
【研究意义】随着现代农业产业结构调整,作物的专业化、区域化和规模化栽培面积不断增加,但耕地资源有限,使得连作和复种指数不断增加,日益严重的作物连作障碍(continuous cropping obstacle)已成为限制农业生产可持续发展的瓶颈之一。连作障碍发生区域广、涉及的作物种类多,轻则导致减产减收,重则绝收,造成严重的经济损失。国内外学者对作物连作障碍的研究较多,如三七[1]、番茄[2-3]、人参[4]、棉花[5]、地黄[6-8]、黄瓜[9]、甜瓜[10]、西瓜[11]、马铃薯[12]、当归[13]、大豆[14]、黄连[15]等。相关研究普遍认为,导致作物发生连作障碍的主要因素包括:(1)根际正常微生物组结构失衡,病原微生物增加,有益微生物减少[5];(2)土壤理化性状的恶变,导致酸化、盐渍化和肥力下降,为病原真菌滋长提供了有利的条件,可加重土传病害的发生[2-3];(3)植物根系自毒物质引起根系微生物组异常,弱化了根系微生物组对病害的抑制,抑制了土壤解磷解钾固氮微生物,引起植物营养缺陷[9,16]。目前解决连作障碍措施主要有轮作和间作[2]、抗病品种筛选[10]、土壤消毒[17]、增施有机肥增加微生物组实施生物防治等[5]。以养殖废弃物和农业副产物为原料,生产整合微生物组菌剂(integrated microbiome agent,IMA),调控作物根际微生物,对连作障碍生物防控和畜禽粪便资源化利用具有重要意义。【前人研究进展】作物连作过程农事操作与土壤微生物群落变化关系密切。人参、棉花、马铃薯和大豆等连作过程中的土壤微生物群落变化已有较为深入的研究[4-5,12,14]。结果表明土壤微生物平衡的破坏是作物连作障碍的主要因素。整合微生物组(integrated microbiome)影响着土壤功能。土壤整合微生物是利用宏基因组等方法分析到的微生物组的集合,已有较多研究报道,如YANG等[18]报道了土壤整合微生物群落变化与烟草青枯病的关系;NOVELLO等[19]报道了土壤根际整合微生物组与葡萄病虫综合治理的关系;KALIVAS等[20]利用宏基因组揭示了生菜栽培过程土壤整合微生物组替代氮肥的机制。环境因素与整合微生物组存在相互作用,作者提出整合微生物组菌剂的概念,利用宏基因组能检测到菌剂的微生物组的集合称之为整合微生物组,试图通过整合微生物组的干预,改变植物根系环境中的微生物结构,提升微生物在环境中的功能,如元素降解、病害抑制、毒素分解等,用于消除作物连作障碍,相关研究未见报道。【本研究切入点】围绕整合微生物组菌剂(简称整合菌剂)产品生产技术、质量指标、整合菌剂功能比较、整合菌剂对土壤微生物组的影响、整合菌剂对连作障碍防控作用等开展研究,分析作为一种新型制剂提出的整合微生物组菌剂生产和应用的可行性。【拟解决的关键问题】阐述整合微生物组菌剂的生产过程,研究菌剂的微生物组结构,测定整合微生物组菌剂对作物发芽率、出苗率、病害防控等作用,为连作障碍生物防控、畜禽粪便资源化利用、微生物组菌剂研发与应用提供科学依据。
1 材料与方法
试验于2018—2019年在福建省农业科学院完成。
1.1 整合微生物组菌剂的生产过程
整合微生物菌组剂的生产采用微生物发酵床大栏养猪系统进行。地点为福建省农业科学院福清现代设施农业样本工程示范基地,微生物发酵床大栏养猪舍建筑面积为2 100 m2(长60 m,宽35 m),养殖面积为1 600 m2,发酵床垫料深度80 cm,发酵床垫料由33%椰糠、33%锯糠和34%谷壳组成。发酵床饲养1 600头育肥猪,猪粪便排泄在垫料上,垫料管理每天旋耕1次,垫料发酵下沉时补充新垫料到原来高度;连续使用1年养猪发酵床作为基础,在生产整合微生物菌剂时,利用30%豆饼粉+70%杏鲍菇菌糠混合成生产原料,平铺在发酵床上10 cm,发酵床相对湿度控制在 50%—60%,发酵床表面温度约 24—26℃,内层温度40.5—45.5℃。每天猪排便作为氮素流加,进行二次固体耗氧发酵,每天用拖拉机旋耕1次,旋耕深度20 cm,充分混合发酵床原有垫料、添加垫料、猪粪,相对湿度调整在55%—65%,连续操作发酵20 d;发酵结束进入产品加工,将表层20 cm发酵好的垫料收集作为整合微生物菌剂的原料,进行晾晒干燥5 d,当发酵产物含水量<30%时,经过晾干、粉碎、过筛等加工,检验、包装成为高含菌量的整合微生物组菌剂产品,包装规格为 10 kg/袋。整合微生物组菌剂生产工艺包括了原料配置→发酵床发酵→发酵控制→产品加工→产品包装等过程(图1、附图1)。关于整合菌剂生产装备、发酵调控和品管技术将另文报道。
1.2 整合微生物组菌剂营养成分分析
从产品中取样7个,记为g1,g2,… g7,送检测资质单位福建省农业科学院土壤肥料研究所分析,测定理化性质和营养成分,包括水分(%)、pH、有机质(%)、全氮(%)、腐殖酸(%)、粗纤维(%)等,统计平均值。
1.3 整合微生物组菌剂芽孢杆菌(Bacillus spp.)活菌总含量的测定
对采集的 7个样品进行芽孢杆菌活菌分离,采用MS培养基,称量10 g样品,配制含10%样品水悬浮液,加热至80℃维持20 min,保留芽孢杆菌,消除其他杂菌,通过梯度稀释涂布菌落计数法,标记菌落形态特征,进行菌落归类和统计计数;采用通用细菌16S rRNA引物进行扩增、测序、比对、鉴定,确定标记菌落为芽孢杆菌后,统计计算每克产品含芽孢杆菌菌落数(cfu/g),每个样品试验重复3次,计算平均值。
1.4 基于宏基因组的整合菌剂产品细菌微生物组测定
从整合微生物组菌剂产品中取样7个样品,每个称取100 g混合均匀后共获得700 g样品,从中取50 g利用宏基因组进行细菌微生物组分析:(1)总DNA的提取:按土壤DNA提取试剂盒FastDNA SPIN Kit for Soil的操作指南,分别提取各垫料样本的总DNA,于-80℃冰箱冻存备用;(2)16S rDNA测序文库的构建:采用扩增原核生物16S rDNA的V3-V4区的通用引物U341F和U785R对各垫料样本的总DNA进行PCR扩增,并连接上测序接头,从而构建各垫料样本的真细菌16S rDNA V3-V4区测序文库;(3)高通量测序:使用Illumina MiSeq测序平台,采用PE300测序策略,每个样本至少获得10万条reads;细菌微生物组测定由上海美吉公司完成。将序列与已知物种的16S数据库(Silva,http://www.arb-silva.de)比对,进行物种注释,得出物种信息。获得的样品细菌微生物组数据后分析:(1)细菌门水平微生物组序列数(reads);(2)细菌微生物组各分类阶元种类(OTU)数量;(3)前10种高含量细菌种类测定;(4)细菌微生物组中芽孢杆菌种类丰度(%)。
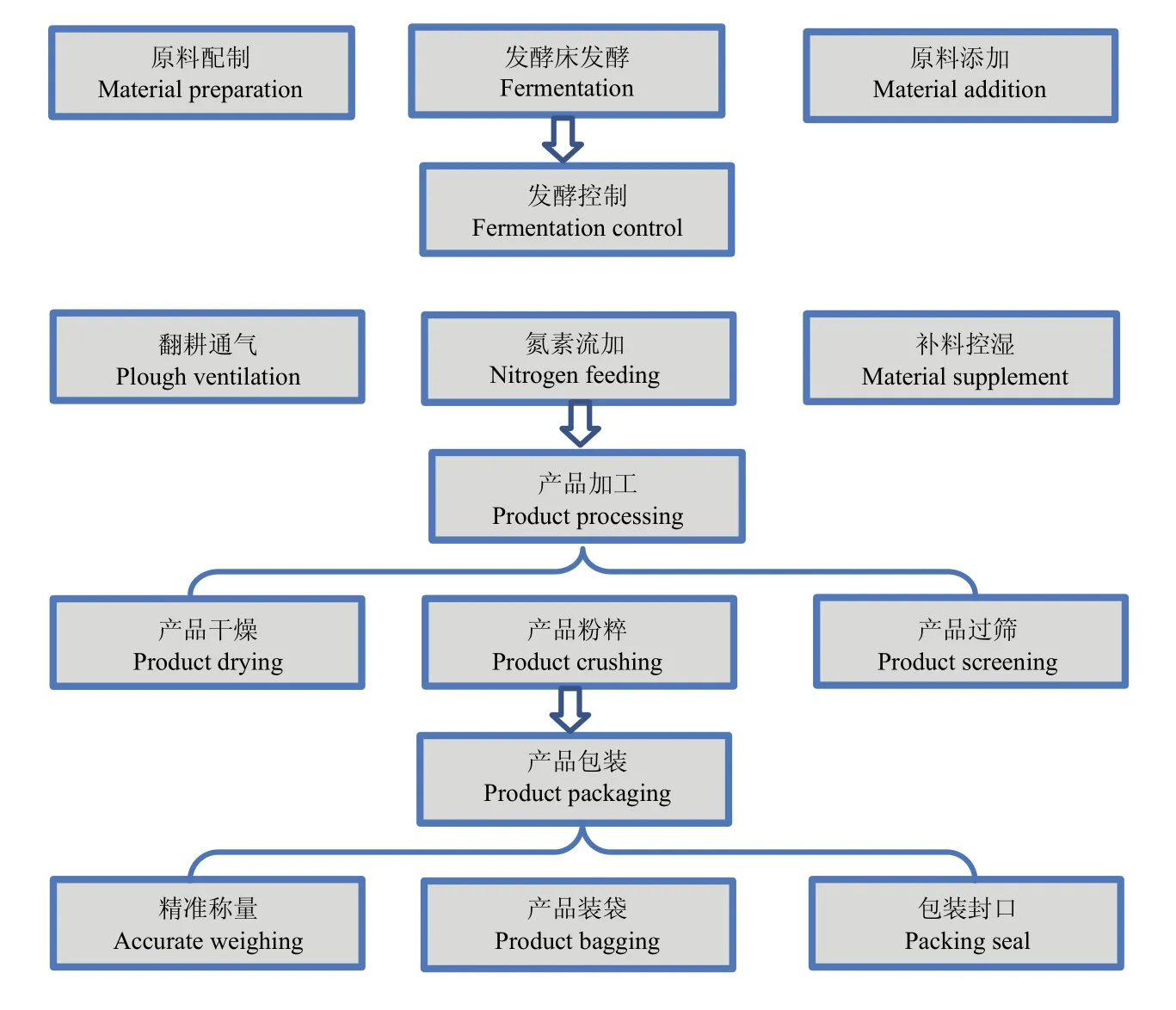
图1 整合微生物组菌剂的生产工艺Fig.1 Production process of the integrated microbiome agent
1.5 整合微生物组菌剂对种子发芽的影响
将0.1 kg的整合微生物组菌剂产品浸泡在0.4 L水中,搅拌过夜后,用4层纱布过滤,收集滤液,即为 25%的整合微生物组菌剂浸出液。取上述溶液 20 mL,置于直径9 cm的培养皿,培养皿底部放置一张滤纸;选饱满、无病虫害的绿豆种子,用浸出液浸种30 min,每皿中放置12颗绿豆种子,重复5次,用清水20 mL作为对照(CK),将其置于28℃恒温人工气候箱,光照16 h∶黑暗8 h。每24 h(1 d)观察绿豆的发芽数量、胚根长度,统计发芽率、发芽指数和活力指数;以对照组为参照,计算处理组与对照组胚根长度和活力指数的比值,分析整合微生物组菌剂25%浸出液对绿豆发芽的影响。计算公式:发芽率(G,%)=(发芽种子数/供试种子数)×100。发芽指数(GI)=Σ(Gt/Dt)。其中,Gt为第t天的发芽种子数,Dt为相应发芽天数。活力指数(VI)=GI×S。其中,GI为发芽指数,S为发芽t时间内胚根及胚轴的总长度(cm)。
1.6 整合微生物组菌剂对番茄穴盘育苗壮苗作用的影响
配制育苗基质,选择整合微生物组菌剂产品与椰糠配制成不同体积比例的育苗基质,处理设置高含量组处理 1和处理 2,整合微生物组菌剂占比分别为30%、25%;中含量组处理 3和处理 4,占比分别为20%、15%;低含量组处理 5和处理 6,占比分别为10%、5%;育苗基质配制混合后,平铺于穴盘进行番茄育苗,番茄品种为不抗青枯病的‘农科 180’,每个处理播种25粒种子,重复2次,用椰糠做育苗基质对照(CK);放入 30℃温室,以日光灯为光源,光照16 h∶黑暗8 h,每日定期喷水管理;于10、20、30 d定期观察番茄的出苗和生长情况,统计30 d的番茄出苗率(%)、根长(cm)、株高(cm)、茎粗(cm)等,比较分析不同处理整合微生物组菌剂对番茄穴盘育苗壮苗作用的影响。
1.7 整合微生物组菌剂对番茄穴盘育苗青枯病防控的影响
用以上不同处理组的穴盘育苗30 d后的番茄穴盘苗(‘农科 180’)继续进行青枯病防控试验;每个处理灌根接种浓度为106cfu/mL强致病力青枯雷尔氏菌(Ralstonia solanacearum)FJAT-91发酵液200 mL,对照组浇灌清水为对照;接种后分别在第 4、7、10天观察计算番茄苗青枯病发病率,统计整合微生物组菌剂高含量组(25%—30%)、中含量组(15%—20%)、低含量组(5%—10%)、对照组(清水)的平均发病率,计算10 d校正防效,进行分析比较。校正防效(%)=[(对照组发病率-处理组发病率)/对照组发病率]×100。
2 结果
2.1 整合微生物组菌剂营养成分分析
整合微生物组菌剂产品营养成分测定结果见表1,水分含量范围27.60%—33.60%,平均值29.74%;pH 范围 6.2—9.5,平均值 7.56;有机质含量范围38.90%—48.50%,平均值 44.46%;全氮含量范围2.00%—2.62%,平均值2.23%;腐殖酸含量范围9.31%—12.90%,平均值 11.20%;粗纤维含量范围11.30%—17.80%,平均值14.06%。
2.2 整合微生物组菌剂芽孢杆菌总活菌数测定
从采集的7个整合微生物组菌剂产品样品中分离标记的100个菌落类型,经过16S rRNA鉴定,相似度>97%,初步鉴定为23种(亚种)芽孢杆菌和2株疑似新种的芽孢杆菌(表2);芽孢杆菌活菌数测定结果见表3,样品的芽孢杆菌活菌总数平均值范围为(17.67—26.67)×107cfu/g,整合微生物组菌剂产品活菌数平均值达20.62×107cfu/g。

表1 整合微生物菌组剂营养成分分析Table1 Nutrient components analysis of the integrated microbiome agent

表2 整合微生物组菌剂产品样品芽孢杆菌种类鉴定Table2 Identification of Bacillus-like species in the product of the integrated microbiome agent

续表2 Continued table2

续表2 Continued table2

表3 整合微生物组菌剂芽孢杆菌活菌计数Table3 Colony forming unit of the Bacillus-like species taken from the integrated microbiome agent
2.3 基于宏基因组整合菌剂产品细菌微生物组测定
2.3.1 整合微生物组菌剂产品宏基因组测序 基于宏基因分析整合菌剂细菌微生物组测定结果见表4。对采集的样本分析结果表明,样品短序列数平均值为99 701.75,种类数即分类操作单元(operational taxonomic units,OTU)平均值为1 469.29,代表细菌微生物组的种类;Ace指数和 Chao指数代表物种指数,平均值分别为1 726.42和1 757.57,指示着细菌物种的数量,是种类(OTU)数量的校正值;测序深度指数(Coverage)平均值为 0.9972,表明测序深度已经基本覆盖到样本中所有的物种;香农指数(Shannon)为5.0686,表明细菌物种的多样性较高,辛普森指数(Simpson)为0.0188,表明物种优势度较低,即无单一物种占有绝对优势。
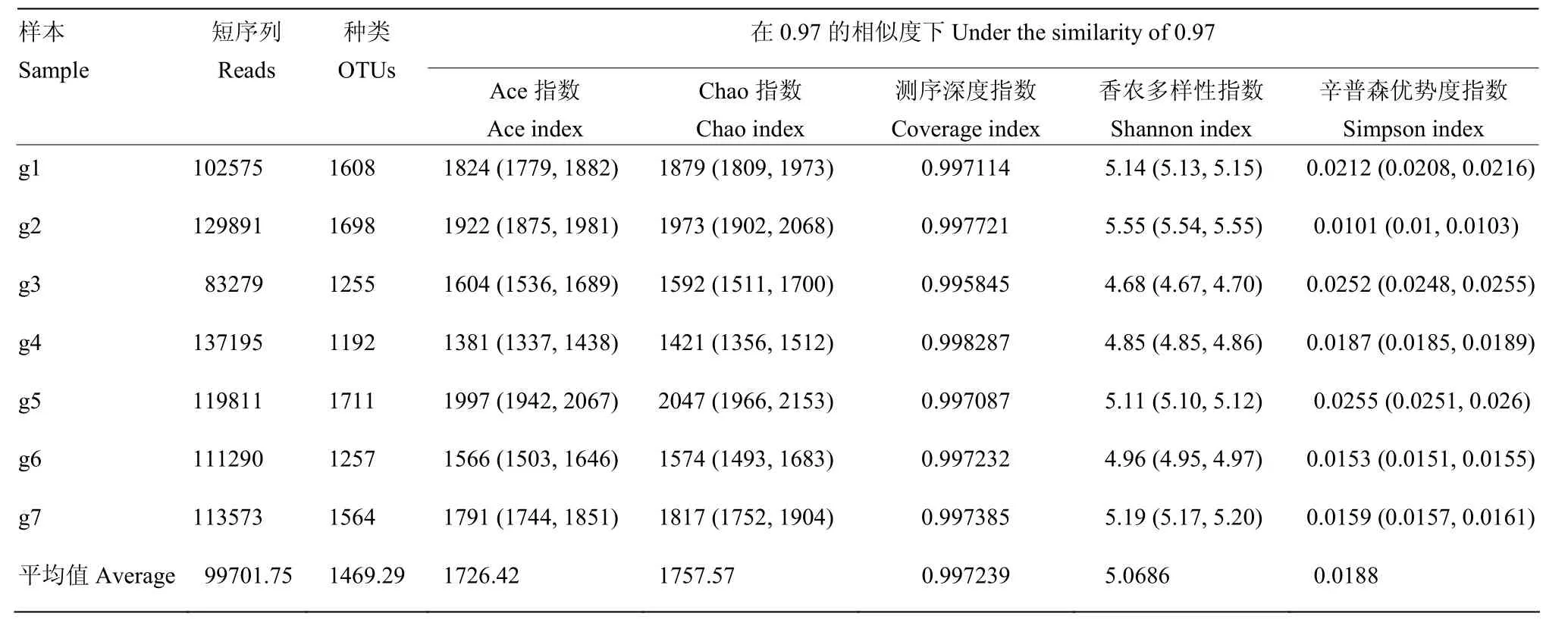
表4 基于宏基因组分析整合菌剂细菌微生物组测定Table4 Determination of bacterial microbiome for the integrated microbiome agent based on metagenome analysis
2.3.2 整合菌剂门水平细菌微生物组序列数(reads)分布 7个样本的整合微生物组菌剂分析结果表明其含有39个门细菌;不同样本差异显著,序列数范围在83 279—137 195,平均值为113 944.85;前7个细菌门reads平均值总和为108 242.43,占比95%;按大小排序 7个细菌门分别为拟杆菌门(Bacteroidetes,reads=30 783.14)、变形菌门(Proteobacteria,27 106.29)、放线菌门(Actinobacteria,19 740.00)、厚壁菌门(Firmicutes,10 725.29)、糖化细菌门(Saccharibacteria,8 005.00)、异常球菌-栖热菌门(Deinococcus-Thermus,6 360.71)、绿弯菌门(Chloroflexi,5 522.00)(图2)。
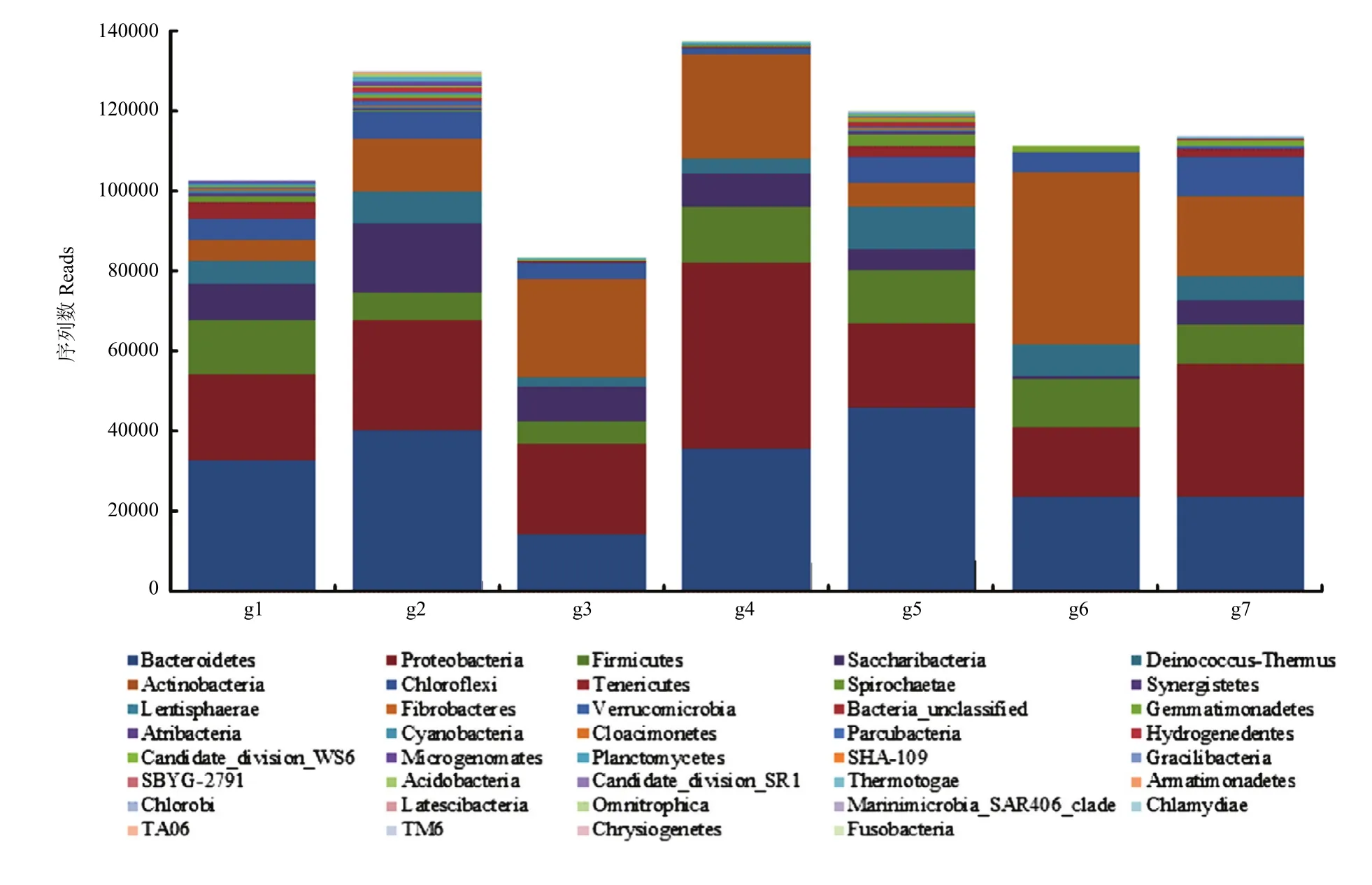
图2 整合菌剂门水平细菌微生物组序列数(reads)Fig.2 Quantity reads of bacteria microbiome at the phylum level of the integrated microbiome agent
2.3.3 整合菌剂细菌微生物组各分类阶元种类(OTU)数量 整合菌剂细菌微生物组各分类阶元种类(OTU)数量分别为细菌门39个,细菌纲96个,细菌目189个,细菌科383个,细菌属786个,细菌种1 281个;表明整合微生物组菌剂含有丰富的细菌种类,每克菌剂含有细菌1 281种。
2.3.4 整合微生物组菌剂前10种序列数(reads)含量高的细菌种类 序列数含量较高的前 10种细菌分别属于:藤黄色杆菌属(Luteibactersp.,reads=8 067.71)、糖杆菌门某属(Saccharibacteria,7 937.00)、特吕珀菌属(Trueperasp.,5 771.86)、漠河杆菌属(Moheibactersp.,5 552.14)、黄杆菌属(Flavobacteriumsp.,4 261.14)、鞘脂杆菌属(Crenotaleasp.,3 443.43)、腐螺旋菌属(Saprospirasp,2 718.86)、海杆菌属(Marinobactersp.,2 324.71)、海洋球菌属(Oceanococcussp.,1 916.43)、鸟杆菌属(Ornithobacteriumsp.,1 665.85),前 10种细菌序列数的总和为43 659.14,占比整合微生物组菌剂 1 281种细菌总序列量 113 944.90的38.31%。
2.3.5 整合微生物组菌剂芽孢杆菌种类丰度 从 7个样本中共检测到46种芽孢杆菌,各样本芽孢杆菌种类分度差异显著,芽孢杆菌丰度总和范围在0.4244%—3.5710%;前 10种高丰度芽孢杆菌分别为芽孢杆菌 2(Bacillussp.2,丰度=0.4698%)、乳杆菌 1(Lactobacillussp.1,0.2557%)、食淀粉乳杆菌(Lactobacillus amylovorus,0.2144%)、肿块芽孢杆菌(Tuberibacillussp.,0.1364%)、纤细芽孢杆菌(Gracilibacillussp.,0.057%)、地芽孢杆菌 1(Geobacillussp.1,0.0529%)、嗜盐盐乳芽孢杆菌(Halolactibacillus halophilus,0.0429%)、类芽孢杆菌2(Paenibacillussp.2,0.031%)、加利福尼亚鸟氨酸芽孢杆菌(Ornithinibacillus californiensis,0.0152%)、少盐芽孢杆菌3(Paucisali bacillussp.3,0.013%);46种芽孢杆菌总丰度为1.4244%(表5)。
在检测到的46种芽孢杆菌中有9种芽孢杆菌未见国内研究报道,分别为:(1)嗜气芽孢杆菌(Bacillus aerophilus),由印度学者 SHIVAJI等[21]从空气采集的样本中分离鉴定的新种;(2)蚯蚓芽孢杆菌(Bacillus eiseniae),由韩国学者HONG等[22]从蚯蚓肠道分离鉴定的新种;(3)丝状芽孢杆菌(Bacillus filamentosus),由印度学者SONALKAR等[23]从海洋沉积物分离的新种;(4)柯赫芽孢杆菌(Bacillus kochii),由德国学者 SEILER 等[24]从食品药物加工厂分离的新种;(5)根际芽孢杆菌(Bacillus rhizosphaerae),由印度学者MADHAIYAN等[25]从甘蔗根际土壤分离的新种;(6)长型赖氨酸芽孢杆菌(Lysinibacillus macroides),由比利时学者COOREVITS等[26]1947年从收集的牛粪中分离的菌株继续鉴定获得的新种;(7)淤泥大洋芽孢杆菌(Oceanobacillus caeni),由韩国学者NAM等[27]从污水处理系统中分离的新种;(8)拾蛤鸟氨酸芽孢杆菌(Ornithinibacillus scapharcae),由韩国学者SHIN等[28]从海边死亡的贝壳中分离的新种;(9)海洋枝芽孢杆菌(Virgibacillus oceani),由中国学者YIN等[29]从西太平洋沉积物中分离的新种。上述9个种为中国新记录种。另有 2个种,即(10)盐湖枝芽孢杆菌(Virgibacillus salinus),由西班牙学者CARRASCO等[30]从中国内蒙古锡林浩特盐湖中分离的新种;(11)香草豆芽孢杆菌(Bacillus vanilla),由中国学者CHEN等[31]从海南香草豆中分离的新种,尽管在国内的研究未见报道,但它们属于国内环境采集的种类,为中国分布种。

表5 整合微生物组菌剂产品中芽孢杆菌种类丰度Table5 The species richness of Bacillus-like species in the integrated microbiome agent

续表5 Continued table5
2.4 整合微生物组菌剂对种子发芽的影响
处理组绿豆发芽率和发芽指数与清水对照无显著差异(P>0.05),但处理组绿豆胚根长平均值为对照组的1.58倍,差异极显著(P<0.01);相比对照组,处理组绿豆活力指数提高了56.26%,差异极显著(P<0.01)(表6、附图2)。因此,整合微生物组菌剂产品浸出液对绿豆发芽无影响,但能明显促进绿豆根长的生长,提高活力指数。
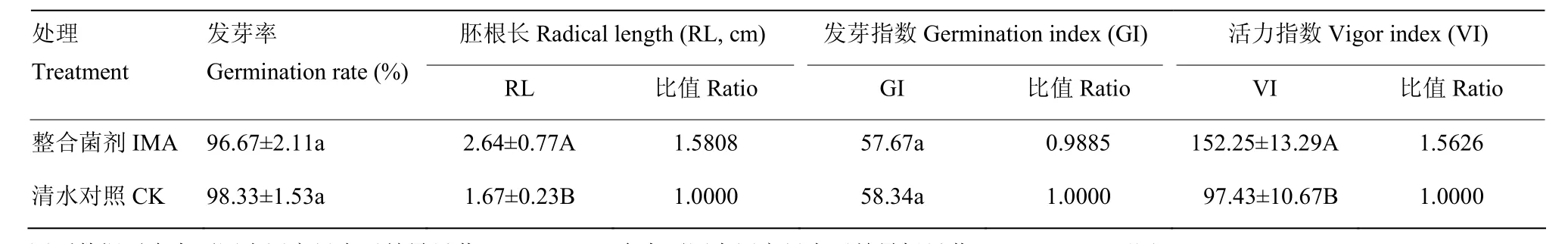
表6 整合微生物组菌剂对绿豆发芽的影响Table6 Effect of the integrated microbiome agent on germination of mung bean (24 h)
2.5 整合微生物组菌剂对番茄穴盘育苗壮苗作用的影响
育苗基质中整合菌剂添加量大时,显著抑制番茄苗的出苗率,与对照出苗率86.20%相比,出苗率降至9.04%—46.10%;同时抑制了番茄根长(0.70—1.45 cm)、株高(1.50—6.23 cm)和茎粗(0.70—1.05 cm)。整合菌剂中浓度添加时,番茄的出苗率(85.30%—86.03%)、根长(4.45—4.85 cm)、株高(9.67—9.78 cm)、茎粗(1.45—1.56 cm)与对照相比无显著差异。整合菌剂低含量添加时,能显著提高番茄出苗率3.0%,增加株高生长25.1%,而对根长和茎粗影响不显著(表7)。
2.6 整合微生物组菌剂对番茄穴盘育苗青枯病防控的影响
用整合菌剂配制的育苗基质培育番茄种苗,在出苗30 d后继续做接种防病试验,用强致病力青枯雷尔氏菌菌液(106cfu/mL)灌根接种,结果表明除了高含量整合菌剂处理1因出苗率低无法统计,其余处理接菌后4 d开始发病,随着时间进程发病率逐渐增加,10 d达到高峰;在发病高峰期(10 d),对照组(CK)发病率达88.89%,高含量整合菌剂处理组平均发病率为66.67%,校正防效达 17.88%;中含量整合菌剂处理组平均发病率为30.45%,校正防效为62.49%,低含量整合菌剂处理组平均发病率为16.72%,校正防效为79.41%;青枯病防治效果为高含量组<中含量组<低含量组(表8、图3)。

表7 整合微生物组菌剂对番茄穴盘育苗的影响Table7 Effect of the integrated microbiome agent on culture of tomato seedling (30 d)
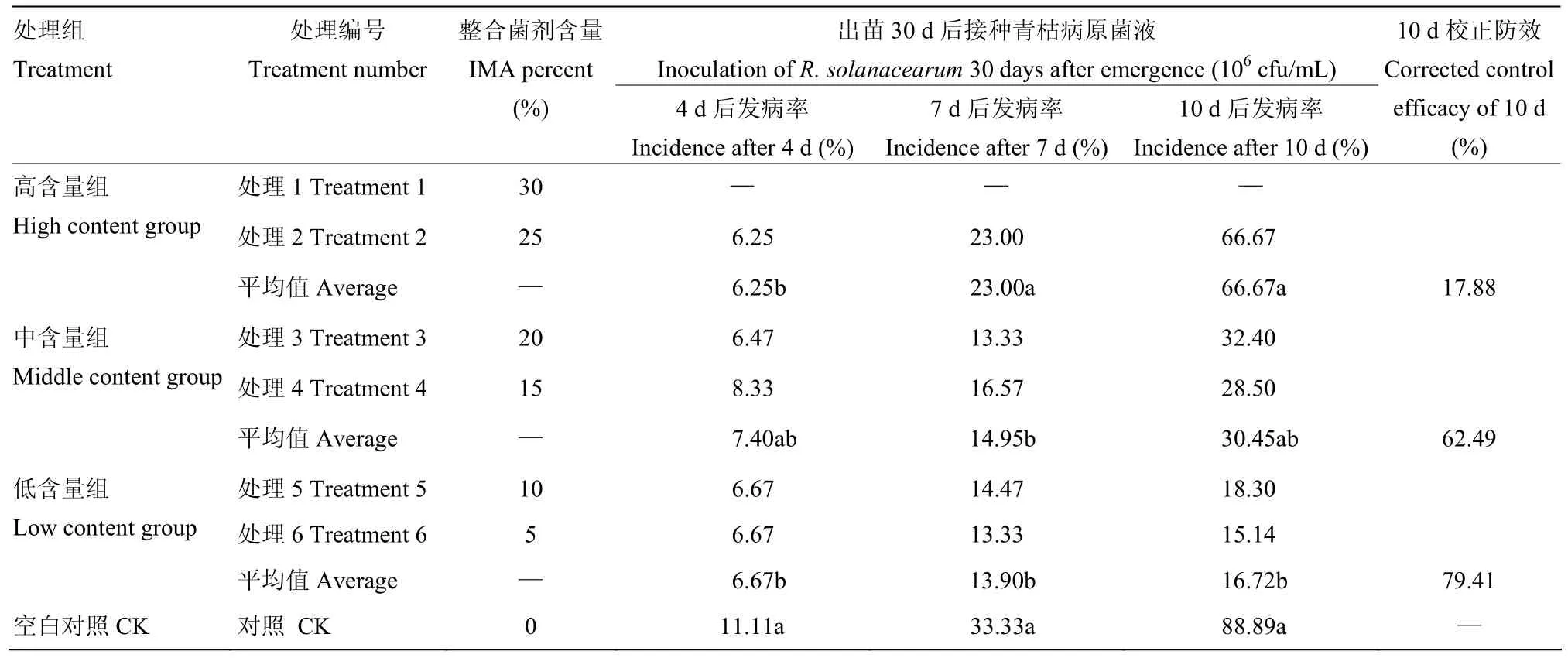
表8 整合微生物组菌剂对番茄种苗青枯病防控的影响Table8 Effect of the integrated microbiome agent on the control efficiency of tomato bacterial wilt

图3 整合微生物组菌剂对番茄穴盘育苗及青枯病防控的影响Fig.3 Effect of the integrated microbiome agent on tomato plug seedling and biocontrol of bacterial wilt
3 讨论
3.1 整合微生物组菌剂提出、研发与应用
近年来,微生物组的研究成为热点,微生物在环境中都以微生物组的形式出现和发挥作用。肠道微生物组影响着动物和人类的健康[32],海洋微生物组平衡着水体生态系统[33],土壤微生物组主导着土壤肥力和植物健康[34],等等。作者提出整合微生物组概念,通过发酵床将猪粪废弃物发酵产生整合微生物组,加工成菌剂,利用整合微生物组菌剂补充到到土壤中,提升土壤微生物组的健康水平,影响土壤微生物组的演替,使之朝着有利于土壤肥力发挥、病害生物防治以及植物健康生长方向进行,保障土壤肥力和抑制病害发生,同时起到生物肥料和生物农药的作用。作为“农药肥料双减行动”替代品具有重要价值,也是畜禽粪便资源高质化利用的一条重要途径。
畜禽粪便与农业秸秆结合等农业废弃物生产生物有机肥方式得到极大的发展。通过堆肥方式,将农业废弃物通过发酵转化成腐殖质(有机肥)的研究有较多报道[35-37]。李季[38]报道了堆肥发酵接种剂及规模化生物有机肥;张发宝等[39]报道了畜禽粪好氧堆肥产品的理化性质及生物效应;田旸等[40]报道了秸秆与污泥混合堆肥。上述研究从堆肥原料、营养添加、通气控制、菌种筛选等角度进行生物有机肥的生产,然而农业废弃物经过充分的堆肥腐熟,损失了大量的微生物组,有效微生物活菌数大幅度下降,最终产品有效活菌数虽然满足生物有机肥农业行业标准(NY884-2012),但是有效活菌数均在 2×107cfu/g左右。畜禽粪便的堆肥发酵与整合微生物组菌剂发酵存在着较大差异,堆肥是按粪污与秸秆的碳氮比配方,一次添加混合发酵腐熟,最终杀灭了大量的微生物;整合微生物组菌剂发酵是利用发酵床进行粪污氮素营养连续流加,逐步添加到发酵结束,产生并保存了丰富的微生物组。
作者提出整合微生物组菌剂(简称整合菌剂)的概念,利用固体耗氧发酵条件控制(培养基和通气量)和畜禽粪污氮素连续流加技术,在保障菌剂产品有机质含量的基础上,使得微生物含量最大化;整合菌剂的生产过程中,发酵床微生物组在充足营养和通气的条件下迅速生长发酵,经过20 d发酵,取出上层发酵垫料加工形成整合菌剂,方法简便易行,结合了发酵床养猪过程,有效地利用猪粪资源好氧发酵生产高值化整合菌剂;整合菌剂含水量 29.74%,pH 7.56,有机质含量 44.46%,全氮含量 2.23%,腐殖酸含量11.20%,粗纤维含量14.06%,芽孢杆菌活菌数达2.062×108cfu/g;产品形态与生物有机肥类似,满足生物有机肥中国农业行业标准(NY884-2012)有机质含量>40%,含水量<30%,pH 5.5—7.5的规定,有效活菌数(仅统计芽孢杆菌)是生物有机肥的10倍以上,达到高有机质含量和高活菌数的目的,较少的用量即可促进植物发芽生长,防病抗病。同时,整合菌剂添加不同的垫料(培养基),如豆饼粉、红糖、玉米粉等,会影响产品微生物组的组成,相关研究将另文报道。
3.2 整合微生物组菌剂中的细菌微生物组检测
整合菌剂每克菌剂含有细菌门39个,细菌纲96个,细菌目189个,细菌科383个,细菌属786个,细菌种1 281个。前7个细菌门含量总和为108 242.43,占比95%。前 10种高含量细菌占比整合微生物组菌剂1 281种细菌总量的38.31%,成为整合菌剂主要的功能细菌微生物组。许多学者对有机肥的发酵工艺及其中的常见功能微生物进行了深入研究[26,41-43],在发酵过程中添加功能微生物菌剂,能够丰富有机肥中的功能微生物,增强肥效。然而,堆肥过程是天然接菌的过程,调整好营养和条件,发酵物料会自动地选择微生物组成,添加进去的微生物对堆肥发酵过程影响较弱,培养基成分变化、堆肥发酵条件、堆肥腐熟时间等的变化影响着堆肥产品微生物组的组成,添加进去的微生物和产品中的微生物种类和数量没有必然联系。传统堆肥过程后期微生物组含量大幅度下降,整合微生物组菌剂生产过程则在微生物组含量最高的时候结束发酵,保持了产品中微生物的最高含量。整合菌剂产品中芽孢杆菌活菌数为2.062×108cfu/g,宏基因组测定显示芽孢杆菌总丰度为 1.42%,推算整合微生物组菌剂的有效细菌含量可达1.45×1010cfu/g;整合微生物组菌剂产品很好地结合了生物有机肥和微生物肥料的特点,为整合微生物组菌剂的应用创造了良好的条件。
3.3 整合微生物组菌剂中芽孢杆菌的分离
通过活菌分离和宏基因组检测,得出整合微生物组菌剂产品中含有大量的芽孢杆菌;由于芽孢杆菌生长培养特性以及分离含量极限等差异,两种方法分离检测到的芽孢杆菌种类数量有较大差异;可培养方法分离到芽孢杆菌23种(亚种)和2株疑似新种的芽孢杆菌,总含量为 2.062×108cfu/g;宏基因组测定方法检测到芽孢杆菌 46个种,总丰度为1.42%,即芽孢杆菌占整个细菌微生物组的1.42%。其中,9个种未见国内分离和研究的报道。芽孢杆菌能产生芽孢,具有良好的保存特性,同时芽孢杆菌能解磷解钾、分解有机物、抗病防病、促进植物生长等。国内学者通过堆肥培养基调配、发酵工艺调控、菌种添加等方法来促进生物有机肥腐熟,增加芽孢杆菌数量,从而提高生物有机肥的应用效果。整合微生物菌剂的提出适应了生物有机肥发展的方向,通过二次固体发酵,增加了菌剂中的芽孢杆菌种类和数量,为菌剂应用范围和效果的提升提供了条件。
3.4 整合微生物组菌剂中猪病原菌风险分析
生物有机肥技术指标中有粪大肠菌群数的指标,对于限制动物病原数量具有重要作用。由于整合微生物组菌剂生产过程是好氧发酵的过程,充分利用发酵床猪粪发酵垫料的微生物组和有机质基础,通过好氧中温发酵,为好氧菌的生长创造了较好的条件,从而限制了以厌氧菌为主的畜禽病原的发展;猪重要病原菌几乎营厌氧或兼性好氧环境生长,通过对整合菌剂产品的宏基因组检测未发现重要猪病原的细菌属,如胸膜肺炎放线杆菌(Actinobacillus pleuropneumoniae)、支气管败血波氏杆菌(Brodetella bronchiseptica)、猪布氏杆菌(Brucella suis)、副猪嗜血杆菌(Haemophilus parasuis)、细胞内劳森氏菌(Lawsonia intracellularis)、多杀巴氏杆菌(Pasteurella multocida)、猪霍乱沙门氏菌(Salmonella cholerae)等所在的细菌属;能检测到疑似猪病原细菌属,如梭菌属(Clostridium)、丹毒丝菌属(Erysipelothrix)、格鲁比卡菌属(Globicatella)、假单胞杆菌属(Pseudomonas)等,但检测不到相应的猪病原菌种类的存在,如检测不到产气荚膜梭菌(Clostridium perfringens)、猪丹毒菌(Erysipelothrix rhusiopathiae)、血格鲁比卡菌(Globicatella sanguinis)、绿脓假单胞菌(Pseudomonas aeruginosa)等;甚至连常见的大肠杆菌(Escherichia coli)也检测不到,这与陈倩倩等[44]报道的发酵床发酵程度II级以上(中等发酵程度)的垫料分离不到猪大肠杆菌的结果是一致的。在整合菌剂中检测不到猪细菌性病原的原因和菌剂的耗氧发酵、营养配方、菌剂加工等操作存在一定的关系,同时与整合菌剂中微生物种群竞争存在关系,整合菌剂的生产过程一并消除了猪病原携带的风险。
3.5 整合微生物组菌剂对种子发芽、种苗生长和病害防控的影响
排除整合微生物组菌剂对植物是否有毒害的第一步就是测定其对种子发芽的影响,以绿豆作为材料进行种子萌发试验,被广泛采用于测定制剂对种子发芽的影响,如测定龙血竭制剂[45]、肌苷[46]、青霉素[47]、根际微生物[48]等对绿豆发芽率的影响。本研究发现,利用整合菌剂 25%浸出液处理绿豆种子能够促进绿豆根的生长,整合微生物组菌剂对绿豆种子发芽无害。不同作物种子对整合微生物组菌剂的反应不同,有待于进一步研究。番茄基质育苗是保障壮苗的关键。利用基础基质(椰糠),添加不同浓度的整合微生物组菌剂,配制成育苗基质,研究对番茄育苗和青枯病防控的影响,结果表明整合微生物组菌剂不仅能提高番茄出苗率,促进株高生长,而且可以有效防控青枯病;在育苗基质中的整合菌剂用量为 5%—10%比较合适。
3.6 整合微生物组菌剂生产工艺和质量标准初步确定
整合微生物组菌剂生产工艺,利用养猪使用 1年以上的微生物发酵床,添加一层10 cm厚的30%豆饼粉+70%杏鲍菇菌糠垫料,进行二次固体好氧发酵,每天翻耕1次,连续好氧发酵20 d后,取出上层20 cm的垫料,进入晾晒、粉碎、分筛、包装,加工成整合微生物组菌剂。生产工艺为:原料配置→发酵床发酵→好氧发酵控制→产品加工→产品包装等。整合微生物组菌剂的质量标准参考农业农村部生物有机肥农业行业标准(NY884-2012),产品技术指标初步确定为:有机质≥40%,含水量≤30%,pH 5.5—7.5,粪大肠菌群数≤100个/g,蛔虫卵死亡率>95%,有效期>6个月;重金属含量满足标准要求:砷<15 mg·kg-1,镉≤15 mg·kg-1,铅≤15 mg·kg-1,铬≤15 mg·kg-1,汞≤15 mg·kg-1;有效活菌数调整为:细菌微生物组≥30×108cfu/g(实际含量高得多,用于缓冲产品保存期含菌量的衰减),其中芽孢杆菌≥2×108cfu/g。
4 结论
提出了整合微生物组菌剂的概念,建立了猪粪氮素连续流加和中温好氧发酵技术的生产工艺;提出产品技术指标,与农业农村部生物有机肥的质量标准接轨,重金属含量满足标准要求,芽孢杆菌有效活菌数≥2×108cfu/g。生产出的整合微生物菌剂不影响种子发芽,能促进根部生长,并对根部病害(番茄青枯病)有良好的防治效果。
