复方黄连灌肠液的总黄酮测定方法研究
2019-08-07倪晓霞王庆芬刘晓玲叶财发
倪晓霞,王庆芬,刘晓玲,叶财发
(中国人民解放军联勤保障部队第九〇九医院/厦门大学附属东南医院制剂科,福建 漳州 363000)
复方黄连灌肠液是按我院消化内科协定处方制成的复方中药灌肠液,用于治疗溃疡性结肠炎,临床效果显著。复方黄连灌肠液处方由黄连、白头翁、黄芪、甘草、山药等13味中药组成,方中多味中药均含有黄酮类物质,本研究拟通过研究复方黄连灌肠液中总黄酮含量测定方法,为建立其质量控制标准奠定基础。
总黄酮含量测定常用方法有高效液相色谱法[1]、毛细管电泳法[2]及紫外可见分光光度法[3-11]等,其中紫外可见分光光度法包括直接测定法和比色法。近年来,金属离子络合法[5-11]已成为总黄酮含量测定应用最广泛的方法[8],其原理是在酸性或碱性条件下,金属离子与黄酮发生络合反应,生成不同颜色的金属螯合物,再在紫外或可见光区用比色法测定其含量[8],常用的显色方法有HCl-Mg法、氯化铝-醋酸钠显色法(AlCl3-CH3COONa法)、硝酸铝显色法[NaNO2-Al(NO3)3-NaOH法]。由于HCl-Mg法反应过程剧烈,反应液中含有的乙醇使反应结果的重复性难以控制,且该法对多数异黄酮类成分不显色[8],因此本文没有采纳此法。复方黄连灌肠液中总黄酮测定方法未见报道,笔者分别以槲皮素、芦丁及橙皮苷为对照品,对直接测定法、AlCl3-CH3COONa法和NaNO2-Al(NO3)3-NaOH法等3种显色方法进行考察,选择并优化总黄酮含量测定方法,建立适用于复方黄连灌肠液中总黄酮含量测定的方法。
1 仪器与试药
槲皮素对照品(批号:117-39-5)、芦丁对照品(批号:153-18-4)、橙皮苷对照品(批号:520-26-3),均购自贵州迪大生物科技有限责任公司;氢氧化钠、亚硝酸钠、硝酸铝、氯化铝、醋酸钠(西陇化工股份有限公司);95%乙醇(上海化学试剂总厂);试剂均为分析纯;复方黄连灌肠液(本院自制,批号:20181206、20181207、20181208)。
2 方法与结果
2.1 对照品溶液的制备
2.1.1芦丁对照品溶液
精密称取芦丁对照品0.031 1 g,加70%乙醇适量,水浴加热溶解,放置冷却至室温,定容至50 ml,摇匀,即得浓度为0.622 mg/ml的对照品储备液。精密量取储备液10 ml,用70%乙醇定容至100 ml,摇匀,即得浓度为62.2 μg/ml的对照品溶液。
2.1.2槲皮素对照品溶液
精密称取槲皮素对照品0.0389g,加70%乙醇适量,溶解并定容至25ml,摇匀,即得浓度为1.556mg/ml的对照品溶液。
2.1.3橙皮苷对照品溶液
精密称取橙皮苷对照品0.0165g,加70%乙醇适量,水浴加热溶解,放置冷却至室温,定容至25ml,摇匀,即得浓度为0.660mg/ml的对照品溶液。
根据以上总结,同时结合安徽新华学院信息工程学院的共享资源课程建设实际情况,对资源共享课程建设从建设目标和具体做法上提出以下建设方法的探讨。
2.2 供试品溶液的制备
精密量取复方黄连灌肠液2.0 ml,置50 ml容量瓶中,用70%乙醇定容至刻度摇匀,4 000 r/min,离心15 min,取上清液,即得供试品溶液,备用。
2.3 显色方法与对照品考察
2.3.1直接测定法
精密量取对照品溶液和供试品溶液(批号:20181206)1.0 ml置于25 ml容量瓶中,用60%乙醇稀释至刻度,摇匀。以60%乙醇为参比,在200~800 nm波长范围内扫描,记录光谱图。结果芦丁、槲皮素、橙皮苷对照品溶液分别在375.9、361.3、285.8nm处有最大吸收;供试品溶液在330.8nm、279.2 nm有强吸收,见图1A。
2.3.2AlCl3-CH3COONa显色法
分别精密量取对照品溶液和供试品溶液(批号:20181206)1.0 ml置于25 ml容量瓶中,依次加入0.1 mol/L AlCl3溶液3 ml,1 mol/L NaAC溶液4 ml,用60%乙醇稀释至刻度,以供试液不加显色剂为参比,在200~800 nm波长范围内扫描,记录光谱图。结果槲芦丁、槲皮素、橙皮苷对照品溶液分别在418.5、436.6、287.2 nm处有最大吸收;供试品溶液在331.8~277.3 nm波长范围内,吸光度随波长变小而增强,在277.3 nm处有最大吸收,见图1B。
2.3.3NaNO2-Al(NO3)3-NaOH显色法
分别精密量取对照品溶液和供试品溶液(批号:20181206)1.0 ml置于25 ml容量瓶中,加5%亚硝酸钠溶液1 ml,摇匀,静置6 min,继续加10%硝酸铝溶液1 ml,摇匀,静置6 min,最后加入4%氢氧化钠溶液10 ml,用60%乙醇稀释至刻度,摇匀,静置15 min,以供试液不加显色剂为参比,在200~800 nm波长范围内扫描,记录光谱图。结果槲芦丁、槲皮素、橙皮苷对照品溶液及供试品溶液均在371.0 nm处有最大吸收,见图1C。
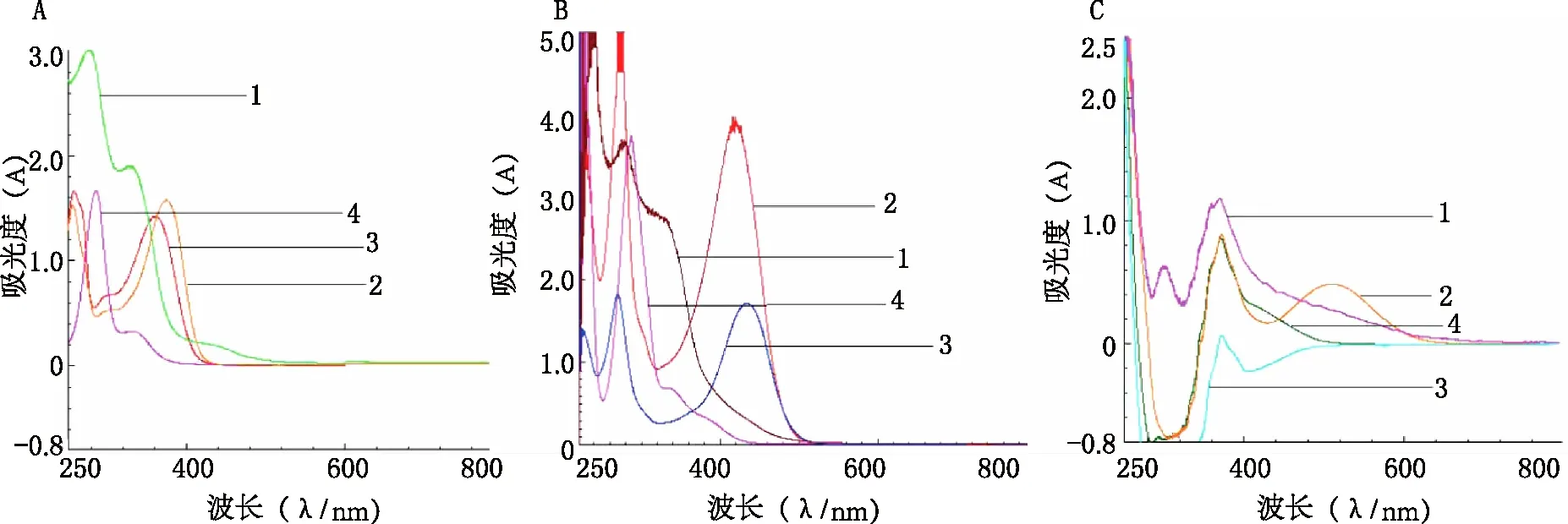
图1 显色方法与对照品考察图谱 A.直接测定法;B.AlCl3-CH3COONa显色法;C.NaNO2-Al(NO3)3-NaOH显色法;1.供试品溶液;2.芦丁对照品溶液;3.槲皮素对照品溶液;4.橙皮苷对照品溶液
综合比较以上3种显色系统,采用NaNO2-Al(NO3)3-NaOH显色系统时,3种对照品溶液的最大吸收波长均能与供试品溶液的最大吸收波长一致,max=371 nm。故笔者最终采用NaNO2-Al(NO3)3-NaOH显色法,以芦丁为对照品,在371 nm处测定复方黄连灌肠液中总黄酮含量,并对显色条件进行优化。
2.4 供试液本体干扰考察
精密量取供试品溶液(批号:20181206)1.0 ml,置25 ml容量瓶中,加60%乙醇至刻度,以60%乙醇作为参比,于200~800 nm范围扫描,记录光谱图。图谱显示在250~400 nm范围内,不加显色剂的供试品溶液有一定吸收,并且在371 nm波长附近存在吸收波谷。提示:供试品溶液对总黄酮含量测定存在一定的干扰,但选择371 nm作为总黄酮含量测定波长时,影响最小,故供试品溶液中总黄酮含量测定以不加显色剂的供试品溶液作为参比(见图2)。
2.5 显色条件优化
2.5.1显色时间的考察
(1)加入NaNO2后放置时间对吸光度的影响:分别精密量取芦丁对照品液和供试品溶液1.0 ml置于25 ml容量瓶中,加5%亚硝酸钠溶液1 ml,摇匀,分别静置2、4、6、8、10 min,继续加10%硝酸铝溶液1 ml,摇匀静置6 min,最后加入4%氢氧化钠溶液10ml,用60%乙醇稀释至刻度,摇匀静置15 min,以供试液不加显色剂为参比,于371 nm处测定吸光度。图谱提示,加入NaNO2后放置时间对供试品溶液的吸光度影响不大;加入后6 min时,芦丁对照品溶液有最大吸收,见图3A。(2)加入Al(NO3)3后放置时间对吸光度的影响:分别精密量取芦丁对照品溶液和供试品溶液1.0 ml置于25 ml容量瓶中,加5%亚硝酸钠溶液1 ml,摇匀,静置6 min,继续加10%硝酸铝溶液1 ml,摇匀,分别静置2、4、5、6、8、10 min,最后加入4%氢氧化钠溶液10ml,用60%乙醇稀释至刻度,摇匀静置15 min,以供试液不加显色剂为参比,于371 nm处测定吸光度。图谱提示,加入Al(NO3)3后2~6 min,供试品溶液的吸光度随放置时间增大,而后随时间延长,吸光度趋于稳定;加入Al(NO3)3后,芦丁对照品溶液的吸光度随放置时间先增大,5min后开始降低,见图3B。(3)加入NaOH后放置时间对吸光度的影响:分别精密量取芦丁对照品溶液和供试品溶液1.0 ml置于25 ml容量瓶中,加5%亚硝酸钠溶液1 ml,摇匀,静置6 min,继续加10%硝酸铝溶液1 ml,摇匀静置6 min,最后加入4%氢氧化钠溶液10ml,用60%乙醇稀释至刻度,摇匀,分别静置3、5、10、15、20、25 min,以供试液不加显色剂为参比,于371 nm处测定吸光度,记录结果。图谱提示,加入NaOH 10 min时,供试品溶液与芦丁对照品溶液均有最大吸收,见图3C。
2.5.2显色剂用量的考察
(1)NaNO2溶液用量对吸光度的影响:分别精密量取芦丁对照品溶液和供试品溶液1.0 ml置于25 ml容量瓶中,分别加5%亚硝酸钠溶液0.25、0.5、1.0、1.5、2.0 、2.5、3.0 ml,摇匀,分别静置6 min,继续加10%硝酸铝溶液1 ml,摇匀静置6 min,最后加入4%氢氧化钠溶液10 ml,用60%乙醇稀释至刻度,摇匀静置15 min,以供试液不加显色剂为参比,于371 nm处测定吸光度,记录结果。图谱提示,NaNO2溶液用量由0.25 ml增至1.5 ml时,供试品溶液与芦丁对照品溶液吸光度增大,而后随用量增大吸光度基本趋于稳定,见图4A。(2)Al(NO3)3溶液用量对吸光度的影响:分别精密量取芦丁对照品溶液和供试品溶液1.0 ml置于25 ml容量瓶中,加5%亚硝酸钠溶液1 ml,摇匀,分别静置6 min,分别继续加10%硝酸铝溶液0.25、0.5、1.0、1.5、2.0、2.5ml,摇匀静置6 min,最后加入4%氢氧化钠溶液10ml,用60%乙醇稀释至刻度,摇匀静置15 min,分别以供试液不加显色剂为参比,于371 nm处测定吸光度,记录结果。图谱提示,Al(NO3)3溶液用量为0.5~1.5ml,芦丁对照品溶液吸光度趋于稳定,而后随用量增大而降低;Al(NO3)3溶液用量为0.5~1.0 ml,供试品溶液吸光度趋于稳定,而后随用量增大而降低,见图4B。(3)NaOH溶液用量对吸光度的影响:分别精密量取芦丁对照品溶液和供试品溶液1.0 ml置于25 ml容量瓶中,加5%亚硝酸钠溶液1 ml,摇匀,分别静置6 min,继续加10%硝酸铝溶液1 ml,摇匀静置6 min,最后加入4%氢氧化钠溶液3、5、7.5、10、12.5、15ml,用60%乙醇稀释至刻度,摇匀静置15 min,分别以供试液不加显色剂为参比,于371 nm处测定吸光度,记录结果。图谱提示,NaOH溶液用量为7.5 ml,芦丁对照品溶液吸光度最大,而后随用量增大而降低;NaOH溶液用量为5~10ml,供试品溶液吸光度趋于稳定,而后随用量增大而降低,见图4C。

图3 显色时间考察图谱 A.加入NaNO2后放置时间对吸光度的影响;B.加入Al(NO3) 3后放置时间对吸光度的影响;C.加入NaOH后放置时间对吸光度的影响;a.供试品溶液;b.芦丁对照品溶液

图4 显色剂用量考察图谱 A.NaNO2溶液用量对吸光度的影响;B.Al(NO3) 3溶液用量对吸光度的影响;C.NaOH溶液用量对吸光度的影响;a.供试品溶液;b.芦丁对照品溶液
2.5.3显色条件确定
结合上述实验结果,综合考虑实验过程的高效性与经济效益,最终确定NaNO2-Al(NO3)3-NaOH显色体系的条件为加5%亚硝酸钠溶液1.5ml,摇匀,分别静置6 min,继续加10%硝酸铝溶液1 ml,摇匀静置5 min,最后加入4%氢氧化钠溶液7.5ml,用60%乙醇稀释至刻度,摇匀静置10 min,以供试液不加显色剂为参比,于371 nm处测定吸光度。
2.6 提取溶剂浓度考察
精密量取供试液(20181206)5.0ml,分别用水及30%、50%、60%、70%、80%乙醇溶液和无水乙醇定容至50ml,4 000 r/min,离心15min,取上清液备用。分别精密量取上述各上清液1.0ml,按“2.5.3”项下显色条件,于371nm处测定吸光度,记录结果。图谱提示,当提取溶剂中乙醇浓度为70%时,供试品溶液有最大吸光度(见图4C)。
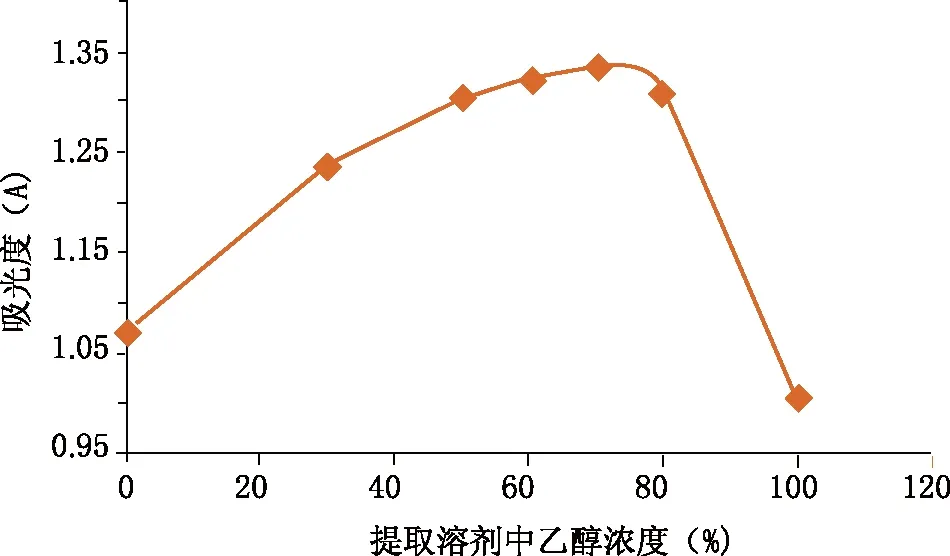
图5 提取溶剂乙醇浓度对吸光度的影响
2.7 方法学考察
2.7.1线性与回归方程
精密量取芦丁对照溶液(62.2 μg/ml)1、2、2.5、3、4、5 ml,分别置于25 ml量瓶中,按“2.5.3”项下显色条件,制备系列浓度对照品溶液,以同法制备参比溶液,于371 nm处测定吸光度,以浓度(g/L)为横坐标、吸光度(A)为纵坐标绘制标准曲线。计算得回归方程为:Y=7.63551X-0.02706 (r=0.9995),表明芦丁对照品浓度在2.488~12.44 μg/ml范围内与吸光度之间呈现良好的线性关系。
2.7.2精密度试验
精密量取芦丁对照溶液1.0 ml,6份,置于25 ml量瓶中,按“2.5.3”项下显色条件于371 nm处测定吸光度,以吸光度计算RSD%(n=6),结果RSD为0.77 %,表明仪器的精密度良好。
2.7.3重复性试验
取同一批复方黄连灌肠液(批号:20181212)6份,按“2.2”项下方法平行制备供试品溶液,精密量取供试品溶液1.0 ml,按“2.5.3”项下显色条件,于371 nm测定吸光度并计算总黄酮含量。结果供试品溶液总黄酮的平均含量为15.41 mg/ml,RSD为0.32 %,表明该方法重复性良好。
2.7.4加样回收率试验
精密量取供试品溶液(批号:20181212,总黄酮含量为0.308 8 mg/ml)0.5 ml置于25 ml容量瓶中,分别加入芦丁对照品溶液(0.622 mg/ml)0.25 ml,按“2.5.3”项下显色条件,于371 nm波长处测定吸光度并计算总黄酮含量。结果得平均回收率为100.43%,RSD为1.328%(n=6),见表1。
2.8 复方黄连灌肠液总黄酮含量测定
取复方黄连灌肠液按“2.2”项下方法制备供试品溶液3批(批号:20181206、20181207、20181212),分别精密量取供试品溶液0.5 ml,按“2.5.3”项下显色条件,依次添加各试剂,于371 nm波长处测定吸光度并计算总黄酮含量,结果见表2。

表2 复方黄连灌肠液总黄酮含量测定结果
3 讨论
黄酮类化合物是一类重要的天然有机化合物,泛指具有2-苯基色原酮结构的化合物,来源不同的黄酮类物质母核上结合的不同的机能基团,包括酚羟基、各种糖苷等,因此其数量列为天然酚类化合物之首[12]。黄酮类化合物的特殊母核结构存在两个主要的紫外吸收带:峰带I(300~400 nm)和峰带II(220~280 nm) ,但一般药材或饮片提取物中存在多种干扰物质,对其含量测定产生较大干扰。NaNO2-Al( NO3)3-NaOH显色法的原理是在碱性条件下,黄酮类化合物中的3-OH、4-OH、5-OH、4-CO或邻二位酚羟基等与Al3+进行络合反应,生成红色络合物,并且一定浓度范围内,其浓度与吸光度符合比尔定律。
目前,已有文献报道采用NaNO2-Al( NO3)3-NaOH显色法测定总黄酮含量[4-12],而该方法用于复方黄连灌肠液中总黄酮含量测定尚未见报道,故笔者参考该显色法用于测量黄连灌肠液中总黄酮含量,并对该具体显色时间和显色剂用量进行考察,最终确定1.5 ml 5% NaNO2溶液(6 min)、1.0 ml 10% Al( NO3)3溶液(5 min)和7.5 ml 4% NaOH溶液(10 min)为最佳显色条件。通过对该方法进行精密度、重复性及加样回收率等方面考察,结果表明,该方法适用于复方黄连灌肠液中总黄酮含量测定,具有简便快速、准确可靠等优点。
文中测定的3批复方黄连灌肠液中总黄酮含量波动从11%到15%,含量相差较大,其原因可能与第三批制剂(批号为20181212)启用新一批次原料药材有关,由于中药饮品质量良莠不齐,可能造成不同批次制剂成品之间总黄酮含量相差较大,建议加强该制剂相关原料药材的质量控制;结合制剂提取、澄清工艺考察结果与原料药材的质量标准范围,进行复方黄连灌肠液质量标准研究,合理设置复方黄连灌肠液中总黄酮含量的限度值,以保证临床用药安全有效。
