月腺大戟的化学成分及其乳腺癌细胞毒活性研究
2019-08-07曹青青李盛建李云青葛继云
曹青青,李盛建,李云青,葛继云,陈 俊,周 瑾,钱 跹,赵 亮
(1.上海市浦东新区人民医院药剂科,上海 201299;2.上海东方肝胆外科医院药材科,上海 200438;3.山西省儿童医院药剂科,山西 太原 030013;4.上海市宝山区罗店医院药剂科,上海 201908)
月腺大戟(EuphorbiaebracteolataHayata.)为大戟科大戟属多年生草本植物,生于山坡、草地或林下,分布于全国,主要产地为安徽、江苏、河南、湖北、山东等省。月腺大戟作为传统中药已有2000年历史,始记载于《神农本草经》:根入药,性平,味辛,有大毒。功能主治:逐水散结,破积杀虫[1]。用于治疗消化不良、水肿、咳嗽、哮喘、皮癣、皮炎等疾病[2],对于结核和癌症的治疗亦有明显效果[3]。近年有文献报道中药月腺大戟醇提物具有抗痛风作用[4],其水提物对于小鼠移植性肿瘤具有明显的抑制作用,同时提高了小鼠的免疫能力[5]。为确定该药的药效成分,前期从月腺大戟中分离得到了多种类型化合物,包括苯乙酮类、二萜类、三萜类以及甾醇类等[6],其中萜类和苯乙酮类化合物表现出显著的抗结核杆菌生长的作用[7],二萜和苯乙酮类化合物亦表现出一定细胞毒和肿瘤细胞抑制作用[8]。结合该药物的治疗作用和毒理研究,对月腺大戟的化学成分及细胞毒活性展开进一步的研究。
1 仪器与材料
1.1 仪器
AVANCE III 600高分辨核磁共振波谱仪系统(德国布鲁克科技有限公司);Agilent1260高效液相色谱仪、Agilent 6220飞行时间质谱仪(美国安捷伦科技有限公司);LC-20AP制备液相色谱仪(日本岛津公司);SMART-N超纯水机(香港力康生物医疗科技控股有限公司);RE-52型旋转蒸发仪(上海申生科技有限公司);Multiskan MK3酶标仪(美国Thermo);CO2培养箱(美国Thermo);TS-100摇床(海门其林贝尔);XDS-200倒置显微镜(上海蔡康光学);SB3200-T超声发生器(上海科导,50 KHz,120 W);18XW-80A型旋涡混合器(海门其林贝尔),AE240型十万分之一电子天平(瑞士梅特勒);全自动手持式细胞计数器Scepter 2.0(美国Millipore)。
1.2 材料
所用试剂(江苏强盛功能化学股份有限公司)均为分析纯试剂,水为本实验室制备的超纯水。玻璃层析柱(江苏南通三晶玻璃仪器有限公司);Kromasil 100-5 C18制备柱(50 mm×250 mm);柱层析用硅胶、硅胶GF254薄层板(山东烟台江友化工有限公司);羟丙基葡聚糖凝胶Sephadex LH-20(上海国药集团化学试剂有限公司),反相C18硅胶(日本大曹株式会社)。
乳腺癌细胞株MDA-MB-231、Sum149、MCF7、ZR-75-1、SKBr3、BT474(南京科佰生物科技有限公司,来源ATCC);紫杉醇(北京谱析);澳洲胎牛血清、DMEM培养基、PBS溶液、0.5%胰蛋白酶(美国Gibco公司)。
中药月腺大戟饮片购自安徽(产地山东,批号:20140811),经第二军医大学药学院生药教研室的韩婷副教授鉴定为大戟科大戟属植物月腺大戟euphorbiaebracteolataHayata.的干燥根。
2 提取和分离
取月腺大戟药材30 kg粉碎后,用8倍量体积分数为80%的乙醇于65℃下依次热提2次,每次2 h,合并2次滤液减压回收溶剂至无醇残留,得浓缩液体积7 L。取浓缩液2 L,分别用石油醚、乙酸乙酯、正丁醇各萃取3次,每次加入萃取溶剂体积2 L。分别合并各萃取层溶液,减压回收溶剂,得石油醚浸膏50 g,乙酸乙酯浸膏135 g,正丁醇浸膏250 g。
取乙酸乙酯浸膏135 g过正相硅胶柱层析(石油醚:乙酸乙酯,50∶1~1∶1洗脱),得到9个馏分Fr1-Fr9,分别取Fr1 (20 g)、Fr2 (20 g)用石油醚∶乙酸乙酯∶甲醇(从石油醚∶乙酸乙酯∶甲醇=100∶1∶1,50∶1∶1,20∶1∶1;10∶1∶1;2∶1∶1;1∶1∶1,每个体积约1.5 L)梯度洗脱,Fr1分离得到化合物 7 (170 mg),8 (52 mg),9 (60 mg);Fr2分离得到化合物 1 (45 mg);取Fr3(15 g)、Fr4(15 g) 经反相C18硅胶用氯仿:甲醇(氯仿:甲醇=20∶1;10∶1;5∶1;2∶1;每个体积约1.5 L)梯度洗脱,从Fr3中分离得到化合物 5(37 mg),6(45 mg);从Fr4中得到化合物 2 (34 mg),3 (27 mg);从Fr9(15 g)中经反相C18硅胶用甲醇洗脱分离得到3个馏分:Fr9-1,Fr9-2,Fr9-3;对Fr9-1 (1.2 g),Fr9-2(1.5 g)用LH-20柱,采用甲醇水(甲醇:水=50%,洗脱体积8 L)洗脱,最后得到化合物4(25 mg),10(26 mg)。
3 结构鉴定
采用Agilent HPLC-ESI-TOF/MS对月腺大戟中分离得到的10个单体化合物进行分子量和分子式的分析,采用Bruker AVANCE III 600 高分辨核磁共振波谱仪采集1H-NMR谱与13C-NMR谱数据。结合理化性质及现有文献中报道的核磁数据,对化合物进行结构解析,结构详见图1。
化合物1:无色针晶,C10H10O5,ESI-MS的质核比(M/Z)为211.0531 [M+H]+。1H-NMR (600 MHz,CDCl3,δ,ppm):15.39 (1H,s,3-OH),13.01 (1H,s,3-CHO),10.20 (1H,s,4-OH),5.90 (1H,s,H-5),3.98 (3H,s,6-OCH3),2.62 (3H,s,1-COCH3).13C-NMR (150 MHz,CDCl3,δ,ppm):204.8,34.2 (1-COCH3),194.0 (3-CHO),172.8 (C-4),171.7 (C-6),169.9 (C-2),106.5 (C-3),105.9 (C-1),92.2 (C-5),57.6 (6-OCH3).以上数据与文献[9]基本一致,鉴定化合物为2,4-二羟基-6-甲氧基-3-甲酰基苯乙酮。

图1 10个单体化合物的结构图
化合物2:无色针晶,C10H12O4,ESI-MS的质核比(M/Z)为197.0721[M+H]+。1H-NMR(600 MHz,DMSO-d6,δ,ppm):14.21 (1H,s,2-OH),10.52 (1H,s,4-OH),6.04 (1H,s,H-5),3.78 (3H,s,6-OCH3),2.51 (3H,s,1-COCH3),1.85 (3H,s,H-3).13C-NMR (150 MHz,DMSO-d6,δ,ppm):204.3,34.5 (1-COCH3),165.9 (C-4),164.8 (C-6),162.7 (C-2),106.0 (C-3),104.6 (C-1),92.3 (C-5),57.4 (6-OCH3),9.2 (3-CH3)。以上数据与文献[10]基本一致,推测化合物为2,4-二羟基-6-甲氧基-3-甲基苯乙酮。
化合物3:黄色针晶,C20H22O8,ESI-MS的质核比(M/Z)为391.1126 [M+H]+。1H-NMR (600 MHz,CDCl3,δ,ppm):13.19 (1H,s,4-OH),9.15 (1H,s,6-OH),8.82 (1H,s,6′-OH),6.02 (1H,s,H-5),3.95 (3H,s,2-OCH3),3.84 (3H,s,4′-OCH3),3.74 (2H,s,CH2),2.69 (3H,s,3′-COCH3),2.63 (3H,s,3-COCH3),2.06 (3H,s,5′-CH3).13C-NMR (150 MHz,CDCl3,δ,ppm):205.2,32.9 (3-COCH3),203.7,31.9 (3,3′-COCH3),164.4 (C-6),164.1 (C-4′),164.0 (C-4),163.9 (C-2′),161.9 (C-6′),157.2 (C-2),112.2 (C-1′),112.1 (C-5′),109.0 (C-3′),106.6 (C-1),106.6 (C-3),93.8 (C-5),66.0 (4′-OCH3),57.1 (2-OCH3),17.6 (CH2),9.3 (5′-CH3).以上数据与文献[11]报道基本一致,推测该化合物为月腺大戟素(ebracteolatain A)。
化合物4:浅黄色针晶,C19H20O8,ESI-MS的质核比(M/Z)为377.1299 [M+H]+。1H-NMR (600 MHz,DMSO-d6,δ,ppm):14.20 (2H,s,2,2′-OH),10.21 (2H,s,6,6′-OH),8.30 (2H,s,5,5′-H),5.92 (6H,s,4,4′-OCH3),3.75 (2H,s,ArCH2Ar),3.62 (6H,s,6,6′-COCH3).13C-NMR (150 MHz,DMSO-d6,δ,ppm):204.1,34.6 (3,3′-COCH3),166.4 (C-6,6′),165.0 (C-4,4′),162.6 (C-2,2′),108.3 (C-1,1′),105.6 (C-3,3′),92.6 (C-5,5′),57.3 (4,4′-COCH3),17.2 (ArCH2Ar)。以上数据与文献[12]报道基本一致,推测化合物为3,3′-乙酰基-4,4′-二甲氧基-2,2′,6,6′-四羟基二苯基甲烷。
化合物5:白色针晶,C20H26O4,ESI-MS的质核比(M/Z)为331.1183 [M+H]+。1H-NMR (600 MHz,CDCl3,δ,ppm):4.03 (1H,s,H-11),3.67 (1H,s,H-14),2.28 (1H,s,H-9),2.08 (3H,s,17-CH3),0.93 (3H,s,18-CH3),0.85 (3H,s,19-CH3),0.82 (3H,s,20-CH3)。13C-NMR (150 MHz,CDCl3,δ,ppm):171.0 (C-16),149.8 (C-13),131.6 (C-15),86.6 (C-12),67.5 (C-8),62.3 (C-11),56.8 (C-14),54.9 (C-5),49.4 (C-9),42.7 (C-1),40.6 (C-3),40.6 (C-10),37.0 (C-7),34.9 (C-4),34.9 (C-18),23.3 (C-6),22.3 (C-19),19.8 (C-2),16.8 (C-20),10.1 (C-17)。以上数据与文献[13]报道基本一致,推测化合物为jolkinolide B。
化合物6:无色雪花状晶体,C20H26O3,ESI-MS的质核比(M/Z)为314.1882 [M+H]+。1H-NMR (600 MHz,CDCl3,δ,ppm):5.46 (1H,d,J=6Hz,H-11),3.70 (1H,s,H-14),2.63 (1H,d,J=6 Hz,H-9),2.06 (3H,s,H-5),0.95 (3H,s,18-CH3),0.86 (3H,s,19-CH3),0.72 (3H,s,20-CH3)。13C-NMR (150 MHz,CDCl3,δ,ppm):172.0 (C-16),148.9 (C-12),146.4 (C-13),126.6 (C-15),105.5 (C-11),62.6 (C-8),55.9 (C-14),54.9 (C-5),53.3 (C-9),43.0 (C-1),42.9 (C-10),41.3 (C-3),35.6 (C-7),34.9 (C-4),34.9 (C-18),23.3 (C-19),22.3 (C-6),19.9 (C-2),16.4 (C-20),10.1 (C-17)。以上数据与文献[14]报道基本一致,故鉴定该化合物为jolkinolide A。
化合物7:淡黄色油状液体,C20H32O2,ESI-MS的质核比(M/Z)为281.2366 [M+H]+,279.2337 [M-H]-。1H-NMR (600 MHz,CDCl3,δ,ppm):5.38 (4H,m,H-9,H-10,H-12,H-13),2.77 (1H,t,J=6.6 Hz,H-11),2.34 (1H,t,J=7.2 Hz,H-2),2.05 (2H × 2,m,H-8,H-14),1.63 (2H,p,J=7.2 Hz,H-3),1.25 (2H×7,br.s,H-4 ~ H-7,H-15 ~ H-17),0.89 (3H,t,J=7.2 Hz,H-18)。13C-NMR (150 MHz,CDCl3,δ,ppm):180.7 (C-1),131.6 (C-10),131.4 (C-12),129.5 (C-13),129.3 (C-9),35.3 (C-2),33.3 (C-16),31.1 (C-7),31.0 (C-6),30.8 (C-15),30.8 (C-5),30.6 (C-4),28.6 (C-8),28.6 (C-14),27.0 (C-11),26.1 (C-3),24.1 (C-17),15.5 (C-18)。以上数据与文献[15]报道基本一致,故推断该化合物为亚油酸(linoleic acid),目前,月腺大戟的研究中未见该化合物的报道,本化合物首次报道于月腺大戟中。
化合物8:无色针晶,C19H28O2,ESI-MS的质核比(M/Z)为289.2151[M+H]+。1H-NMR (600 MHz,CDCl3,δ,ppm):5.89 (1H,d,J=1.2 Hz,H-3),5.78 (1H,dd,J=10.7 Hz,15.7 Hz,H-15),4.92 (1H,s,H-5),4.87 (1H,s,H-16),1.68 (1H,m,H-8),1.62 (1H,m,H-9),1.44 (1H,t,J=12Hz,H-14),1.27 (1H,dd,J=2.9 Hz,13.7 Hz,H-12),1.21 (1H,s,H-18),1.20 (1H,s,H-20),1.14 (1H,m,H-11),1.11(1H,m,H-14),1.02 (1H,s,H-17),0.69 (1H,s,H-19)。13C-NMR (150 MHz,CDCl3,δ,ppm):185.2 (C-2),174.7 (C-4),151.4 (C-15),118.7 (C-3),110.9 (C-16),91.3 (C-5),44.7 (C-7),42.4(C-14),41.1 (C-10),41.0 (C-8),40.8 (C-9),40.5(C-6),37.4 (C-13),33.0 (C-12),31.4 (C-20),29.9 (C-11),24.0 (C-17),20.3 (C-19),20.2 (C-18)。以上数据与文献[16]报道基本一致,故推测该化合物为fischeria A。目前,月腺大戟的研究中未见该化合物的报道,该化合物主要从大戟科白狼毒中研究发现,从月腺大戟中首次发现。
化合物9:无色针晶,C32H52O2,ESI-MS的质核比(M/Z)为469.3967 [M+H]+。1H-NMR (600 MHz,CDCl3,δ,ppm):5.17 (1H,t,J=3.4 Hz,H-12),4.49 (1H,dd,J=7.7 Hz,H-3),2.04 (3H,s,CH3CO),1.13 (3H,s,CH3-27),0.97 (6H,s,CH3-25,26),0.96 (6H,s,CH3-29,30),0.87 (6H,s,CH3-23,24),0.83 (3H,s,CH3CO)。13C-NMR (150 MHz,CDCl3,δ,ppm):172.4 (C-32),146.6 (C-13),123.1 (C-12),82.4 (C-3),56.7 (C-5),49.0 (C-9),48.7 (C-18),48.2 (C-19),43.1 (C-14),41.2 (C-8),39.7 (C-1),39.1 (C-4),38.6 (C-22),38.3 (C-10),36.2 (C-21),34.7 (C-29),34.6 (C-7),33.1 (C-17),32.5 (C-20),29.8 (C-28),29.5 (C-23),28.4 (C-15),27.6 (C-16),27.4 (C-27),25.0 (C-30),25.0 (C-2),24.91 (C-11),22.3 (C-31),19.7 (C-6),19.2 (C-24),18.1 (C-26),17.0 (C-25)。以上数据与文献[17]报道基本一致,故推测该化合物为 β-香树脂醇乙酸酯。
化合物10:微黄色粉末,C22H44O4,ESI-MS的质核比(M/Z)为353.2660 [M- H2O]+。1H-NMR (600 MHz,CDCl3,δ,ppm):4.18 (2H,m),3.93 (1H,m),3.67 (2H,m)。13C-NMR (150 MHz,CDCl3,δ,ppm):175.8,71.7 (-CH),66.6 (-CH2),64.8 (-CH2),提示该化合物有甘油酸酯片段。δH2.34 (2H,t,J=7.5 Hz)与δC35.6 是与酯羰基相连的-CH2的信号。δH0.87 (3H,t,J=6.7 Hz) 与δC15.5 是端甲基信号。以上信号与文献[18]对照,推断该化合物为单十九酸甘油酯,该化合物首次在月腺大戟研究中报道。
4 细胞毒活性试验
采用MTT法对提取得到的苯乙酮类成分进行细胞毒性评价,选取6种类型乳腺癌细胞,分别为三阴性乳腺癌MDA-MB-231及Sum149;LuminalA型MCF-7,LuminalB型ZR-75-1,Her 2阳性型SKBr3及BT474。将上述6种乳腺癌细胞接种到96孔培养板中,置于37 ℃的CO2培养箱中培养过夜。设置阳性对照组,肿瘤细胞对照组和各个不同浓度药物的实验组。配置化合物1-4母液浓度为5 mmol/L母液经稀释得到8个梯度浓度的样品溶液,浓度分别为20、15、12.5、10、7.5、5、2、1 μmol/L,作用于6种乳腺癌细胞,每个剂量设6个平行孔。各分别置于37℃、CO2培养箱中培养72 h,之后每孔加入MTT。继续培养4 h,用酶标仪(波长492 nm)测定吸光度(OD)值,计算不同浓度的化合物对乳腺癌细胞的抑制率。
细胞抑制率=(加药组OD值-调零孔OD值)/(对照组OD值-调零孔OD值),结果如表1所示。
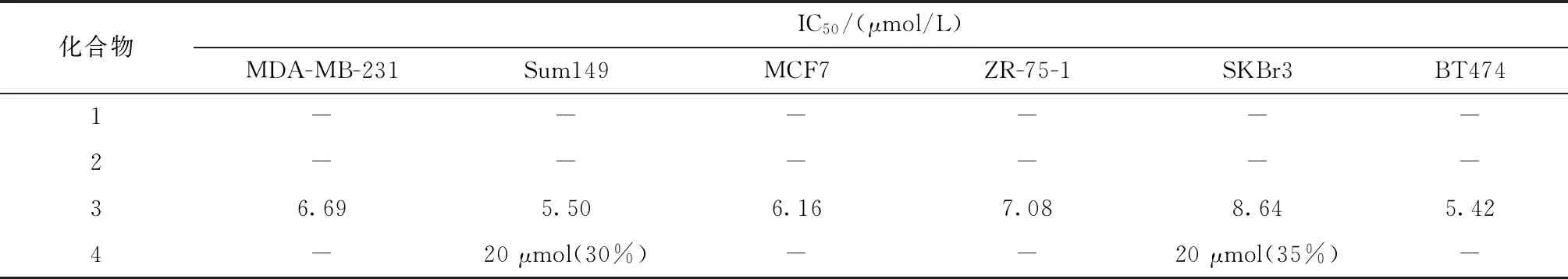
表1 MTT法测定4个化合物对各乳腺癌细胞生长的影响(72 h,n=6)
注:“-” 表示没有活性;20 μmol(30%)表示给药浓度20 μmol时抑制率为30%
5 讨论
本次研究采用多种分离技术和鉴别方法对月腺大戟的化学成分开展了进一步研究,从中分离10个化合物,并对其进行结构解析。其中分析得到4个苯乙酮类化合物,3个二萜类化合物,1个三萜类化合物和2个脂肪酸酯类化合物。化合物6、7、8、10为首次从该植物中分离得到。采用MTT法选用6种乳腺癌细胞测试 4 个苯乙酮类化合物的抗乳腺癌活性,化合物3显示出明显的抗乳腺癌活性,化合物4对乳腺癌细胞抑制活性较弱,化合物1和化合物2未表现出生物活性。化合物1和化合物2均为单苯乙酮化合物,化合物3和化合物4均为双苯乙酮类化合物,化合物3为对称的甲基取代对称的双苯乙酮,化合物4为非对称的无甲基取代对称的双苯乙酮,化合物3对抗乳腺癌细胞的生物活性较化合物4显著,而单苯乙酮类化合物1和化合物2对乳腺癌细胞未表现出抑制活性。因此,本研究初步探讨了苯乙酮类化合物的构效关系,为月腺大戟的抗乳腺癌活性开发及质量控制提供一定的物质基础和参考依据。
