滋肾降糖丸联合西药治疗气阴两虚证糖尿病肾病(G3aA2期)的临床观察及对Galectin-3的影响
2019-08-06楚淑芳赵恒侠刘德亮刘雪梅渠昕李惠林
楚淑芳, 赵恒侠, 刘德亮, 刘雪梅, 渠昕, 李惠林
(深圳市中医院内分泌病科,广东深圳 518033)
糖尿病常伴有危及生命的并发症,如糖尿病肾病(diabetic kidney disease,DKD)、视网膜病变和神经病变等[1]。DKD是糖尿病患者最常见的微血管并发症之一,与其他肾脏疾病相比,它是导致肾功能衰竭的主要原因[2],其发生发展机制尚不清楚,目前临床上西医治疗措施主要有控制血糖、降压、调脂及降低尿蛋白等对症处理以延缓肾脏的进一步损害,但不能阻止DKD病程的进展。近年来,中医对DKD的研究颇多,随着对其病因病机、临床症状等研究的深入,认为其病位主要在脾肾,并形成了“消渴肾病”这一中医病名[3]。在治疗方面也初步显示出中医药疗法能有效改善临床症状、减缓病情进展和不良反应小等独特优势。滋肾降糖丸为本院自主研发的中药复方制剂,是用于治疗糖尿病的有效临床协定方,具有益气养阴、健脾滋肾的作用,切合DKD的早期病机特点。
半乳糖凝集素-3(Galectin-3)是半乳糖凝集素家族的重要成员之一,也是晚期糖基化终末产物(advanced glycation end products,AGEs)的受体之一,在DKD发生、发展过程中发挥重要作用。Kikuchi等[4]研究表明,DKD患者的肾小球Galectin-3阳性细胞明显增多,且与尿蛋白呈正相关,与肾功能呈负相关。最近的一项临床研究[5]进一步证实,血清Galectin-3与DKD独立相关,推测其可能是DKD的一个生物标志物。基于此,本研究旨在观察滋肾降糖丸对气阴两虚证DKD(G3aA2期)患者的临床疗效及其对血清Galectin-3的影响,为进一步研究中药治疗气阴两虚证DKD的作用靶点及机制提供新的研究切入点。
1 对象与方法
1.1 研究对象及分组 收集2016年3月至2017年2月在深圳市中医院内分泌科住院治疗的2型糖尿病病例中符合DKD气阴两虚证诊断标准的患者,共60例。采用随机数字表法将患者随机分为对照组和观察组,每组各30例。本研究符合医学伦理要求并获医院伦理委员会审核批准。
1.2 病例选择标准
1.2.1 诊断标准 (1)糖尿病西医诊断和分型标准参照1999年世界卫生组织(WHO)提出的糖尿病诊断标准[6];(2)DKD的诊断参照2001年中华医学会编著的《临床诊疗指南肾脏病学分册》中对DKD的临床诊断标准[7];(3)G3aA2分期:参照肾脏病改善全球预后(KDIGO)指南建议,联合慢性肾脏病(chronic kidney disease,CKD)分期(G1~G5)和白蛋白尿分期(A1期:UACR<30 mg/g;A2期:UACR30~300mg/g;A3期:UACR>300mg/g)描述和判定DKD的严重程度[8]。(4)中医辨证标准:依据2007年中华中医药学会肾病分会《糖尿病肾病诊断、辨证分型及疗效评定标准(试行方案)》[9]中对气阴两虚证的定义。主症:倦怠乏力,心悸气短,头晕耳鸣,自汗、盗汗;次症:面色白,心烦失眠,遗精早泄,口渴喜饮;舌脉:舌淡红、少苔或花剥,脉濡细或细数无力。
1.2.2 纳入标准 ①年龄30~70岁;②符合上述中西医诊断标准;③中医证型经2位副主任及以上高级职称医师严格辨证后,确定诊断为气阴两虚证;④自愿参加本试验并签署知情同意书的患者。
1.2.3 排除标准 ①1型糖尿病或近期出现糖尿病急性并发症的患者;②合并其他原发性或继发性肾脏疾病的患者;③合并有严重心脑血管、呼吸、血液系统疾病、肿瘤及肝功能严重损害的患者;④妊娠期或哺乳期妇女;⑤依从性差,意识障碍和拒签知情同意书的患者。
1.2.4 脱落及终止标准 ①已进入研究但未完成规定疗程的患者;②试验过程中出现过敏、安全性指标异常或不良反应,根据评估应终止试验的患者;③试验过程中受试者病情持续加重或出现其他严重疾病等情况的患者;④试验方案发生了重要偏差,导致药物疗效无法评价的患者;⑤主动退出试验及失访者。
1.3 药物、试剂及仪器
1.3.1 药物 滋肾降糖丸为本院自行研发的中药复方制剂,药味组成:生地黄、黄芪、党参、五味子、黄精、怀牛膝、三七等;批准文号:粤Z20070085;规格:50 g/瓶。
1.3.2 试剂 空腹血糖(FPG)、餐后2 h血糖(2hPG)、甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、血肌酐(Scr)检测试剂盒购自德国Roche公司;C肽测定试剂盒购自美国雅培公司;空腹胰岛素(FINS)化学发光法检测试剂盒购自美国Beckman Coulter公司;糖化血红蛋白(HbA1c)测定所用试剂为美国Primus公司U1tra2原装试剂。尿微量白蛋白/肌酐比值(UACR)检测试剂盒购自挪威Axis-Shield PoC AS。人Galectin-3酶联免疫吸附法(ELISA)定量检测试剂盒购自美国R&D公司。
1.3.3 仪器 Cobas 8000全自动生化分析仪(Roche,德国);U1tra2亲和层析高压液相糖化血红蛋白检测仪(Primus,美国);全自动免疫分析系统ARCHITECT i2000SR(Abbrot,美国);全自动酶标仪(Bio-Rad,美国)。
1.4 治疗方法 对照组:给予西医常规治疗,包括:糖尿病健康教育,DKD饮食,规律的合适运动,药物治疗[根据患者病情选择合适的降糖方案,合并脂代谢紊乱者给予调脂药物治疗,合并高血压者则首选血管紧张素转换酶抑制剂(ACEI)和血管紧张素Ⅱ受体拮抗剂(ARB)类降压药]。观察组:在对照组基础上加服滋肾降糖丸,每日3次,每次6 g。2组疗程均为1个月。
1.5 观察指标
1.5.1 一般项目及中医证候积分 (1)一般项目:主要包括姓名、性别、年龄、体质量、身高、糖尿病病程、收缩压(SBP)及舒张压(DBP)等。(2)中医证候积分:根据2002年《中药新药临床研究指导原则》[10]中的证候积分量表,主证按无、轻、中、重分别计0、2、4、6分,次证按无、轻、中、重分别计0、1、2、3分,观察2组患者治疗前后中医证候积分的变化情况。
1.5.2 血生化指标检测 患者均空腹8 h以上,于次日7∶00-8∶00采空腹肘静脉血,离心,分离血清,FPG、2hPG、TC、TG、LDL-C及Scr等指标由本院检验科Roche全自动生化仪检测;FINS检测使用化学发光法;HbA1c应用亲和层析法测定;C肽检测方法为化学发光微粒子免疫检测法。胰岛素抵抗指数(HOMA-IR)=FINS(μU/mL)×FBG(mmol/L)/22.5;肾小球滤过率估计值(eGFR)利用简化的肾脏病膳食改良试验(MDRD)公式计算:eGFR(mL/min1.73 m2) =186 × Scr(mg/dL)-1.154×年龄(y)-0.203×(0.742女性)。观察2组患者治疗前后各项血生化指标的变化情况。
1.5.3 尿蛋白指标检测 收集患者晨尿约15 mL,离心取上清液,应用快速免疫比浊法检测UACR。观察2组患者治疗前后UACR的变化情况。
1.5.4 血清Galectin-3检测 患者均禁食8 h以上,于次日7∶00-8∶00空腹采肘静脉血,采集于普通干燥管中,离心,取上清,并将标本放于-80℃冰箱保存备用。采用ELISA法检测血清Galectin-3水平,严格按照说明书程序操作。
1.6 统计方法 应用State12.0统计软件进行数据的统计分析和处理。计量资料用均数±标准差(±s)表示,组内比较采用配对t检验,组间比较采用两独立样本t检验;各组间差异采用单因素方差分析,组间多重比较用Bonferroni检验;不符合正态分布或方差不齐者采用Wilcoxon秩和检验。以P<0.05为差异有统计学意义。
2 结果
2.1 2组患者的基线特征比较 对照组30例患者中,男19例,女11例;年龄35~65岁,平均年龄(54.80±7.85)岁;病程6~18年,平均病程(12.53± 4.09)年;体质量指数(BMI)为(25.11± 3.35)kg/m2。观察组30例患者中,男21例,女9例,年龄35~68岁,平均年龄(51.07±8.35)岁;病程6~19年,平均病程(11.90±4.09)年;BMI为(26.33±3.68)kg/m2。2组患者的性别、年龄、病程、BMI等基本特征比较,差异均无统计学意义(P>0.05),具有可比性。
2.2 2组患者治疗前后中医证候总积分比较 表1结果显示:治疗前,2组患者的中医证候总积分比较,差异无统计学意义(P>0.05)。治疗后,2组患者的中医证候总积分均较治疗前明显下降(P<0.01),且观察组对中医证候总积分的下降作用明显优于对照组,差异有统计学意义(P<0.01)。
表1 2组患者治疗前后中医证候总积分比较Table 1 Comparison of overall TCM symptom scores in the two groups before and after treatment(±s,s/分)

表1 2组患者治疗前后中医证候总积分比较Table 1 Comparison of overall TCM symptom scores in the two groups before and after treatment(±s,s/分)
①P<0.01,与治疗前比较;②P<0.01,与对照组治疗后比较
治疗后20.27±2.86①13.40± 2.98①②组别对照组观察组N 30 30治疗前23.13±3.45 21.33±4.97
2.3 2组患者治疗前后收缩压和舒张压比较 表2结果显示:治疗前,2组患者的SBP和DBP比较,差异均无统计学意义(P>0.05)。治疗后,2组患者的SBP和DBP均较治疗前明显下降(P<0.01),且观察组对SBP和DBP的下降作用明显优于对照组,差异有统计学意义(P<0.05)。
2.4 2组患者治疗前后肾功能及UACR比较 表3结果显示:治疗前,2组患者的Scr、eGFR和UACR水平比较,差异均无统计学意义(P>0.05)。治疗后,2组患者的Scr、UACR水平均较治疗前明显下降(P<0.01),eGFR水平均较治疗前明显升高(P<0.01),且观察组对Scr、UACR水平的下降作用及对eGFR水平的升高作用均明显优于对照组,差异均有统计学意义(P<0.01或P<0.05)。
表2 2组患者治疗前后收缩压和舒张压比较Table 2 Comparison of SBP and DBP in the two groups before and after treatment (±s,p/mmHg)
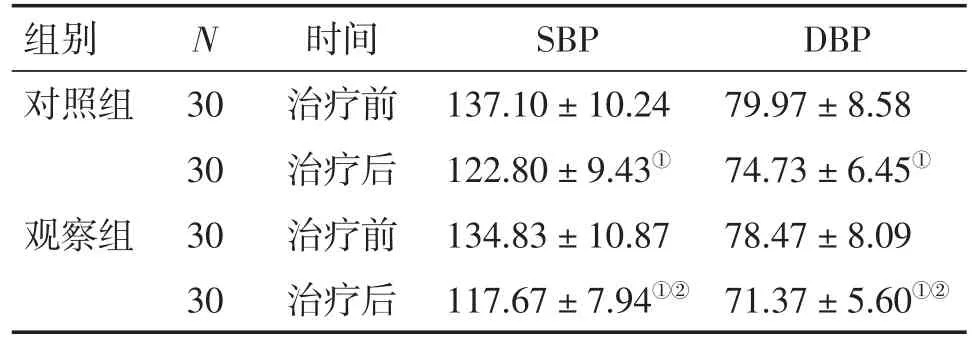
表2 2组患者治疗前后收缩压和舒张压比较Table 2 Comparison of SBP and DBP in the two groups before and after treatment (±s,p/mmHg)
①P<0.01,与治疗前比较;②P<0.05,与对照组治疗后比较
DBP 79.97±8.58 74.73±6.45①78.47±8.09 71.37± 5.60①②组别对照组N观察组30 30 30 30时间治疗前治疗后治疗前治疗后SBP 137.10±10.24 122.80±9.43①134.83±10.87 117.67± 7.94①②
表3 2组患者治疗前后肾功能及UACR比较Table 3 Comparison of renal function and UACR in the two groups before and after treatment (±s)
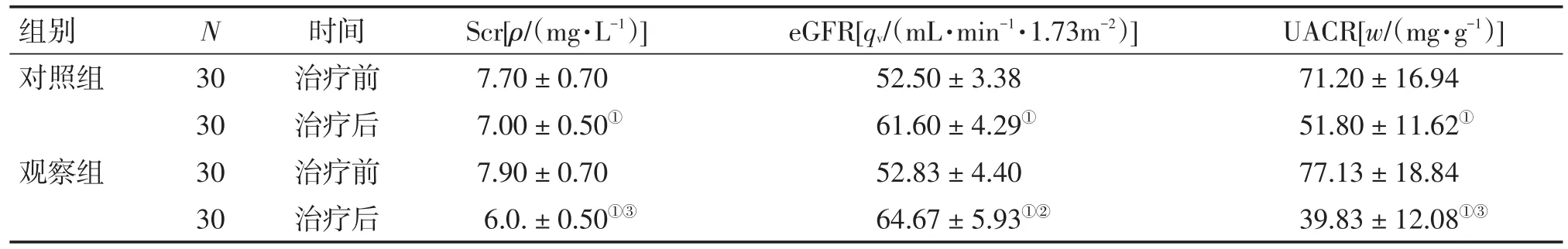
表3 2组患者治疗前后肾功能及UACR比较Table 3 Comparison of renal function and UACR in the two groups before and after treatment (±s)
①P<0.01,与治疗前比较;②P<0.05,③P<0.01,与对照组治疗后比较
组别对照组N观察组UACR[w/(mg·g-1)]71.20±16.94 51.80±11.62①77.13±18.84 39.83± 12.08①③30 30 30 30时间治疗前治疗后治疗前治疗后Scr[ρ/(mg·L-1)]7.70±0.70 7.00±0.50①7.90±0.70 6.0.± 0.50①③eGFR[qv/(mL·min-1·1.73m-2)]52.50±3.38 61.60±4.29①52.83±4.40 64.67± 5.93①②
2.5 2组患者治疗前后糖代谢指标比较 表4结果显示:治疗前,2组患者的FPG、2hPG、FINS、HbAlc、HOMA-IR等各项糖代谢指标比较,差异均无统计学意义(P>0.05)。治疗后,2组患者的FPG、2hPG、FINS、HbAlc、HOMA-IR等各项糖代谢指标均较治疗前明显下降(P<0.01),且观察组对上述各项糖代谢指标的下降作用均明显优于对照组,差异均有统计学意义(P<0.01或P<0.05)。
2.6 2组患者治疗前后脂代谢指标比较 表5结果显示:治疗前,2组患者的TG、TC和LDL-C等各项脂代谢指标比较,差异均无统计学意义(P>0.05)。治疗后,2组患者的TG、TC和LDL-C等各项脂代谢指标均较治疗前明显下降(P<0.01),且观察组对上述各项脂代谢指标的下降作用均明显优于对照组,差异均有统计学意义(P<0.05)。
表4 2组患者治疗前后糖代谢指标比较Table 4 Comparison of glucose metabolism indicators in the two groups before and after treatment (±s)

表4 2组患者治疗前后糖代谢指标比较Table 4 Comparison of glucose metabolism indicators in the two groups before and after treatment (±s)
①P<0.01,与治疗前比较;②P<0.05,③P<0.01,与对照组治疗后比较
组别对照组N观察组HOMA-IR 4.68±1.13 2.02±0.49①4.29±0.88 1.77± 0.38①②30 30 30 30时间治疗前治疗后治疗前治疗后FPG[c/(mmol·L-1)]9.70±1.07 7.23±0.73①9.25±0.64 6.71± 0.64①③2hPG[c/(mmol·L-1)]15.17±1.92 11.31±1.20①14.31±1.89 9.93± 1.10①③HbAlc(p/%)8.75±0.60 7.57±0.37①8.88±0.69 7.38± 0.35①②FINS[J/(mU·L-1)]10.84±2.15 6.78±1.55①10.45±2.13 5.94± 1.08①②
表5 2组患者治疗前后脂代谢指标比较Table 5 Comparison of lipid metabolism indicators in the two groups before and after treatment[±s,c/(mmol·L-1)]
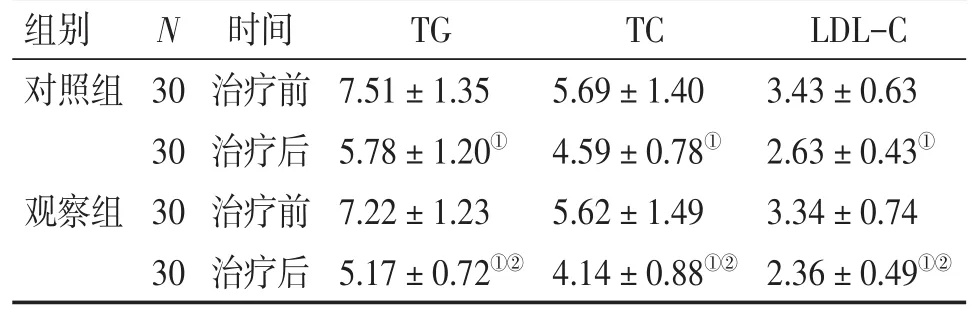
表5 2组患者治疗前后脂代谢指标比较Table 5 Comparison of lipid metabolism indicators in the two groups before and after treatment[±s,c/(mmol·L-1)]
①P<0.01,与治疗前比较;②P<0.05,与对照组治疗后比较
LDL-C 3.43±0.63 2.63±0.43①3.34±0.74 2.36± 0.49①②组别对照组N观察组30 30 30 30时间治疗前治疗后治疗前治疗后TG 7.51±1.35 5.78±1.20①7.22±1.23 5.17± 0.72①②TC 5.69±1.40 4.59±0.78①5.62±1.49 4.14± 0.88①②
2.7 2组患者治疗前后血清Galectin-3水平比较 表6结果显示:治疗前,2组患者血清Galectin-3水平比较,差异无统计学意义(P>0.05)。治疗后,2组患者血清Galectin-3水平均较治疗前明显下降(P<0.01),且观察组患者血清Galectin-3水平的下降作用明显优于对照组,差异有统计学意义(P < 0.05)。
表6 2组患者治疗前后血清Galectin-3水平比较Table 6 Comparison of serum galectin-3 in the twogroups before and after treatment (±s)

表6 2组患者治疗前后血清Galectin-3水平比较Table 6 Comparison of serum galectin-3 in the twogroups before and after treatment (±s)
①P<0.01,与治疗前比较;②P<0.05,与对照组治疗后比较
治疗后2.45±0.29①2.26± 0.35①②组别对照组观察组N 30 30治疗前2.76±0.40 2.80±0.52
3 讨论
本研究发现,滋肾降糖丸联合西药治疗气阴两虚证糖尿病肾病(DKD)G3aA2期患者,具有较好疗效,可有效改善患者的中医证候,降低患者的血压;其次,可有效降低Scr水平,提高eGFR水平,从而改善患者的肾功能,还可有效降低患者的UACR水平以减少尿蛋白;同时,可显著降低患者的 FPG、2hPG、FINS、HbA1c、HOMA-IR 水平,改善患者的糖代谢,减轻患者的胰岛素抵抗;此外,可有效降低TG、TC及LDL-c水平,改善患者的脂代谢,且其对上述指标的改善作用均明显优于单纯西药治疗的对照组。本研究同时还发现,滋肾降糖丸可明显降低气阴两虚证DKD(G3aA2期)患者的血清Galectin-3水平。
DKD是糖尿病患者最常见的微血管并发症之一,与其他肾脏疾病相比,它是导致肾功能衰竭的主要原因,约占终末期肾病患者的30%~47%,但其发生发展机制尚不清楚,可涉及血流动力学异常、多元醇通路的激活、晚期糖基化终末产物(AGEs)产生、脂代谢紊乱以及氧化应激等多种因素[2]。Galectin-3是广泛表达的多功能半乳糖凝集素家族的一员,它可发挥多种功能,参与细胞—细胞和细胞外基质黏附、细胞生长分化、凋亡和血管生成[11],因此,Galectin-3作为广谱生物反应调节剂,参与组织纤维化、肿瘤发生、免疫和炎症反应[12]。Galectin-3在糖尿病及其并发症中的研究也越来越多,研究表明肾功能正常的2型糖尿病患者血清Galectin-3水平较非糖尿病患者升高,并与脂联素水平、胰岛素敏感指数、葡萄糖清除率呈正相关,与FINS及HOMA-IR呈负相关[13,14]。Kikuchi等[4]的研究表明Galectin-3阳性细胞的浸润可能在DKD的进展中发挥重要作用,因此,Galectin-3表达的程度可能是预后不良的一个预测因子。Song等[15]的研究表明,与健康对照组相比,T2DM和DKD患者血清Galectin-3水平升高,与Scr、β2微球蛋白、FPG、年龄、HbA1c、SBP以及eGFR有关,进一步的回归分析显示,血清Galectin-3水平升高与2型糖尿病肾病患者eGFR降低、UACR升高有独立关系。Li等[16]的研究表明,Galectin-3是一种造血细胞分泌因子,可直接降低胰岛素信号传导和胰岛素抵抗,同时促进脂肪组织炎症,这表明抑制Galectin-3表达可能是一种改善胰岛素敏感性和糖耐量的抗糖尿病治疗途径。最近的一项临床研究[5]亦进一步证实,血清Galectin-3与DKD独立相关,推测其可能是DKD的一个生物标志物。
中医古籍中并无“糖尿病肾病”这一病名记载,随着现代医家对其研究的深入,目前其病名已统一为“消渴肾病”。对于其治疗,多采用分期论治[17],2011年中华中医药学会编写的糖尿病肾病中医防治指南中对其病机、演变规律以及辨证论治均有描述,认为DKD早期以气阴两虚证为主,治以益气养阴为主;中期以脾肾阳虚证为主,治以温肾健脾;晚期以阴阳两虚证为主,治以阴阳双补[18]。滋肾降糖丸为本院自主研发的中药复方制剂(批准文号:粤Z20070085),是用于治疗糖尿病的有效临床协定方。方中以黄芪、熟地黄益气养阴、健脾滋肾共为君药,臣以生地黄、党参等益气养阴,佐以淫羊藿、骨碎补、三七等滋肾活血,共奏益气养阴、健脾滋肾之功效。而本试验纳入研究的病例均为气阴两虚证DKD(G3aA2期)患者,符合DKD早期的辨证及治法。本研究结果亦证实,滋肾降糖丸可降低气阴两虚证DKD(G3aA2期)患者的中医证候积分,同时有降压、改善肾功能、降低尿蛋白、改善糖代谢、减轻胰岛素抵抗以及改善脂代谢等作用,此外,还可明显降低血清Galectin-3水平。
综上,本研究结果表明,滋肾降糖丸联合西医常规治疗气阴两虚证DKD(G3aA2期)患者,具有较好疗效,可有效改善中医证候,降低血压,改善肾功能,降低尿蛋白,改善糖脂代谢和胰岛素抵抗,降低血清Galectin-3水平,其疗效优于单纯西药治疗的对照组。对于其机制,我们推测其可能是通过改善胰岛素抵抗来降低血清Galectin-3水平。但由于本次研究样本量较小、机制研究不深入,故仍需要大规模的随机对照试验的临床研究加以证实,并进一步开展动物实验研究以探讨其作用机制。
