2,6-二氯嘌呤C6位胺基化反应条件的优化
2019-08-05李鑫华王天歌唐骏森金黎明侯熙彦
李鑫华,王天歌,唐骏森,金黎明,侯熙彦
(大连民族大学 生命科学学院,辽宁 大连 116600)
嘌呤的结构非常简单,由一个嘧啶环和一个咪唑环组成。对嘌呤结构的改造多集中在嘌呤的C2、C6和C8位上。其中,在嘌呤C6上引入各种基团 ,得到的 6-取代嘌呤核苷类化合物具有良好的生物生理活性 ,形成了 C6-C、C6-N、C6-S、C6-O、C6-X(X=F、Cl、Br、I)、C6-P等功能性的核苷衍生物[1-6]。微波化学合成是国际上的研究热点,能够显著提高化学反应速度,提高选择性和产品纯度,而且能够节约能源,减少污染。研究表明,微波催化技术用于有机合成,能够明显改善反应环境,提高反应收率,甚至可以合成出用常规方法不能合成的有机化合物[5]。本文将微波反应应用到嘌呤C6位的胺基化反应中,通过改变时间、温度和溶剂的条件,得到了2,6-二氯嘌呤C6位胺基化的最优反应条件。为今后合成C6-氨基取代的嘌呤提供了新的合成方法,反应路线如图1所示。
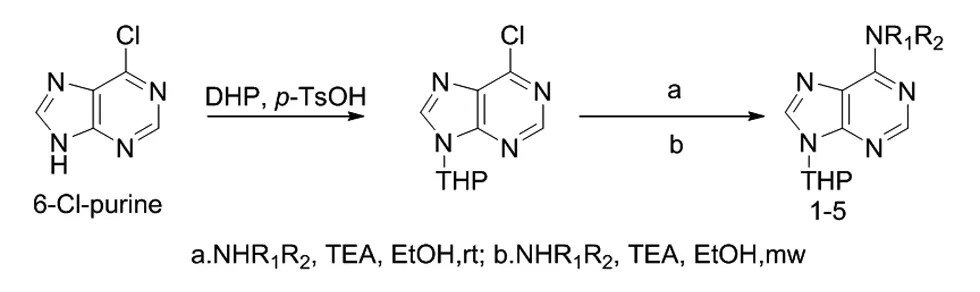
图1 反应路线
1 实验部分
1.1 仪器及试剂
仪器: 电子天平 AR1104,微波合成仪 Biotage Zhitiator,集热式恒温加热磁力搅拌器 DF-101S,磁力搅拌低温恒温水槽 PSL-1810,真空干燥箱DUG-9123A。试剂:6-氯嘌呤,分析纯,北京偶合科技有限公司;其他试剂均为分析纯或化学纯。
1.2 实验步骤
1.2.1 合成C9-THP保护的嘌呤的
将2,6-二氯嘌呤(2 g)溶于干燥的THF(30 mL)后,加入TSOH(0.36 g),加热到75℃后,加入3,4-二氢吡喃(1.45 mL),在回流的状态下反应4 h。加入氨水(2.6 mL)后,旋转蒸干得黄色油状物。加入乙酸乙酯溶解后,和饱和食盐水萃取,有机层用无水硫酸镁干燥后,过滤,蒸干。用正己烷重结晶得到C9-THP保护的2,6-二氯嘌呤。
1.2.2 C6-位胺基化合物的合成
将C9-THP保护的2,6-二氯嘌呤在微波条件下分别与胺基试剂(二乙胺、环丙甲胺、N-甲基烯丙基胺、二甲胺;2eq)和三乙胺(2eq)反应,以各种醇溶液作为溶剂进行胺基化反应。反应结束后旋转蒸干后,经柱层析分离纯化,收集产物,测核磁确定产物。
2 结果与讨论
2.1 温度对C6位胺基化微波反应的影响
我们以C9-THP的2,6-二氯嘌呤和甲胺盐酸盐(2eq)和三乙胺(3eq)的作用下,以乙醇为溶液进行温度对比实验。在微波作用下,反应3 min的情况下,分别以60℃(产率72%)、70℃(产率83%)、80℃(产率93%)、90℃(产率90%)和100℃(产率87%)位反应温度进行实验,发现在80℃的情况下反应最好,产率可达到93%。因此选定80℃作为此实验的反应温度。
2.2 溶剂对C6位胺基化微波反应的影响
我们仍以C9-THP的2,6-二氯嘌呤和甲胺盐酸盐(2eq)的反应为例,在反应温度位80℃的情况下,仍然将反应时间设定为3 min,分别以甲醇、乙醇、异丙醇、异丁醇和正丁醇为溶剂,进行C6位胺基化反应。发现,当以乙醇为溶剂的时候,产率最高,能达到90%,以其他醇溶液位溶剂时,产率略低,其中正丁醇为溶剂时产率最低,只用71%。
2.3 反应时间对C6位胺基化微波反应的影响。
在选定乙醇为溶剂后,我们以C9-THP-2,6-二氯嘌呤和甲胺盐酸盐(2eq)反应,在80℃下反应,将反应时间分别设定为15 s,30 s,1 min,1 min30 s,2 min和2 min30 s。实验发现当反应时长小于2 min的时候,起始物质都有不同程度的剩余,造成产率低,但是当反应时间高于2 min的时候,有部分化合物出现分解现象,故2 min的反应时间是最佳反应时间,产率为92%。
3 结论
2,6-二氯嘌呤C6位胺基化的最优反应位,反应温度80℃,反应溶剂为乙醇,反应时间为2 min的微波反应。将C9-THP保护的2,6-二氯嘌呤溶于乙醇后,加入铵盐(2eq)和三乙胺(2eq)。在80℃的情况下微波反应2 min得相对应的C6胺基化产物,见图2。
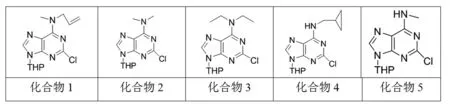
图2 在最佳条件与不同胺盐反应产物
化合物1,产率92%。1H NMR (400 MHz,CDCl3) δ 7.89 (d,J = 1.7 Hz,1H),5.88 (s,1H),5.68 (d,J = 10.7 Hz,1H),5.20 (d,J = 12.3 Hz,2H),4.84 (s,1H),4.38 (s,1H),4.12 (d,J = 11.8 Hz,1H),3.75 (t,J = 11.4 Hz,1H),3.61 (s,1H),3.24 (s,2H),2.04 (t,J = 12.6 Hz,2H),1.89 (dd,J = 21.4,10.3 Hz,1H),1.81~1.64 (m,3H),1.61 (d,J = 9.0 Hz,1H),1.25 (d,J = 7.7 Hz,1H)。
化合物2,产率86%。1H NMR (400 MHz,CDCl3) δ 7.86 (s,1H),5.66 (d,J = 10.5 Hz,1H),4.10 (d,J = 10.3 Hz,1H),3.87~3.50 (m,4H),3.24 (d,J = 47.3 Hz,3H),2.02 (t,J = 14.0 Hz,2H),1.93~1.80 (m,1H),1.80~1.65 (m,2H),1.60 (t,J = 11.8 Hz,1H)。
化合物3,产率85.4%。1H NMR (400 MHz,CDCl3) δ 7.91 (s,1H),5.70 (d,J = 11.0 Hz,1H),4.14 (d,J = 11.4 Hz,3H),3.77 (t,J = 10.6 Hz,3H),2.05 (t,J = 12.4 Hz,2H),1.96~1.85 (m,2H),1.75 (dd,J = 20.5,11.5 Hz,2H),1.62 (d,J = 10.7 Hz,1H),1.28 (t,J = 6.8 Hz,6H)。
化合物4,产率86%。1H NMR (400 MHz,CDCl3) δ 7.91 (s,1H),5.68~5.62 (m,1H),4.69 (s,1H) H,4.11 (d,J = 13.4 Hz,1H),3.73 (t,J = 10.4 Hz,1H),3.43 (s,2H),2.03 (dd,J = 21.5,11.1 Hz,3H),1.97~1.81 (m,2H),1.71 (td,J = 23.5,11.8 Hz,3H),1.61 (s,2H),0.57~0.49 (m,2H),0.28 (t,J = 5.0 Hz,2H)。
化合物5,产率90%。1H-NMR (400 MHz,CDCl3) δ 7.96
(s,1H),6.00 (s,1H),5.71 (d,J = 10.5 Hz,1H),4.17 (d,J = 11.4 Hz,1H),3.78 (d,J = 11.1 Hz,1H),3.20 (s,3H),2.17~2.02 (m,2H),1.95 (d,J = 11.5 Hz,1H),1.86~1.61 (m,4H)。
