棘孢木霉JM -1菌株对麦根腐离蠕孢的拮抗机制
2019-08-03张眉吴斌徐德坤王升吉辛相启姜珊珊
张眉 吴斌 徐德坤 王升吉 辛相启 姜珊珊


摘要:为了研究木霉菌JM-l菌株对麦根腐离蠕孢CY6菌株的拮抗机制,本研究结合形态学和分子生物学鉴定方法,明确JM-l菌株的分类地位,并采用平板对峙培养法和显微观察,分析JM-l菌株对CY6菌株的拮抗作用。结果表明,木霉菌JM-l菌株为棘孢木霉(Trichoderma a.sperellurn),可通过空间和营养竞争抑制CY6菌株的生长,抑菌率为77.22%;显微观察发现,棘孢木霉JM-l对CY6菌株有明显的重寄生作用,同时,JM-l菌株可产生某些抗生物质,使CY6菌株的菌丝、分生孢子发生变形和消解。因此,棘孢木霉JM-l菌株可通过竞争作用、重寄生作用和抗生作用等多重生防机制抑制麦根腐离蠕孢的生长。
关键词:棘孢木霉;麦根腐离蠕孢;拮抗机制
Antagonistic Mechanism of Trichodermaasperellum JM - 1 against Bipolaris sorokinianaZhang Mei, Wu Bin, Xu Dekun, Wang Shengji, Xin Xiangqi, Jiang Shanshan
Abstract In order to study the antagonistic mechanism of Trichoderma spp. JM - I against Bipolaris so-rokiniana, the taxonomic status of JM - 1 was confirmed by morphological and molecular biological identifica-tion methods, and the antagonistic mechanism between JM -1 and CY6 isolates were analyzed by plate con-frontation culture and microscopic observation. The results showed that JM - 1 isolate was identified as Tri-choderma asperellum, and it restrained the growth of CY6 isolate through spatial and nutrient competition withand the inhibition rate as 77.22% . Microscopic observation found that JM - 1 isolate had the significant para-sitic effect on CY6 isolate, and produced some antibiotic substance, which led to deformation and digestion ofmycelia and conidia. In summary, T. asperelluim JM - 1 isolate could inhibit the growth of B. sorokinianathrough multiple biological control mechanisms such as competition, mycoparasitism and antibiosis.
Keywords Triclzoderma asperellum ; Bipolaris sorokiniana ; Antagonistic mechanism
木霉菌(Trichoderma spp.)对多种植物病原菌都具有较好的拮抗作用[1],是一类应用广泛、适应力强、拮抗机制多样的生防菌[2],在防治植物病害上发挥着重要作用。棘孢木霉(Trichoder-ma asperellum]是由Samuels等[3]于1999年命名的木霉新种,在我国由章初龙等[4]于2005年首次報道。目前研究表明,棘孢木霉是一种优良的生防真菌,对黄瓜枯萎病菌(Fusarium oxyspo-rum)[5]、玉米大斑病菌(Exserohilum turcicum)[6]、水稻纹枯病菌(Rhizoctonia solani)[7]等病原菌都有良好的抑制效果。
小麦根腐病是山东小麦产区的重要病害之一,该病危害严重并呈逐年加重趋势,主要病原物为麦根腐离蠕孢(Bipolaris sorokiniana)。崔云龙等[8]研究表明,短小芽孢杆菌D82对小麦根腐病有较强的抗生作用,防效显著。王立等[9]研究发现,丛枝菌根真菌摩西球囊霉( Glomus mosseae)能有效防治小麦根腐病,并对小麦的营养生长有促进作用。目前利用木霉菌防治小麦根腐病的研究报道较少。本研究采用形态学和分子生物学鉴定方法,确定木霉菌JM-1菌株的分类地位,通过平板对峙培养和显微观察,明确其对麦根腐离蠕孢的拮抗机制,为木霉菌JM-1菌株防治小麦根腐病提供理论依据。
1 材料与方法
1.1供试菌株
供试菌株:木霉菌JM -1菌株分离自小麦根际土壤;小麦根腐病麦根腐离蠕孢(Bipolaris soro-kiniana)CY6菌株为本实验室保存。
1.2 生化试剂及其他
Easy Taq酶购自北京全式金生物技术有限公司,真菌DNA提取试剂盒购自Omega公司,DNA凝胶回收试剂盒购自上海Sangon公司。其他常规化学药品均为分析纯试剂。PCR引物合成由上海Sangon公司完成。DNA测序由铂尚生物技术(上海)有限公司完成。
1.3 木霉菌的鉴定
1.3.1 形态学鉴定 将纯化的木霉菌JM -1菌株接种于PDA培养基平板,28C倒置培养,分别在接种24、48、72、96 h观察菌落形态、颜色及培养性状。挑取菌丝,显微观察分生孢子梗和分生孢子的形态特征。
1.3.2 分子生物学鉴定 收集JM -1菌株的菌丝体,用HP Fungal DNA Kit提取试剂盒提取菌株基因组,以DNA为模板,用通用引物ITSIF(5-TCCGTAGGTGAACCTGCGG -3)和ITS4R(5 -TCCTCCGCTTATTGATATGC -3)扩增rDNA -ITS序列,水作阴性对照。PCR反应体系为25μL:IO×Easy Taq Buffer(含Mg2+)2.5μL,2.5mmol/L dNTPs 2poL,5 U/pL Easy Taq 0.3μL,10ymol/L正反向引物各0.5μL,DNA模板1μL,ddH,0补足至25μL。PCR反应程序为:94℃ 4min;94℃ 30 s,56℃ 30 s,72℃ 35 s,35个循环;72℃ 10 min。切胶回收目的条带进行测序。
在GenBank数据库中下载合适的木霉菌株序列,通过Clustalx l.83软件对ITS序列进行比对。利用MEGA 5.0分析软件中的Neighbor-Joining分析法构建系统发育树,基于Kimura 2-parameter距离模式计算遗传距离。各分支置信度(Bootstrap)进行1000次重复分析。
1.4 木霉菌对病原菌的拮抗作用
采用平板对峙培养法:木霉菌JM-1菌株和麦根腐离蠕孢CY6菌株均置于28℃活化3d,然后用直径7mm的打孔器分别在菌落边缘打取菌饼,接种于PDA平板中线上相距7 cm的两点处,28℃黑暗培养。以一端接种病原菌菌饼,一端接种空白PDA菌饼作对照,每个处理重复3次。每隔24h测量菌落半径,计算抑菌率。抑菌率(%)=(对照病原菌菌落半径一处理病原菌菌落半径)/对照病原菌菌落半径×l00。
1.5 拮抗作用的显微观察
在PDA平板两端分别接种木霉菌JM-1菌株和麦根腐离蠕孢CY6菌株的菌饼,在菌饼之间平放无菌盖玻片,28℃黑暗培养。待两端菌丝长至盖玻片上,菌丝相交后,进行显微观察。以盖玻片上只长有病原菌作对照。
2 结果与分析
2.1 木霉菌JM-1菌株的形态学鉴定
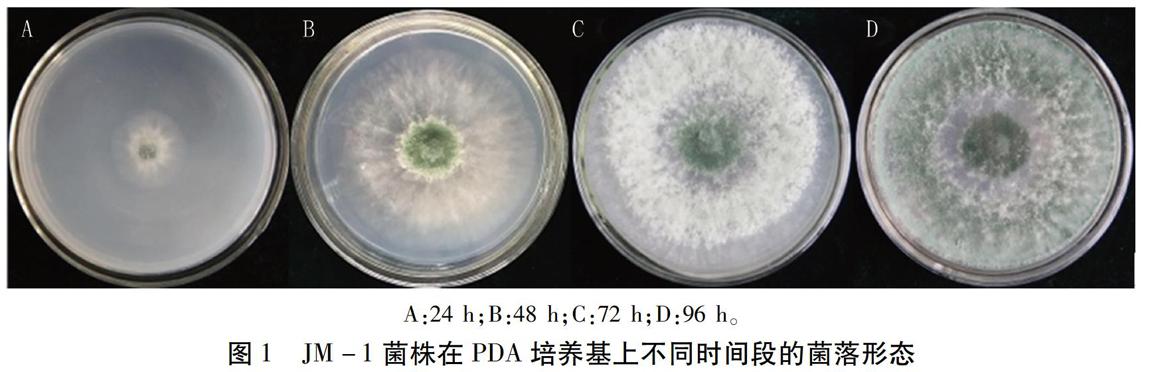
在PDA培养基上培养24 h菌落圆形,呈辐射状生长,菌丝白色;培养48 h菌落中央产生绿色孢子;72 h菌落即能长满直径9 cm的培养皿,并出现一圈稀薄一圈厚密的菌丝生长带,绿色孢子由中央向四周扩展;96h厚密的菌丝生长带上产生大量绿色孢子,菌落呈现白绿相间的同心圆状(图1)。
显微镜观察发现,菌丝细长,有隔,分生孢子梗对生分支,顶端有瓶梗,瓶梗2个或多个为一组轮生,瓶梗中间膨大,呈安瓿瓶形。分生孢子大小为(2.95~4.07) μm×(3.11~4.69)卜Lm,青绿色,圆形或卵形(图2)。该菌株的培养性状和形态特征与棘孢木霉(Trichoderma asperellum)基本一致,因此初步鉴定为棘孢木霉。
2.2 木霉菌JM-1菌株的分子生物學鉴定
用通用引物ITSIF/ITS4R扩增JM-1菌株基因组的ITS序列,得到一条约600 bp的目的条带(图3)。将测定的JM-1菌株ITS序列与GeneBank数据库中下载的木霉序列进行同源性比较并构建系统发育树,从树状图(图4)可以看出,JM-1菌株聚类到Trichoderma asperellum进化枝上。综合形态学和分子生物学鉴定结果,明确JM-1菌株为棘孢木霉(Trichoderma asperel-lum)。
2.3 棘孢木霉对麦根腐离蠕孢的拮抗作用
在PDA平板对峙培养过程中,棘孢木霉JM-1菌株对麦根腐离蠕孢CY6菌株有较强的抑制作用,抑菌率为77.22%。相比CY6菌株,JM-1菌株生长迅速,培养3d菌丝即与CY6菌丝相交,CY6菌丝的生长明显受到抑制,菌落边缘出现轻微塌陷。培养至第4d,JM-1菌丝将CY6菌落包围,菌丝几乎不能生长,而JM-1菌丝覆盖在CY6菌落上继续生长。对峙培养10d,JM -1菌丝已将CY6菌落完全覆盖,并在CY6菌落上产生大量绿色孢子(图5)。从以上结果可以看出,棘孢木霉JM -1菌株能够通过对生长空间和营养物质的竞争有效抑制麦根腐离蠕孢CY6菌株的生长。
2.4 棘孢木霉对麦根腐离蠕孢拮抗作用的显微观察
在PDA培养基上,棘孢木霉JM -1菌株与麦根腐离蠕孢CY6菌株对峙培养3d菌丝相交,显微观察发现,棘孢木霉JM-1菌丝逐渐缠绕CY6菌丝,与对照相比,CY6菌丝发生变形、断裂、消解,分生孢子量明显减少,并出现变形、破裂现象(图6)。由此可见,棘孢木霉JM-1菌株可通过缠绕的方式寄生在CY6菌丝上,具有重寄生作用,此外,JM-1菌株还可能产生了某些抗生物质,导致CY6菌丝和分生孢子变形、解体。
3 讨论与结论
木霉属真菌广泛存在于土壤、植物残体等生态环境中,是土壤中微生物种群的优势真菌[10]。该属真菌种类繁多,常见的木霉属真菌有哈茨木霉(T.harzianum)、绿色木霉(T.viride)、棘孢木霉(T.asperelluim)、深绿木霉(T.atroviride)、长枝木霉(T. longibrachiatum)、康宁木霉(T.konin-gii)等。本研究从菌落形态、分生孢子梗及分生孢子特性等方面,初步确定木霉菌JM-1菌株为棘孢木霉。但由于木霉菌形态特征较复杂,同时缺乏稳定性[5],单从形态特征上不能准确确定分类地位。真菌rDNA - ITS序列因既具有保守性,又具有序列多态性,能够有效鉴定微生物的种属关系。本研究通过扩增JM-1菌株ITS序列并构建系统发育树发现,木霉菌JM-1菌株聚类在了Trichoderma asperellu:m进化分支上。分子生物学鉴定结果与形态学鉴定结果一致,明确了木霉菌JM-1菌株为棘孢木霉(Trichoderma asperellum)。
木霉菌可通过竞争作用、重寄生作用、抗生作用、诱导抗性和协同拮抗作用等多重生防机制防治植物病害[ll]。李琳等[6]筛选获得一株棘孢木霉T31菌株,该菌对玉米大斑病菌有较强的生长竞争优势,同时具有明显的重寄生作用。夏伟等[12]研究结果表明,棘孢木霉菌株I4能够通过竞争和抗生双重作用有效抑制立枯丝核菌的生长。本研究发现,棘孢木霉JM-1菌株能够快速占领生长空间,且能覆盖在麦根腐离蠕孢CY6菌落上,表明棘孢木霉JM -1菌株具有较强的空间和营养竞争优势,可通过竞争作用抑制CY6菌丝的生长。同时,棘孢木霉JM-1菌株还可缠绕在CY6菌株的菌丝上,通过重寄生作用吸取CY6菌丝的营养物质,使其菌丝发生断裂、解体。木霉菌发挥抗生作用而产生的抗菌物质主要有抗菌肽类、抗生素类以及挥发性物质[13],这些代谢产物能够引起病原菌菌丝原生质凝聚、菌丝变形解体[12,14],抑制病原孢子萌发[15]等。本研究显微观察发现,棘孢木霉JM-1菌株与麦根腐离蠕孢CY6菌株相交后,CY6菌丝发生变形、断裂、解体,分生孢子发生变形消解。由此可以推断,棘孢木霉JM -1菌株可能产生了某些抗菌物质,从而对麦根腐离蠕孢CY6菌株起到抗生作用。综上,棘孢木霉JM-1菌株可通过竞争作用、重寄生作用和抗生作用有效抑制麦根腐离蠕孢的生长。下一步将针对棘孢木霉JM-1菌株产生的抗生物质主要成分以及该菌株对小麦根腐病的生防作用做进一步研究。
参考文献:
[1]郭润芳,刘晓光,高克祥,等.拮抗木霉菌在生物防治中的应用与研究进展[J].中国生物防治,2002,18(4):180 -184.
[2] 吉海龙,伊洪伟,池玉杰.长枝木霉菌株T05抑菌活性与拮抗机制[J].东北林业大学学报,2016,44(1):114 -119.
[3] Samuels G J,Lieckfeldt E,NirenbergH I.Trichoderma a.s-perellum,a new species with warted conidia. and redesCriptionof Zviricle[J].Svdowia,1999,51(1):71 - 88.
[4] 章初龙,徐同.我国河北、浙江、云南及西藏木霉种记述[J].菌物学报,2005,24(2):184 -192.
[5] 夏伟,颜艳伟,张红,等.木霉菌Trl0的鉴定及其对几种病原菌的抑制作用[J].安徽农业科学,2010,38(5):2424 - 2426.
[6] 李琳,张雅梅,张祥辉,等.生防棘孢木霉T31菌株的分离筛选及其生物学特性[J].植物保护学报,2014,41(1):54 -60.
[7] 陈立华,金秋,牛明,等.棘孢木霉对水稻纹枯病病原菌立枯丝核菌生物防治的研究[J].江苏农业科学,2015,43(5):115 -117.
[8] 崔云龙,姬金红,衣海青.短小芽孢杆菌D82对小麦根腐病原菌拮抗的研究[J].中国生物防治,1995,11(3):114 - 118.
[9] 王立,王敏,马放,等.丛枝菌真菌对小麦的促生长效应与根腐病抑制效应[J].哈尔滨工业大学学报,2015,47(4):15 -19.
[10]张广志,杨合同,文成敬.木霉菌形态学分类检索与分子生物学鉴定[J].山东农业大学学报(自然科学版),2011,42(2):309 -316.
[11] 王永阳,杜佳,高克祥.苦瓜枯萎病生防木霉的筛选鉴定及其定殖的qPCR检测[J].山东农业科学,2018,50(8):110 - 115.
[12] 夏伟,张红,颜艳伟,等.棘孢木霉L4对立枯丝核菌的拮抗机制[J].植物保护学报,2010,37(5):477 -478.
[13] 李沖伟,杨立宾,邓勋,等.木霉菌株对金黄壳囊孢菌的抑菌效应及机制[J].林业科学,2012,48(9):88 -94.
[14] 朱天辉,邱德勋.Trichoderma harzzanum对Rhizoctonic solani的抗生现象[J].四川农业大学学报,1994,12(1):11 -15.
[15] 蒋妮,白丹宇,宋利沙,等.棘孢木霉F2菌株对三七灰霉病的生物防治作用[J].江苏农业科学,2018,46(20):94 - 97.
