HPLC法同时测定复方阿胶补血颗粒中4种氨基酸
2019-08-03尹宁宁郭东晓
尹宁宁,郭东晓
(1.山东省食品药品审评认证中心,山东济南250014;2.山东省食品药品检验研究院,山东 济南250101)
复方阿胶补血颗粒由阿胶、熟地黄和党参3味药组成,具有补气养血的功效,用于气血两虚所致的倦怠乏力、面色无华、头晕目眩、失眠多梦、心悸气短等症,以及缺铁性贫血见上述证候者。复方阿胶补血颗粒是湖南东健药业有限公司独家生产品种,最早收载于《安徽省药品标准》(1987年),原名“阿胶冲剂”。1992年5月14日湖南省药政局批准生产。2002年11月30日地标升国标,由原国家食品药品监督管理局批准为“复方阿胶补血颗粒”,收载于《国家中成药标准汇编》内科气血津液分册,标准号为WS-10319(ZD-0319)-2002。该标准含量测定项下仅收载总氮量的测定,方法专属性较差。参照《中国药典》2015年版阿胶含量测定项下[1]以及相关文献[2-10],本文研究建立了处方药味阿胶中L-羟脯氨酸、甘氨酸、丙氨酸、L-脯氨酸的HPLC含量测定方法,提高了含量测定方法的专属性。
1 仪器与试药
Agilent1200高效液相色谱仪;MettlerAE240电子天平(瑞士梅特勒-托利多公司);L-羟脯氨酸、甘氨酸、丙氨酸、L-脯氨酸对照品,购自中国食品药品检定研究院,批号分别为111578-200201、140689-200401、140680-200401、140677-200405;乙腈为色谱纯,其他试剂为分析纯。复方阿胶补血颗粒收集自湖南东健药业有限公司,规格为每袋装20g,批号分别为 20090101、20090103、20090701。
2 方法与结果
2.1 溶液的制备
2.1.1 混合对照品溶液的制备 精密称取L-羟脯氨酸对照品 9.73mg、甘氨酸对照品 18.14mg、丙氨酸对照品 8.12mg、L-脯氨酸对照品 13.31mg,加 0.1 mol·L-1盐酸溶液使溶解并定容至50mL。精密量取 3mL,置 10mL 量瓶中,加 0.1mol·L-1盐酸溶液稀释至刻度,摇匀,滤过,即得混合对照品溶液,每1 mL 含 L-羟脯氨酸 58.38 μg、甘氨酸 108.84 μg、丙氨酸 48.72 μg、L-脯氨酸 79.86 μg。
2.1.2 供试品溶液的制备 取装量差异项下的本品,研细,取约2.5g,精密称定,置具塞锥形瓶中,精密加入0.1mol·L-1盐酸溶液 20mL,密塞,称定重量,超声处理(功率500W,频率40kHz)30min,放冷,再称定重量,加0.1mol·L-1盐酸溶液补足减失的重量,摇匀,滤过,精密吸取续滤液2mL,置5mL安瓿中,加盐酸2mL,150℃水解1h,放冷,移至蒸发皿中,用水10mL分次洗涤,洗液并入蒸发皿中,蒸干,残渣加 0.1mol·L-1盐酸溶液溶解,滤过,滤液转移至25mL量瓶中,加0.1mol·L-1盐酸溶液稀释至刻度,摇匀,即得。
2.1.3 阴性对照溶液的制备 取处方中除阿胶以外的其他药味,照处方的组成和比例制成不加阿胶的阴性对照样品,并按“2.1.2”项下方法制成阴性对照溶液。
2.1.4 衍生化溶液的制备 精密量取上述混合对照品溶液、供试品溶液、阴性对照溶液各5mL,分别置25mL量瓶中,各加0.1mol·L-1异硫氰酸苯酯(PITC)的乙腈溶液 2.5mL,1mol·L-1三乙胺的乙腈溶液2.5mL,摇匀,室温放置1h后,加50%乙腈至刻度,摇匀。取10mL,加正己烷10mL,振摇,放置10min,取下层溶液,滤过,取续滤液,即得。
2.2 色谱条件及系统适用性试验 WatersSunfire C18色谱柱(4.6mm×250mm,5 μm);以乙腈-0.1 mol·L-1醋酸钠溶液(用36%乙酸调节pH值至6.5)(7∶93)为流动相A,以乙腈-水(4∶1)为流动相B,梯度洗脱(0~13min,100%A →93%A;13~17.9 min,93%A →88%A;17.9~29min,88%A →85%A;29~39min,85%A →66%A;39~45min,66%A →0%A);流速 1.0mL·min-1;测定波长 254nm;柱温 43℃;分别吸取“2.1.4”项下各溶液的衍生化溶液,进样量5μL。在上述条件下,4种氨基酸的色谱峰与相邻色谱峰的分离度均大于1.5,理论板数均大于6000。样品中其他成分对4种目标成分的测定没有干扰,色谱图见图1。
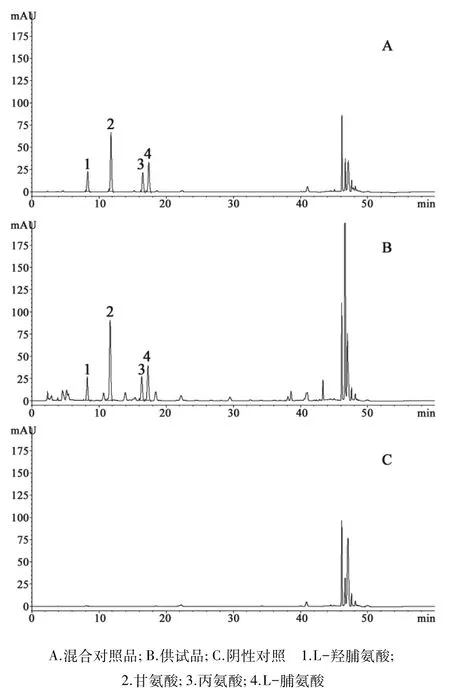
图1 HPLC色谱图
2.3 含量测定方法学验证
2.3.1 线性关系考察 精密吸取“2.1.4”项下混合对照品溶液的衍生化溶液各 1、2、3、4、5、10 μL,按“2.2”项下色谱条件进行测定,以各成分进样量X(μg)为横坐标,峰面积Y为纵坐标进行线性回归。结果在相应进样量范围内,4种成分线性关系良好,结果见表1。
2.3.2 精密度试验 精密吸取“2.1.4”项下混合对照品溶液的衍生化溶液5μL,注入液相色谱仪,连续进样6次,结果L-羟脯氨酸、甘氨酸、丙氨酸、L-脯氨酸峰面积的 RSD 分别为0.4%、0.4%、0.5%、0.4%。结果表明仪器的精密度良好。
2.3.3 稳定性试验 取“2.1.4”项下复方阿胶补血颗粒供试品溶液(批号:20090103)的衍生化溶液分别于 0、2、4、6、8、12h 分别进样 5 μL,结果 L-羟脯氨酸、甘氨酸、丙氨酸、L-脯氨酸峰面积的RSD分别为 0.7%、0.4%、0.4%、0.6%。表明供试品溶液中的4个待测成分在室温放置12h内稳定性良好,能够满足测定需要。
2.3.4 重复性试验 取复方阿胶补血颗粒样品(批号:20090103,平均装量 20.2307g),按照“2.1.2”项下方法,平行制备 6份供试品溶液,然后按照“2.1.4”项下方法,分别制备上述供试品溶液的衍生化溶液,进样5μL进行测定。结果L-羟脯氨酸平均含量为 143.5mg/袋,RSD 为 0.7%;甘氨酸平均含量为 279.8mg/袋,RSD 为 1.9%;丙氨酸平均含量为109.0mg/袋,RSD 为 1.7%;L-脯氨酸平均含量为172.0mg/袋,RSD 为 1.0%。结果表明该测定方法的重复性良好。
2.3.5 加样回收率试验 取“2.3.4”项下已测定含量的复方阿胶补血颗粒(批号:20090103)粉末约1.25g,共取6份,精密称定,置具塞锥形瓶中,分别精密加入L-羟脯氨酸、甘氨酸、丙氨酸、L-脯氨酸对照品适量,按照“2.1.2”项下方法自“精密加入 0.1 mol·L-1盐酸溶液20mL”起,同法制备供试品溶液,然后按照“2.1.4”项下方法,分别制备上述供试品溶液的衍生化溶液,进样5μL进行测定,并计算4种待测成分的加样回收率,结果见表2。试验结果表明,含量测定方法回收率良好。
2.4 样品测定 取收集到的3批复方阿胶补血颗粒样品,按照“2.1.2”项下方法制备供试品溶液,然后按照“2.1.4”项下方法,分别制备上述供试品溶液的衍生化溶液,进样5μL进行测定。结果见表3。
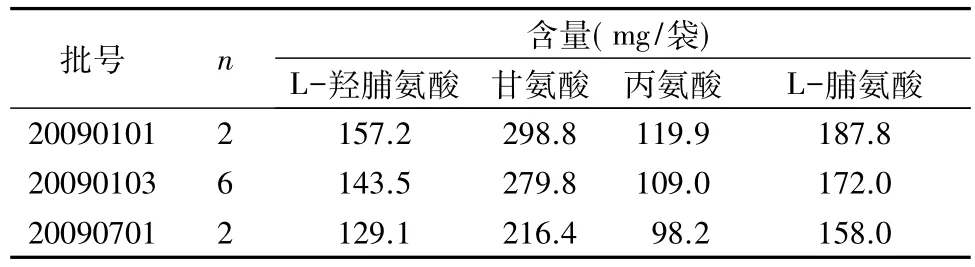
表3 3批复方阿胶补血颗粒中4种氨基酸的测定结果
3 讨论
3.1 色谱柱的考察 对3个品牌的色谱柱进行考察,包括 WatersSunfireC18、迪马 KromasilC18、InertsilODS-3C18(均为4.6mm×250mm,5 μm),结果对照品溶液和供试品溶液的衍生化溶液色谱图中,4种氨基酸色谱峰均有良好的对称因子、理论板数及分离度,表明该方法对色谱柱无选择性,适用范围广。
3.2 取样量的考察 分别取 2.0、2.5、3.0g 样品,精密称定,按照“2.1.2”项下方法制备供试品溶液,然后按照“2.1.4”项下方法,制备供试品溶液的衍生化溶液,进样测定。3种取样量的测定结果没有显著差异,但取样量为3.0g时,L-羟脯氨酸的峰形较差,为了确保分离效果,同时考虑到取样的均匀性,选择取样量为 2.5g。
3.3 检测结果的分析 《中国药典》2015年版阿胶药材含量测定项下,规定L-羟脯氨酸、甘氨酸、丙氨酸、L-脯氨酸不得少于 8.0%、18.0%、7.0%、10.0%[1]。根据复方阿胶补血颗粒中阿胶的处方量(50g)、制剂的制成总量(1000g)、规格(每袋装20g)进行折算,L-羟脯氨酸、甘氨酸、丙氨酸、L-脯氨酸的理论含量分别为不得少于 80.0、180.0、70.0、100.0mg。按转移率为90%进行折算,建议规定本品含量限度为每袋含阿胶以L-羟脯氨酸计,不得少于72.0mg;以甘氨酸计,不得少于 162.0mg;以丙氨酸计,不得少于 63.0 mg;以L-脯氨酸计,不得少于90.0mg。收集的3批样品均符合上述规定。
