稻草炭/g-C3N4的制备及其吸附性能研究
2019-08-02王洪杰兰依博温彪金石郭亮李晓东
王洪杰,兰依博,温彪,金石,郭亮,李晓东
(1.吉林建筑大学 材料科学与工程学院,吉林 长春 130118;2.吉林建筑大学 基础科学部,吉林 长春 130118)
稻草占农业废弃物的最大份额[1],是一种低膳食纤维植物[2-3],在限氧条件下热解制得生物炭,相较于活性炭,其表面极性官能团对染料具有极强的吸附能力[4],且生产成本更低[5-6]。亚甲基蓝(MB)是一种具有噻嗪结构的共轭性杂环阳离子染料[7],处理方法主要有氧化法[8]、生物法[9]以及吸附法等,其中吸附法是一种有效、廉价、通用的处理方式[10]。g-C3N4具有高比表面积,且其表面的化学官能团能提供高亲和活性的吸附位点,进而增加对污染物的络合能力。
本实验通过热解法制得生物炭和g-C3N4,再通过浸渍法合成生物炭基氮化碳(BC/g-C3N4),探究其对亚甲基蓝的吸附效果及机理。
1 实验部分
1.1 试剂与仪器
稻草,取自长春市周边农田;MB、尿素、NaOH、HCl均为分析纯;实验用水均为去离子水。
SKM-SW-HA型马弗炉;DHG型电热恒温鼓风干燥箱;AB223型电子分析天平;PHS-3C型pH计;TD4型台式高速离心机;UV-1700型紫外可见分光光度计;KQ-250DE型数控超声波清洗器;HJ-4B型多头磁力加热搅拌器;SUPRA40 型SEM;FTIR Spectrum100 型傅里叶红外光谱仪。
1.2 BC/g-C3N4复合材料的制备
1.2.1 稻草炭的制备 稻草经清洗、超声去除表面粘附物后,置于60 ℃烘箱中烘干至恒重。剪成长度约为2 cm 的段状,装入带盖陶瓷坩埚中,以15 ℃/min速率升温到300 ℃,恒温保持5 h。冷却到室温后,过150目标准筛,即获得BC。
1.2.2 g-C3N4的制备 称取一定量的尿素,置于带盖陶瓷坩埚中,以5 ℃/min升温至550 ℃,恒温4 h。冷却至室温后取出,过150目标准筛后,即获得g-C3N4。
1.2.3 BC/g-C3N4复合材料的制备 分别称一定量BC与g-C3N4至于烧杯中,加入去离子水,超声形成悬浮液,混合超声30 min,40 ℃水浴搅拌2 h后,60 ℃干燥至恒重。
1.3 吸附实验
在室温下,取250 mL浓度50 mg/L的MB溶液于容器中,改变pH值,投加0.16 g/L掺杂比1∶3的BC/g-C3N4,高速搅拌一定时间后,取上层清液并离心,测定溶液中染料浓度。每个点多次测量,取平均值。
生物炭对MB的吸附量(qt)和去除率(η)分别按下式计算:
qt=(C0-Ct)V/m
(1)
η=1-Ct/C0
(2)
其中,C0和Ct分别为MB的初始和t时刻质量浓度,V为溶液体积,m分别为BC、g-C3N4、BC/g-C3N4的质量。
2 结果与讨论
2.1 生物炭的结构特征
2.1.1 SEM 由图1a可知,BC以小的块状和带状织构形式出现,具有多孔结构。由图1b可知,复合材料的局部及放大部分,除具有相同的外观形貌外,在BC表面上还出现了与g-C3N4的结合位点,且包覆比较均匀分散,两者在结合的基础上还保持着各自原生形态。


图1 BC(a)和BC/g-C3N4(b)扫描电镜图Fig.1 SEM image of BC (a) and BC/g-C3N4 (b)


图2 BC、g-C3N4、BC/g-C3N4红外光谱图Fig.2 FTIR spectra of BC,g-C3N4 and BC/g-C3N4
2.2 各组分及掺杂比对吸附的影响
由图3可知,吸附在120 min后基本达到平衡,且复合材料的吸附量分别是单一组分的2.70倍和3.76倍,在BC载体上负载g-C3N4增加了其表面积以及表面官能团,明显提升了吸附性能。由图4可知,掺杂比为1∶3时,吸附率最大,为95.32%。g-C3N4的含量过少时,不能完全包覆在BC表面,只是个别位点存在且不均匀分散,而当g-C3N4持续增加时,过量的部分在BC表面发生团聚,降低了MB在复合材料上的附着点,同时也减弱了官能团间的作用力。

图3 各组分的吸附效果Fig.3 Adsorption effect of each component

图4 掺杂比对吸附效果的影响Fig.4 Influence of doping ratio on adsorption effect
2.3 pH值对吸附的影响
pH值是BC/g-C3N4吸附MB的关键因素,图5显示了不同pH条件下其对MB的去除效果。

图5 pH值对吸附效果的影响Fig.5 Influence of pH on adsorption effect
由图5可知,pH=11时的吸附量最大,说明碱性环境更有利于MB在复合材料上的吸附。在酸性环境中,溶液中存在过剩的H+/H3O+,消耗 —OH和 —COOH等官能团所提供的结合位点,且生物炭表面被质子化,正电荷增多产生脉冲作用[12]。pH值增大后,H+/H3O+离子浓度降低,MB与吸附剂之间的静电吸引能力加强,同时溶液中H+与OH-浓度差距逐渐缩小,吸附剂表面的质子化/去质子化效应不明显,因而对MB的吸附量呈上升,并逐渐平缓的趋势[13]。
2.4 投加量对吸附的影响
投加量对吸附效果的影响见图6。

图6 投加量对吸附效果的影响Fig.6 Influence of dosage on adsorption effect
由图6可知,BC/g-C3N4的吸附量随着投加量的增加而呈下降趋势,投加过量的吸附剂,将导致吸附点位过剩,生物炭对MB的吸附量下降,而使MB的去除率迅速上升,投加量>0.16 g/L时,去除率趋于稳定。综合考虑吸附量、去除率和吸附剂成本等,适宜投加量为0.16 g/L。
2.5 吸附动力学
为了研究吸附机理,采用4种动力学模型对实验数据进行拟合[14],结果见图7、图8和表1。
准一级动力学模型:qt=qe(1-e-K1t)
(3)
(4)
Elovich模型:qt=A+Blnt
(5)
颗粒内扩散模型:qt=Kit1/2+Ci
(6)
其中,qe为MB的平衡吸附量,t为吸附时间,K1、K2、Ki为各模型的速率常数,A、B、Ci分别为相关常数,i为颗粒内扩散阶段。

图7 BC/g-C3N4对MB的吸附动力学Fig.7 Adsorption kinetics of BC/g-C3N4 on MB

图8 BC/g-C3N4对MB的颗粒内扩散模型Fig.8 Intraparticle diffusion model of BC/g-C3N4 on MB
由图7、表1可知,准二级动力学拟合效果优于准一级动力学,因此,BC/g-C3N4对染料的吸附包含化学作用[15]。Elovich模型描述了由反应速率和扩散因子综合调控的非均匀扩散过程。相关系数R2>0.900,表明MB在生物炭上的吸附是一个非均相扩散过程,而不是简单的一级反应,与准二级动力学模型的结果一致。
为确定BC/g-C3N4对MB作用的实际控制步骤,利用内扩散模型对实验数据进行拟合,结果见图8、表2。
由图8可知,拟合线分为两个阶段,第1阶段为 MB从溶液中扩散至BC/g-C3N4表面,第2阶段为MB 在BC/g-C3N4内部扩散。两阶段拟合线均未通过零点,说明MB溶液在生物炭上的颗粒内扩散不是唯一的速率控制步骤[16]。吸附速率也受外扩散步骤(表面吸附和液膜扩散)的影响。K1明显大于K2(表2),说明初始阶段吸附速率较快,第2段拟合线几乎呈水平状,说明吸附在第2 阶段是控速步骤,随着反应的进行,MB浓度降低,导致K2明显减小,最终达到平衡状态。

表1 吸附动力学参数

表2 BC/g-C3N4吸附MB的颗粒内扩散模型参数
2.6 等温吸附及热力学
为了描述MB溶液在BC/g-C3N4上的吸附等温过程,本实验采用Langmuir-Freundlich模型、Langmuir模型、Freundlich模型和Temkin模型对实验数据进行拟合,结果见图9、图10及表3。



图9 BC/g-C3N4吸附MB的等温吸附线Fig.9 Adsorption isotherm of BC/g-C3N4 on MBa.298 K;b.308 K;c.318 K
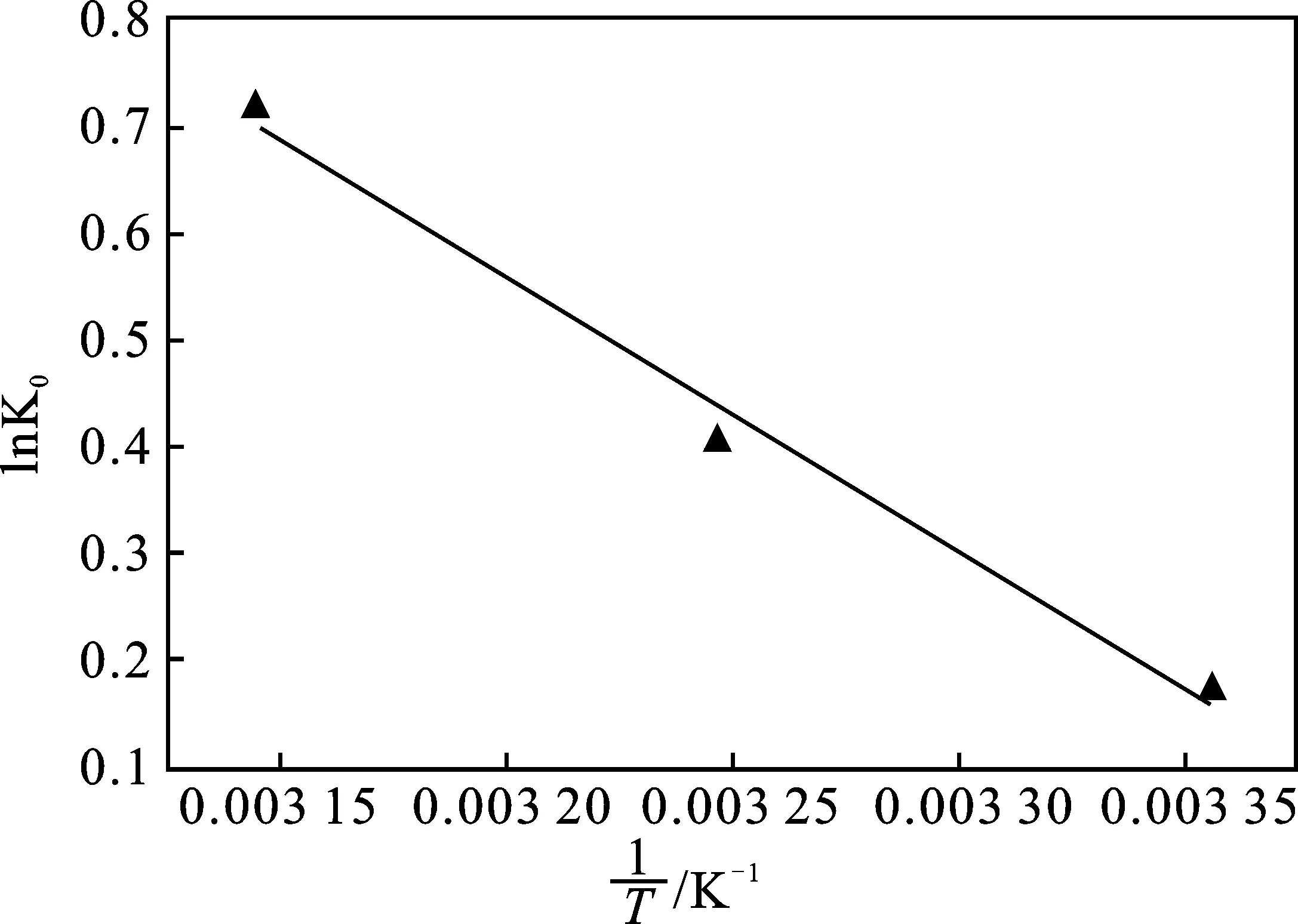
图10 BC/g-C3N4吸附MB的lnK0对1/T的拟合Fig.10 BC/g-C3N4 adsorption MB lnK0 fit 1/T

表3 吸附等温线参数
随着世界食素人数的增多,素食文化的研究空白也逐渐被人所意识。素食不只是与人的生理健康有所关联,与宗教、经济、政治等因素都相关,且值得被探讨。而世界多地的素食文化研究在还属于空白,素食文化又具有一系列研究意义,因此,对研究者而言,也意味着巨大的研究机遇。
(7)
(8)
(9)
Temkin模型:qe=D+ElnC
(10)
其中,qm为理论最大吸附量,KL为Langmuir模型常数,Ce为吸附平衡时MB质量浓度,α为Langmuir-Freundlich模型常数,n为与吸附强度有关的经验常数;KF为Freundlich模型常数;D、E为Temkin模型常数。
由图9可知,BC/g-C3N4在不同温度下对MB的吸附平衡曲线有相似的趋势,随着亚甲基蓝浓度的增大,吸附量也随之增大,且当MG浓度>200 mg/L时,吸附量仍呈现逐渐上升的趋势。
由表3可知,Langmuir-Freundlich模型(R2>0.99)和Langmuir模型(R2>0.98)模型很好地描述了吸附过程,由此可知MB溶液在BC/g-C3N4上的吸附主要发生在单分子吸附上。温度升高,最大吸附容量也随之增大,这表明提高操作温度可以增强吸附性能。在本研究中,Temkin等温线很好地拟合了观测结果(R2=0.893~0.938),因此,静电相互作用是影响BC/g-C3N4与MB相互作用的重要机制。
通过Langmuir模型(R2=0.991~0.983)对热力学参数进行计算。吸附过程中的吉布斯自由能变化与温度(T)和热力学标准平衡常数K0有关,在无限稀释条件下,可根据热力学定律用浓度代替活性,因此通过不同初始浓度MB的表观平衡常数(Kd)外推到零并求出平衡常数,进而得到无纲量方程[17]。
Kd=Ca,e/Ce
(11)
qe=(Ci-Ce)(V/m)=Ca,e
(12)
将公式(7)、(11)和(12)重排得:
(13)
在无限稀释条件下:
(14)
ΔG0=-RTlnK0
(15)
lnK0=ΔS0/R-ΔH0/RT
(16)
其中,Ca,e是平衡时单位体积溶液中吸附剂的吸附量,Kd是表观平衡常数,K0是平衡常数,其它与上相同。
参数ΔS0、ΔH0可由lnK0与1/T图的斜率和截距求得(图10),吸附热力学参数列于表4。

表4 吸附热力学参数
由表4可知,在不同温度下,ΔG0为负值,表明吸附反应是自发的、有利的,同时,随着温度的升高,ΔG0值的下降越大,表明温度升高有利于MB的吸附。ΔH0为正值,表明MB在BC/g-C3N4的吸附是吸热的;ΔS0正值,表明MB在BC/g-C3N4吸附过程中,固/液界面的随机性(或无序性)增加[18]。
2.7 吸附机理分析
随着对BC煅烧温度的提升(400,500,600 ℃),BC表面具有更多典型的芳香性结构,形成更多π-π键,BC与MB之间的离子静电力减弱。实验结果(去除率):BC300(95%)>BC400(68%)>BC600(33%)>BC500(29%),表明低温裂解具更好吸附MB的性能,因此,针对亚甲基蓝等阳离子染料,应优先考虑裂解温度较低、极性较大的生物炭[15]。与许多其他化合物一样,g-C3N4粉末在水悬浮液中表现出质子化和去质子化。这两个过程的化学本质包括氢离子、羟基离子和氮化碳表面的某些基团之间的相互作用。在不同pH条件下,这些化学相互作用的程度是不同的,从而导致g-C3N4样品的表面电荷和Zeta电位不同。因此,g-C3N4表面的C—N杂环和N—H配位基团以及表面静电吸附起着至关重要的作用[19]。
准二级动力学拟合的结果表明,BC/g-C3N4对染料的吸附主要通过两者间的化学键作用;而Langmuir-Freundlich模型的拟合结果则说明,吸附不是受单一的机制控制。颗粒内扩散模型表明吸附受颗粒内扩散和外扩散共同控速影响。FTIR表明,BC/g-C3N4表面主要由极性含氧官能团(羧基、羟基、酚羟基、醚、酯)组成,结合吸附曲线特征,以及按亚甲基蓝实验方案对阴离子染料甲基橙进行吸附实验,吸附效率仅为对亚甲基蓝的87%,进一步可推断BC/g-C3N4对阳离子染料MB的吸附存在离子交换作用。

3 结论
BC/g-C3N4复合材料的吸附性能优于单一组分,且在碱性条件下(pH=11)尤为显著,当掺杂比为1∶3时,g-C3N4在BC上分散较为均匀,官能团数量增加,投加0.16 g/L左右就能达到极佳的吸附效果。
吸附过程符合准二级动力学模型(R2=0.966),反应受物理和化学吸附共同作用,颗粒内扩散模型进一步说明BC/g-C3N4吸附过程包括表面吸附和颗粒内扩散。
在不同温度条件下,Langmuir-Freundlich模型能很好地描述吸附过程(R2>0.99),通过热力学参数计算得,ΔG0<0反应自发进行,ΔH0>0、ΔS0>0,反应是吸热反应且随着温度增加无序性程度加大。
