柠檬酸交联对谷朊纤维稳定性能的影响
2019-08-02朱小颖温乐蛟马博谋曹秀明侯秀良
朱小颖,温乐蛟,马博谋,,曹秀明,侯秀良
(1.江南大学 生态纺织教育部重点实验室,江苏 无锡 214122;2.江苏阳光股份有限公司,江苏 江阴 214426)
谷朊粉是小麦淀粉加工过程中的副产物,其中蛋白质含量75%~85%,延伸性和生物相容性比其他植物蛋白更好,是制备高品质生物材料的理想原料[1]。但限制其纤维应用的主要问题之一是稳定性较差。目前,解决的主要方法是对纤维进行交联处理[2],对蛋白进行交联多使用戊二醛[3]、谷氨酰胺转酶[1]等,其中戊二醛交联处理过程有甲醛等有害物质;谷氨酰胺转胺酶价格贵,对反应条件要求高。柠檬酸安全无毒,价格低廉,作为谷朊纤维的交联剂更具有实用价值。
本文基于研究室研究柠檬酸交联处理谷朊纤维的力学性能的基础上[4-5],深入研究了此方法对谷朊纤维稳定性的影响。
1 实验部分
1.1 试剂与仪器
谷朊粉(蛋白质含量86%),无锡山紫凌云商贸有限公司;一水合柠檬酸、亚硫酸钠、硫酸钠、尿素均为分析纯。
XL-21湿法纺丝机;GZX-9140 MBE电热鼓风干燥箱。
1.2 实验方法
1.2.1 谷朊纤维制备 采用湿法纺丝方法制备谷朊纤维,过程见图1。
1.2.2 交联处理 对纤维的交联处理采用柠檬酸水溶液浸泡法,处理后的纤维同样进行第二次牵伸、干燥和热处理[4],得到交联谷朊纤维,其过程见图1。

图1 谷朊纤维和交联处理后的谷朊纤维的制备流程图Fig.1 Preparation scheme of gluten fibers and crosslinked gluten fibers
1.3 纤维结构测试方法
1.3.1 谷朊分子量 制备浓缩胶浓度为5%、分离胶浓度为10%的SDS-PAGE凝胶,将样品剪碎,用玛瑙研钵研磨成粉末,溶解于蛋白质电泳上样缓冲液,制成电泳上样液。将静置后的凝胶装进电泳仪,倒入甘氨酸缓冲液,上样跑胶,跑胶结束后,将凝胶用考马斯亮蓝染色液染色3 h,脱色液脱色3 h后拍照[5]。
1.3.2 谷朊大分子构象 将测试样品保存在干燥皿中,测试前在85 ℃热空气中烘干2 h,试验台使用氮气吹扫排除水分干扰。采用ATR法采集测试样品的红外光谱信息。对红外光谱图酰胺Ⅰ区的处理采用FSD法分峰和曲线拟合法分峰。
1.4 纤维稳定性能测试方法
1.4.1 热稳定性
1.4.1.1 差示扫描量热分析(DSC) 测试前将样品用玛瑙研钵在红外灯下研磨成粉末,称取质量相近的试样坩埚与对比坩埚,称取5 mg左右的样品装入试样坩埚中并密封。将试样坩埚与对比坩埚放入DSC测试仪器开始测试,测试范围0~260 ℃,升温速率5 ℃/min,氮气流速50 mL/min。
1.4.1.2 热重分析(TG) 测试前将样品用玛瑙研钵在红外灯下研磨成粉末,称取5~10 mg的样品粉末用于测试,测试范围0~500 ℃,升温速率 20 ℃/min。
1.4.2 耐水解稳定性 把谷朊纤维和交联谷朊纤维在不同pH值(4,7,9)和不同温度(25,30,37,40,45 ℃)缓冲溶液下处理,浴比为1∶200,以缓冲体系中溶解出的蛋白含量评价纤维的水解稳定性。
紫外分光光度计法测试蛋白质含量。每隔一定的时间,吸取一定量的蛋白溶液(并补充相应体积的空白溶液),根据缓冲液278 nm处吸光度A278在标准曲线上查出缓冲液中蛋白质的浓度[6]。
2 结果与讨论
2.1 柠檬酸交联对谷朊纤维热稳定性的影响
谷朊粉、谷朊纤维与交联谷朊纤维的DSC曲线见图2。

图2 谷朊粉、谷朊纤维、交联谷朊纤维DSC曲线Fig.2 DSC curves for gluten,gluten fibers,cross-linked gluten fibers
由图2可知,谷朊粉、谷朊纤维与交联谷朊纤维均有一个较强的水分挥发峰,谷朊粉的峰尖位于83.75 ℃处,而谷朊纤维和交联谷朊纤维的峰位都向高温方向偏移,分别为88.31,95.20 ℃,很明显谷朊纤维的峰面积大于交联谷朊纤维。前者由于谷朊粉结构松散,大分子二级结构杂乱,疏水基团外露较多,疏水性强;而谷朊纤维结构相对紧密,且凝固时,疏水基团向分子内部移动[7],大分子的亲水能力提高,升温过程中水分流失速度相对较慢。而后者交联作用产生的差异,则是由于谷朊纤维大分子间产生交联作用,纤维结构趋于紧密,纤维含水量下降,水分挥发峰减小,升温的过程中水分挥发的难度上升,水峰向高温方向偏移。谷朊粉、谷朊纤维与交联谷朊纤维的熔融峰分别位于208.02,209.65,211.04 ℃处,温度向高温方向偏移,这可能是由于蛋白质分子量的上升。分子量上升,蛋白质大分子克服阻碍内旋转的势能难度以及分子构象改变的难度都随之上升,所以通常情况下分子量增加后熔融温度会有所上升。
谷朊纤维、交联谷朊纤维的TG曲线见图3。


图3 谷朊纤维(a)、交联谷朊纤维(b)TG曲线Fig.3 TG curves for gluten fibers(a) and cross-linked gluten fibers(b)
由图3可知,纤维的热失重主要分为三个阶段:阶段1在0~150 ℃由于水分挥发失重,阶段2在150~340 ℃区间共价肽键断裂导致的蛋白质分解失重,阶段3在340~500 ℃区间由于S—S键、O—N键、O—O断裂导致的蛋白质分解失重[8-9]。与谷朊纤维相比,交联谷朊纤维失重率在阶段2减少1.09%,在阶段3增加2.89%,且初始温度偏小,这可能是由于柠檬酸对蛋白质大分子的交联作用使得一部分不含二硫键的肽链与含二硫键的肽链发生交联,这部分肽链受与之相近的二硫键的影响,热学性能相对稳定,在共价肽键发生断裂的阶段2没有发生分解,但其在二硫键断裂后热学稳定性迅速下降从而发生分解,即阶段3的初始温度偏小。因此,交联谷朊纤维热学性能总体上是上升的。
2.2 柠檬酸交联对谷朊纤维水解稳定性的影响
在温度37 ℃、不同pH值下谷朊纤维与交联谷朊纤维的水解稳定性见图4。
由图4可知,随着水解时间的增加,浸泡谷朊纤维和交联纤维的pH 4缓冲液中蛋白质的浓度几乎不增加;而浸泡谷朊纤维和交联谷朊纤维的pH 9缓冲液中的蛋白质浓度略微上升,在48 h时分别达到0.45 mg/mL和0.40 mg/mL;浸泡谷朊纤维和交联谷朊纤维的pH 7缓冲液中的蛋白质浓度在48 h时分别达到3.8 mg/mL和3.0 mg/mL。与谷朊纤维相比,交联谷朊纤维在不同pH值下水解稳定性均有所上升,这是由于柠檬酸对谷朊纤维的交联作用使得大分子间和分子内的肽键增多,其在水解过程中断裂出小分子的可溶性蛋白质所需的时间也相对增加,因此交联作用后的纤维水解稳定性上升。另外,无论交联与否,谷朊纤维在pH 4,9的缓冲液中蛋白质损失的量均小于pH 7的缓冲液。究其原因,谷朊大分子的等电点偏酸性,在pH 4时谷朊大分子的溶解度较低,其水解稳定性较好,而pH 7的磷酸盐缓冲液与pH 9的硼酸缓冲液都能与蛋白质大分子发生作用,但磷酸盐缓冲液对蛋白质大分子的影响更加剧烈,能够使其带有负电荷[10],因此pH 7的缓冲液中蛋白质浓度较高。

图4 谷朊纤维、交联谷朊纤维在不同pH下的水解稳定性(水解温度37 ℃)Fig.4 Hydrolytic stability of gluten fibers,cross-linked gluten fibers at different pH (hydrolysis temperature 37 ℃)
在pH为7,不同温度下谷朊纤维与交联谷朊纤维的水解稳定性见图5。

图5 谷朊纤维、交联谷朊纤维在不同温度下的水解稳定性(pH 7)Fig.5 Hydrolytic stability of gluten fibers,cross-linked gluten fibers at different temperatures (pH 7)
由图5可知,在温度为25 ℃和30 ℃条件下保温48 h,交联与未交联纤维的缓冲液中蛋白质浓度相对稳定,均低于1 mg/mL。随着温度升高,缓冲液中蛋白质的浓度增加,速度趋于剧烈,37 ℃、48 h下的缓冲液中蛋白质浓度分别为3.81 mg/mL和3.04 mg/mL。随着温度的升高,纤维的稳定性继续下降。45 ℃、48 h 下则分别为5.23 mg/mL和4.25 mg/mL。由此可知,交联处理能够有效提高谷朊纤维的水解稳定性,同时谷朊纤维的水解稳定性也随温度的升高而降低。前者是由于柠檬酸对于谷朊纤维的交联作用使得大分子间和分子内的肽键增多,其在水解过程中断裂出小分子的可溶性蛋白质所需的时间也相对增加,因此交联谷朊纤维的水解稳定性上升。后者则由于温度升高,蛋白质大分子的链段运动趋于剧烈,纤维溶胀程度高。
2.3 柠檬酸交联对谷朊纤维分子量的影响
谷朊纤维与交联谷朊纤维的SDS-PAGE见图6。

图6 谷朊纤维(a)、交联谷朊纤维(b)SDS-PAGE图Fig.6 Gluten fibers(a) and cross-linked gluten fibers(b) SDS-PAGE figure
由图6可知,谷朊纤维经过柠檬酸溶液交联处理后分子量在100 k以上的大分子数量明显增多,表明谷朊纤维经过柠檬酸溶液交联处理后,蛋白质大分子间产生交联作用,分子量明显上升。
在交联反应发生的过程中,柠檬酸-蛋白质分子之间发生图7a所示的亲核取代反应,最终的交联反应产物见图7b[11]。


a.柠檬酸羧基与谷朊蛋白质分子氨基亲核取代反应b.柠檬酸-谷朊蛋白分子交联反应图7 柠檬酸-谷朊蛋白分子交联反应机理Fig.7 Cross-linking reaction mechanism between citric acid and gluten protein molecules
2.4 柠檬酸交联对谷朊纤维大分子构象的影响
谷朊粉、谷朊纤维、交联谷朊纤维FTIR图谱见图8。

图8 谷朊粉(a)、谷朊纤维(b)、交联谷朊纤维(c)FTIR图Fig.8 FTIR for gluten(a),gluten fibers(b) and cross-linked gluten fibers(c)
由图8可知,谷朊粉、谷朊纤维、交联谷朊纤维FTIR图谱都是十分相似的,而主要发生变化的则为其酰胺区峰位波数的移动,这主要是由于蛋白质大分子构象的变化。与谷朊粉相比,谷朊纤维红外酰胺区峰位向低波数平移,这主要由于谷朊粉中蛋白质大分子构象以红外吸收峰在高波数处的α螺旋构型为主,而谷朊纤维蛋白质大分子构象则以低波数处的β折叠构型为主。谷朊粉在酰胺Ⅱ区的峰形为杂乱的平台形,而谷朊纤维的酰胺Ⅱ区峰形圆滑整齐,尤其是还原剂对二硫键的破坏并重建这一过程后[12],谷朊纤维中的蛋白质大分子构象趋于统一,故而酰胺Ⅱ区峰形趋于平滑。另外,由图8可以看出,交联谷朊纤维的红外光谱与谷朊粉的更为接近,与谷朊粉相比,酰胺Ⅰ区峰和酰胺Ⅱ区峰向高波数移动。究其原因,可能是谷朊纤维在柠檬酸溶液中受到碱性条件的影响,蛋白质大分子发生一定的变形,原本由于纺丝形成的相对统一的构象发生了变化,在高波数区的构象增多。
蛋白质红外光谱酰胺Ⅰ区对于研究构象最有价值,对谷朊粉、谷朊纤维以及交联谷朊纤维的红外光谱酰胺Ⅰ区分峰见图9。

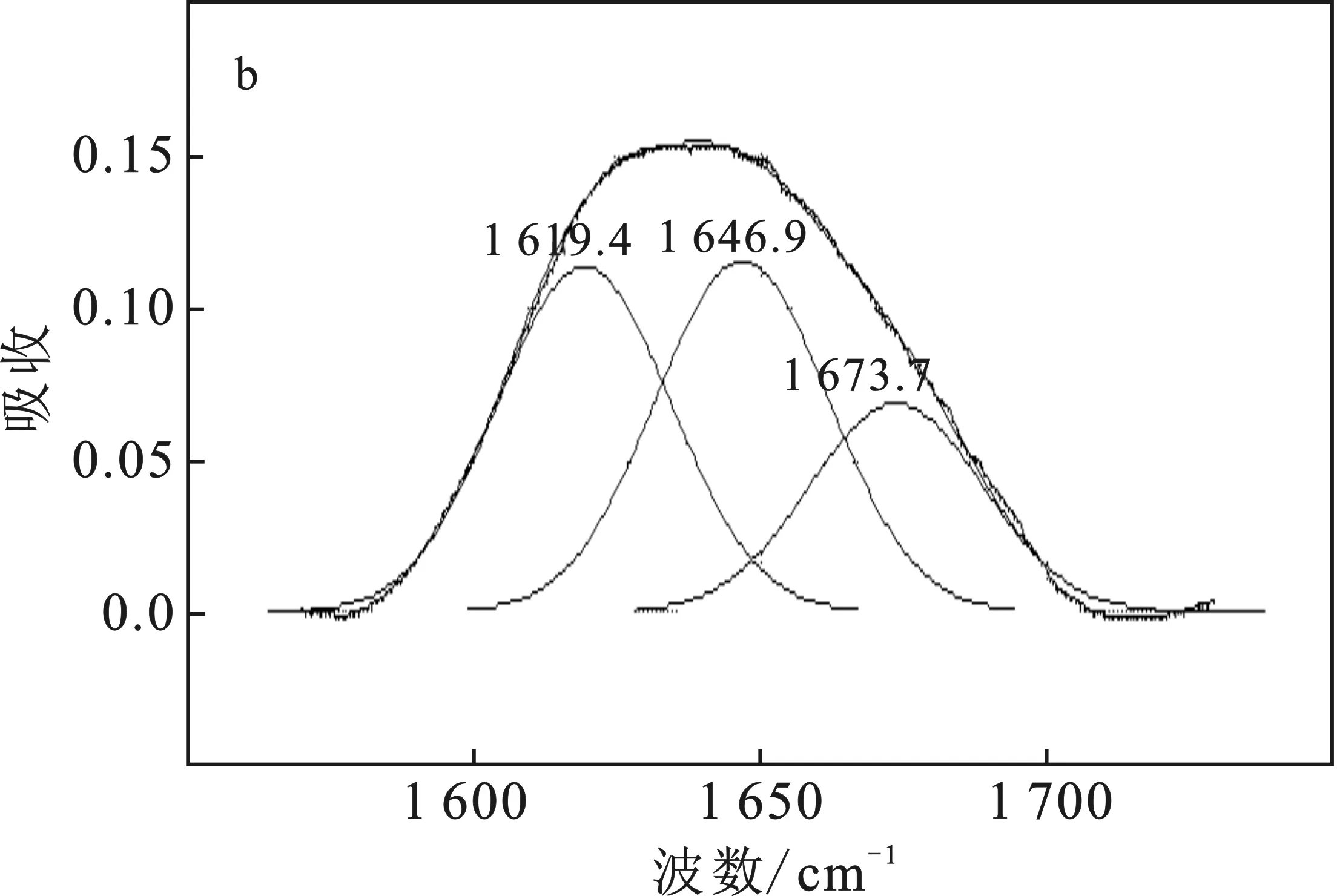

图9 谷朊粉(a)、谷朊纤维(b)、交联谷朊纤维(c)FTIR酰胺Ⅰ区分峰图Fig.9 Peak fits of FTIR amide I areas for gluten(a),gluten fibers(b) and cross-linked gluten fibers(c)
由图9可知,谷朊粉中蛋白质大分子构象复杂多样,1 688,1 676 cm-1以及1 610~1 640 cm-1处出现β-折叠峰,1 652 cm-1处出现明显的α-螺旋峰,1 643 cm-1处出现明显的无规卷曲峰,而谷朊纤维中大分子构象峰相对较少,主要是出现在1 690 cm-1处的β-转角或β-折叠峰,1 649 cm-1处的无规卷曲峰,β-折叠区仅有1 621 cm-1处的弱氢键β-折叠峰。这主要是由于谷朊粉中的蛋白质大分子构象杂乱,但经过尿素溶液溶解后纺丝,尤其是还原剂对二硫键破坏并重建后,谷朊纤维中的蛋白质大分子构象趋于统一。
与谷朊纤维相比较,交联谷朊纤维的构象发生明显变化。其中β-折叠分化为两个峰:位于1 610 cm-1处的强氢键β-折叠峰和位于1 627 cm-1处的弱氢键β-折叠峰。同时1 690 cm-1处的β-转角峰弱化,1 666 cm-1处的β-转角峰变明显,无规卷曲峰向低波数偏移至1 647 cm-1处。1 594 cm-1处的谷氨酰胺侧链(NH2)峰变明显,更接近于谷朊粉。究其原因,可能是谷朊纤维在柠檬酸溶液中受到碱性条件的影响,蛋白质大分子发生一定的变形,原本由于纺丝形成的相对统一的构象发生了变化,在高波数区的构象增多。
谷朊粉、谷朊纤维、交联谷朊纤维酰胺Ⅰ区FTIR构象与含量对比见表1。
由表1可知,谷朊粉中大分子构象以β-折叠为主,而交联谷朊纤维中的β-折叠构象数量增多且发生分化,通过构象的含量充分说明了谷朊纤维经过柠檬酸溶液交联处理后,蛋白质大分子间确实是产生了交联作用,使之构象增多。另外可以明显看出,谷朊粉纺丝成谷朊纤维后α-螺旋结构几乎没有了。

表1 谷朊粉、谷朊纤维、交联谷朊纤维FTIR二级结构与含量对比
3 结论
(1)柠檬酸交联处理可有效提高谷朊纤维中蛋白质大分子分子量,尤其在大分子量100 k以上有显著体现。
(2)柠檬酸交联处理可使大分子β-折叠构象数量增多,无规卷曲构象数量明显减少,大分子结构稳定。
(3)柠檬酸交联谷朊纤维结构上的变化直接导致了热稳定性的提高,TG图中各个峰值都向高温偏移。
(4)柠檬酸交联谷朊纤维结构上的变化直接导致了水解稳定性的提高,在pH 7处,很明显水解稳定性提高了21%。
