骨骼肌挫伤修复过程中巨噬细胞的趋化机制
2019-08-02刘晓光陈佩杰赵淋淋曾志刚肖卫华
刘晓光, 陈佩杰, 赵淋淋, 曾志刚,2, 肖卫华
(1.上海体育学院 运动科学学院,上海 200438; 2.井冈山大学 体育学院,江西 吉安 343000)
骨骼肌是人体最重要的器官之一,约占体质量的40%。骨骼肌收缩牵拉骨骼绕关节转动,为人体运动提供动力。骨骼肌具有较强的损伤后再生能力,而这种再生能力主要依赖于肌卫星细胞[1]。肌卫星细胞是一种肌原性前体细胞,存在于肌细胞膜和基底膜之间。当骨骼肌损伤时,肌卫星细胞被激活,然后增殖分化,与受损肌纤维融合,修复损伤骨骼肌[2]。
近年来研究表明,巨噬细胞在骨骼肌损伤修复过程中也具有重要作用,它不仅参与损伤后肌卫星细胞的激活,还促进坏死肌纤维及细胞碎片的清除,调节炎症反应[3]。骨骼肌损伤后,巨噬细胞在多种因素刺激下游离到损伤部位,参与损伤组织修复[4]。研究发现,趋化因子在骨骼肌损伤后巨噬细胞的趋化中发挥了重要作用[5-6]。在骨骼肌挫伤这一特定病理状态下,巨噬细胞如何趋化到损伤部位却鲜有研究。因此,本文建立了骨骼肌挫伤模型,通过HE染色观察骨骼肌挫伤后修复过程中的形态学变化,通过RT-PCR检测骨骼肌挫伤后巨噬细胞和趋化因子的时空表达规律,并对巨噬细胞和趋化因子表达进行相关性分析,以探索骨骼肌挫伤后巨噬细胞趋化的具体机制。这将加深对骨骼肌挫伤修复机制的理解与认识,为研制治疗骨骼肌挫伤的药物提供新的思路,具有潜在的临床应用价值。
1 材料和方法
1.1 实验动物与分组8~10周龄健康ICR雄性小鼠66只,购自上海杰思捷实验动物有限公司。饲养环境温度为21~25℃,湿度为40%~50%,12 h光照,12 h黑暗,自由饮食。随机选取11只作为对照组(C组),余下进行腓肠肌挫伤处理,分为伤后12 h、1 d、5 d、10 d和15 d组,每组11只。
1.2 骨骼肌挫伤模型小鼠用400 mg/kg体质量水合氯醛腹腔注射麻醉后,膝关节伸直0°,踝关节背伸90°位,将质量16.8 g,直径15.9 mm的实心不锈钢钢珠置于一透明管道顶端(高100 cm,内径16.0 mm)释放后垂直击中一打击装置,打击装置底端撞击小鼠双侧腓肠肌肌腹中段(打击面积28.26 mm2)。骨骼肌挫伤后,可见腓肠肌血肿,HE染色可见肌纤维肿胀、坏死、红细胞渗出和炎性细胞浸润。此法已多次被验证可成功建模[7-9]。
1.3 动物取材小鼠腓肠肌挫伤后在不同时间点(12 h、1 d、5 d、10 d和15 d)取材。小鼠麻醉后颈椎脱位致死,迅速取双侧受损腓肠肌。其中3只小鼠共6条腿腓肠肌进行HE染色,剩余8只小鼠的左腿腓肠肌用于荧光定量PCR检测。
1.4 HE染色小鼠腓肠肌取材,经4%多聚甲醛(国药集团化学试剂有限公司产)固定后,用石蜡(国药集团化学试剂有限公司产)包埋,然后于切片机(Leica-EG 1 160,德国产)切3~4 μm的薄片。切片经脱蜡处理后,用苏木素-伊红染色,然后中性树胶封片。20倍物镜下观察并拍照(Labphot-2,Nikon,美国产)。
1.5 实时荧光定量PCR
1.5.1 RNA抽提 称重骨骼肌(约50 mg),并将组织剪碎,然后放入2 mL离心管中,加入1 mL Trizol(Invitrogen公司产);机械匀浆器(IKA,德国产)匀浆5~6次,每次10 s,静置5 min后,13 400g离心(centrifuge5 417R,德国Eppendorf公司产)10 min,然后取上清(约800~900 μL)放入1.5 mL离心管中;每使用1 mL Trizol加200 μL氯仿(国药集团化学试剂有限公司产),剧烈震荡15 s,然后静置3 min;4 ℃条件下,13 400g离心10 min后,样品分为3层,中间层和上层是无色水相,RNA主要在水相中(约500 μL),将RNA转移到1.5 mL离心管中;在得到的水相中,加入等体积异丙醇(国药集团化学试剂有限公司产),混匀,室温放置20~30 min;4 ℃条件下13 400g离心10 min后,弃上清,离心后RNA沉在管底,呈微小羽毛状;加入1 mL 75%的乙醇(国药集团化学试剂有限公司产)洗涤2次;在4 ℃条件下2 300g离心5 min,弃上清;干燥5 min后,加入30~100 μL DEPC水(生工生物工程(上海)股份有限公司产),分析RNA的浓度或放-20 ℃短期保存,-80 ℃长期保存。
1.5.2 cDNA合成 cDNA合成按RevertAid第一链cDNA Synthesis试剂盒说明进行,取2 μg总RNA、1μL随机六聚体引物、4μL 5X Reaction Buffer、1μL RiboLockTMRNA酶抑制剂 (20 u/μL)、2μL 10 mmol/L dNTP Mix、1μL RevertAidTMM-MuLV 逆转录酶(200 u/μL)和适量无RNA酶高纯水,总体积共20μL。于梯度 PCR仪(Mastercycler EP,德国 Eppendorf 公司产)进行逆转录。反应过程中的温度和时间控制是25 ℃ 5 min、42 ℃ 60 min、70 ℃ 5 min,然后温度降低到4 ℃,cDNA合成完成。
1.5.3 荧光定量PCR 荧光定量PCR反应体系包括12.5 μL 2×Maxima SYBR Green/ROX qPCR Master mix (Thermo Scientific)、1μL cDNA、无核酸酶水和300 nmol/L的上下游引物。引物由生工生物工程(上海)股份有限公司合成(表1)。 使用荧光定量PCR仪进行扩增。反应条件为:预变性95 ℃ 10 min,然后95 ℃变性 15 s,60 ℃ 1 min共 40个循环。 通过2-△△CT方法计算所测样本mRNA的相对含量[10-11]。
1.6 统计学分析实验数据采用SPSS 20.0软件处理,结果以均数±标准差表示。One-way ANOVA和Bonferroni事后检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 挫伤骨骼肌修复过程中形态学变化骨骼肌挫伤后,在伤后12 h~1 d组,取材时可见腓肠肌表面有明显血肿,特别是伤后12 h组最明显,5 d组开始有所改善,14 d和21 d组已观察不到此现象。HE染色结果表明,未损伤骨骼肌形态规则,细胞核分布于肌膜下,无坏死肌纤维。骨骼肌挫伤后12 h~1 d,肌纤维肿胀、结构完整性被破坏,出现大量炎性细胞浸润。伤后第5天仍有较多炎性细胞浸润,但出现少量再生肌纤维(中央成核肌纤维)。伤后第10天再生肌纤维数量大大增加,伤后第15天仍见少量再生肌纤维,但肌纤维结构较完整,损伤后修复基本完成(图1)。

表1 荧光定量PCR引物序列Table 1 Primer Sequences for PCR
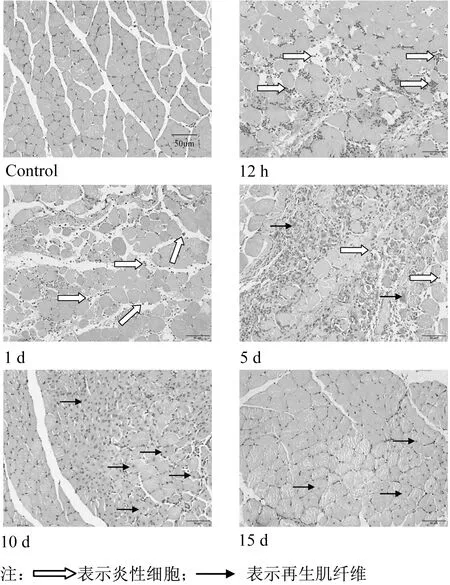
图1 挫伤骨骼肌形态学变化Figure 1 Morphological changes of skeletal muscles after contusion
2.2 骨骼肌挫伤后巨噬细胞标志物表达变化RT-PCR结果显示,骨骼肌挫伤后CD68(M1巨噬细胞标志物)[8]mRNA表达升高,且在挫伤后第1天达到峰值(P<0.01),第5天仍显著高于对照组(P<0.01)。CD206为M2a巨噬细胞标志物[8],与对照组相比,在挫伤后5 d和10 d均显著增加,且第10天达到峰值(P<0.01)。CD163作为M2c巨噬细胞标志物[12],与对照组相比,在挫伤后第10天表达显著增加(P<0.01)(图2)。
2.3 骨骼肌挫伤后趋化因子表达变化如图3 所示,与损伤组相比,单核细胞趋化蛋白1(MCP-1)在骨骼肌挫伤后12 h显著增加并达峰值(P<0.01),且在伤后1 d、5 d和15 d仍显著增加(P<0.01)[图3(a)]。CC趋化因子受体2(CCR2)在挫伤后1 d、5 d和15d mRNA表达均显著高于对照组(P<0.01)[图3(b)]。基质细胞衍生因子-1(SDF-1)mRNA在挫伤后12 h、10 d和15 d表达均显著增加[图3(c)]。CXC趋化因子受体4(CXCR4)虽在骨骼肌挫伤后表达出现变化,但与对照组相比并无显著差异(P>0.05)[图3(d)]。
2.4 巨噬细胞与趋化因子的相关性分析通过皮尔逊相关分析发现,骨骼肌挫伤后,MCP-1与CD68存在强相关(r=0.654,P=0.001),与其受体CCR2呈强相关(r=0.617,P=0.015),与CD163和CD206无相关。SDF-1与其受体CXCR4呈相关(r=0.187,P=0.023),与CD68、CD163和CD206均无相关(表2)。
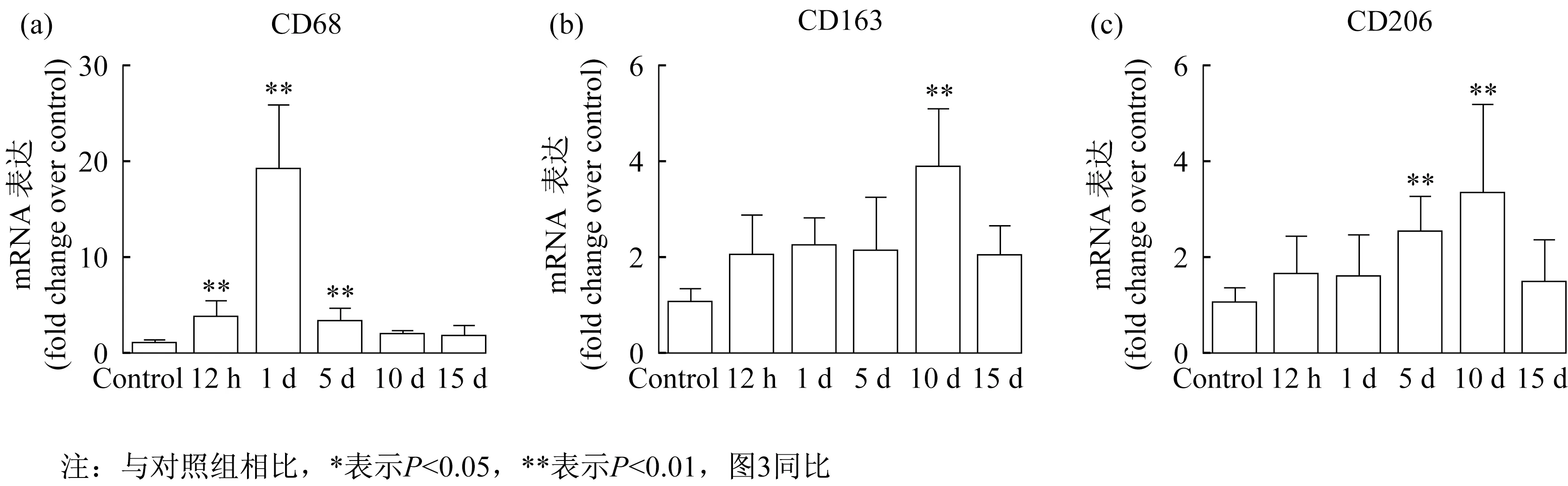
图2 骨骼肌挫伤后巨噬细胞标志物表达变化Figure 2 The expression changes of macrophages markers after skeletal muscle contusion
表2 趋化因子与其受体及巨噬细胞标志物的相关性
Table 2 Correlation between thechemokines and their receptors and markers of macrophages
注:*表示无相关;—表示未进行相关分析
3 讨论
3.1 骨骼肌挫伤模型的构建Ceafalan等[13]发现,小鼠腓肠肌压碎性损伤后,大量肌纤维坏死、炎性细胞浸润,在伤后第5天首次发现中央成核肌纤维(再生肌纤维),伤后第14天大部分再生肌纤维已成熟。本实验结果与Ceafalan等的结果相似,骨骼肌挫伤后肌纤维坏死、肿胀、大量炎性细胞浸润,伤后第7天有大量再生肌纤维,伤后第14天大部分再生肌纤维已成熟。与之不同的是,在本实验中,骨骼肌挫伤后第3天即可见少量再生肌纤维。出现这种差异的原因可能是骨骼肌压碎伤较挫伤更为严重,因此再生肌纤维出现得较晚。此外,Wright等[14]发现,小鼠腓肠肌挫伤后第7天,损伤部位出现大量再生肌纤维。Nozaki等[15]发现,小鼠腓肠肌挫伤后第14天,损伤骨骼肌仍有少量再生肌纤维,大部分再生肌纤维已成熟。以上结果与本文相似,提示骨骼肌挫伤模型建立成功[7,16]。
3.2 骨骼肌挫伤后巨噬细胞浸润的规律巨噬细胞在骨骼肌损伤修复过程中发挥重要作用[9,12]。巨噬细胞通常可分为2种基本类型:M1和M2巨噬细胞。M2巨噬细胞又可进一步分为M2a、M2b和M2c 3种类型[3,17]。M1巨噬细胞为促炎性巨噬细胞,它可分泌多种促炎细胞因子(如IFN-γ、TNF-α和IL-6等),清除坏死肌纤维及细胞碎片等,促进机体炎症反应[18]。M2巨噬细胞为抗炎性巨噬细胞,可分泌多种肌再生因子(如IGF、MGF和HGF等)及抗炎细胞因子(IL-10),促进骨骼肌损伤修复[19]。巨噬细胞在损伤骨骼肌中的表达存在一定规律性,如Tonkin等[20]发现,小鼠胫骨前肌注射心脏毒素损伤后第2天M1巨噬细胞达峰值,随后表达下降,而M2巨噬细胞在伤后第5天达峰值。Shono等[21]发现,小鼠腓肠肌挤压损伤后1~4 d M1型巨噬细胞表达显著增加,M2巨噬细胞在伤后7~10 d表达显著增加。与上述损伤模型相似,本文发现,M1巨噬细胞在骨骼肌挫伤后1~5 d显著增加(P<0.01),M2a巨噬细胞在挫伤后5~10 d显著增加,M2c巨噬细胞在挫伤后第10天显著增加。此外,本实验结果与上述研究者略有差异的原因可能与骨骼肌损伤方式不同(心脏毒素致伤与骨骼肌挫伤;挤压致伤与骨骼肌挫伤)及损伤肌肉类型(胫骨前肌与腓肠肌)不同有关。尽管不同研究之间略有差异,但这些结果提示,骨骼肌损伤后巨噬细胞浸润存在一定规律性,在骨骼肌损伤早期M1巨噬细胞浸润占优势,随后M1巨噬细胞转化为M2巨噬细胞,在损伤后期M2巨噬细胞显著增多[22]。
3.3 骨骼肌挫伤后修复过程中巨噬细胞趋化的可能机制MCP-1/CCR2轴参与了多种病理环境中巨噬细胞的迁移,如肿瘤组织中MCP-1与CCR2结合可促进巨噬细胞趋化[23-24],离体状态下MCP-1可促进经典激活型巨噬细胞(M1巨噬细胞)的迁移与激活[25]。骨骼肌挫伤后,MCP-1/CCR2轴是否参与了巨噬细胞的募集则不得而知。本文通过RT-PCR检测挫伤骨骼肌修复过程中巨噬细胞和趋化因子的表达,采用相关性分析探讨骨骼肌损伤修复过程中巨噬细胞趋化的可能机制。结果显示,骨骼肌挫伤后MCP-1表达显著上调,且与CCR2呈强相关(r=0.617,P=0.015),与M1巨噬细胞标志物CD68呈强相关(r=0.654,P=0.001),提示骨骼肌挫伤后MCP-1/CCR2轴可能参与了巨噬细胞的募集。
这一推测可从其他骨骼肌损伤模型得到支持。如Shireman等[6]发现,与野生型小鼠相比,MCP-1基因缺失小鼠,在骨骼肌缺血性损伤后第3天巨噬细胞浸润减少,在伤后第7天仍有巨噬细胞浸润和大量坏死组织,损害了骨骼肌再生。与野生型小鼠相比,CCR2(MCP-1的受体)基因敲除小鼠,在心脏毒素注射骨骼肌损伤后巨噬细胞募集减少、脂肪沉积增加、VEGF表达下降,骨骼肌再生受损[5,26-27]。虽然MCP-1与M1巨噬细胞显著相关,但MCP-1与M2巨噬细胞标志物CD163和CD206均无相关,提示MCP-1可能未参与M2巨噬细胞趋化,因为骨骼肌损伤后,M2巨噬细胞一般较晚出现,且一般认为其由M1巨噬细胞转化而来,而非从外周血募集[17,28]。以上结果提示,MCP-1/CCR2轴可能参与了挫伤骨骼肌修复过程中M1巨噬细胞的趋化。
此外,SDF-1/CXCR4轴也与巨噬细胞的迁移相关。SDF-1及其受体CXCR4属于CXC趋化因子家族,在多种细胞中表达(如C2C12成肌细胞、肌卫星细胞、造血干细胞、白细胞等)[29-31]。SDF-1/CXCR4轴常被认为与肿瘤环境中巨噬细胞募集有关[32-33]。虽然在离体状态下SDF-1可促进巨噬细胞趋化[33],但能否促进损伤骨骼肌中巨噬细胞的募集则少有研究。本实验中,骨骼肌挫伤后SDF-1 mRNA表达显著上调,且SDF-1与其受体CXCR4呈相关,但SDF-1与巨噬细胞3种标志物间均无相关性。提示在骨骼肌挫伤这一特定病理环境中,SDF-1/CXCR4可能并未参与巨噬细胞趋化。
4 结束语
本文基于前期大量文献报道,仅对涉及巨噬细胞趋化的2条重要趋化途径进行了探索。从结果看,MCP-1/CCR2轴可能参与了挫伤骨骼肌修复过程中M1巨噬细胞的趋化,但仍不能排除有其他促进巨噬细胞向损伤骨骼肌趋化的途径。
