沉默UBE2N对人喉鳞癌hep-2细胞放射敏感度的影响
2019-08-01宫梦晓邓鑫州沈力张梦琳柯青吴林刘艳芹陈晓琳邱小燕骆志国
宫梦晓,邓鑫州,沈力,张梦琳,柯青,吴林,刘艳芹,陈晓琳,邱小燕,骆志国
0 引言
近年来,我国喉癌发病率及死亡率不断上升,已成为头颈部最常见的恶性肿瘤之一[1],晚期喉癌术后同期放化疗的5年生存率为68.2%,单纯放疗的5年生存率仅为48.9%[2]。放疗在喉鳞癌的治疗中起到至关重要的作用[3]。放射抵抗是导致放疗失败的重要原因[4]。
UBE2N是泛素交联酶E2家族的成员之一。泛素交联酶E2家族参与泛素-蛋白酶体复合通路(ubiquitin-proteasome pathway, UPP)对底物蛋白的泛素化降解[5]。泛素-蛋白酶体复合通路在调控细胞周期、增殖、信号转导、DNA损伤修复、免疫应答等方面都发挥着重要作用[6]。UBE2N是DNA损伤修复通路的成员[7],DNA损伤后,UBE2N与泛素连接酶RNF8及RNF168结合后,促进DNA损伤反应中BRCA1及H2AX的泛素化修饰,从而促进下游DNA损伤反应的进行[8]。研究发现泛素交联酶UBE2N可能调控肿瘤细胞的放疗敏感度[9]。本研究沉默喉鳞癌hep-2细胞中UBE2N的表达,通过CCK8法、流式细胞术及克隆形成等实验,验证沉默UBE2N表达后对喉鳞癌细胞放射敏感度的影响,为明确UBE2N在调控喉鳞癌细胞放射敏感度中的作用提供实验依据。
1 材料与方法
1.1 实验材料
DMEM培养基、胎牛血清购自美国Gibco公司;UBE2N siRNA沉默序列和阴性对照序列均由上海吉玛公司合成。RNA反转录试剂盒、PCR扩增试剂盒购自日本TaKaRa公司;蛋白裂解液、蛋白提取试剂盒、BCA蛋白定量试剂盒、细胞周期检测试剂盒、细胞凋亡检测试剂盒均购自南通碧云天生物技术研究所;内参GAPDH购自苏州GenePharma公司。GAPDH抗体、β-actin抗体、UBE2N抗体及各HRP-标记二抗购自英国Abcam公司;ECL化学发光试剂盒购自美国Thermo公司。Lipofectamine 3000购自美国Invitrogen公司;CCK8试剂盒购自日本同仁公司。流式细胞仪购自美国BD公司;荧光定量PCR仪、酶标仪、凝胶成像系统购自美国Bio-Rad公司。相机购自日本Canon公司。
1.2 实验方法
1.2.1 细胞培养 人喉鳞癌hep-2细胞购自中国科学院上海细胞库,用含10%胎牛血清的DMEM培养基,置于37℃含5%CO2的细胞培养箱中培养。
1.2.2 UBE2N RNA沉默质粒转染 实验分为UBE2N干扰组(UBE2N-siRNA)和阴性对照组(NC),UBE2N RNA沉默靶序列为:5′-AUCCAGAUGAUCCAUUAGCAATT-3′,阴性对照序列为:5′-TTCTCCGAACGTGTCACGT-3′。收集细胞,调整细胞密度至2×105/ml,接种于6孔板。待细胞贴壁生长后,按照Lipofectamine 3000说明书操作转染siRNA,转染24、48、72、96 h后,收集细胞进行后续相关实验。
1.2.3 qPCR实验 收集细胞(约1×106个),按照RNA反转录试剂盒说明书操作提取RNA。取总RNA 2μg进行反转录反应,然后进行qPCR反应,PCR反应条件:95℃预变性1 min,95℃变性15 s,60℃退火1 min,72℃延伸1min,40个循环。UBE2N引物序列为:F: 5′-GCGTTTGCTGGCAGAACCAG-3′,R: 5′-CTCAAAGGGGGAATCCTGAGGG-3′;GAPDH引物序列为:F: 5′-CCAACCGCGAGAAGATGA-3′,R:5′-CCAGAGGCGTACAGGGATAG-3′。以GAPDH为内参,按照2-ΔΔCt法计算UBE2N相对表达量。
1.2.4 Western blot实验 收集细胞(约1×106个),按照试剂盒说明书操作提取蛋白,采用BCA法进行蛋白定量。取10 μg总蛋白用10% SDS-PAGE胶电泳,转膜后置于5%脱脂奶粉中室温封闭2 h。一抗4℃孵育过夜,二抗室温孵育2 h,采用ECL 化学发光试剂盒显影。以ImagePro Plus 6.0图像分析软件计算灰度值,将内参蛋白与目的蛋白两者灰度值的比值作为目的蛋白的表达量。
1.2.5 CCK8增殖实验 hep-2细胞经siRNA转染,并用0、2、4、6、8 Gy X线照射或不照射,收集细胞(约1×106个),以每孔3 000个细胞铺到96孔板中,培养24、48、72和96 h后分别向对应的细胞中加入CCK8,将96孔培养板置于37℃恒温箱孵育1 h,用酶标仪测450 nm处吸光度值。
1.2.6 细胞凋亡的测定 hep-2细胞经siRNA转染,并用0、2、4、6、8 Gy X线照射后,收集细胞(约1×106个),预冷PBS洗3次。按照细胞凋亡检测试剂盒说明书操作,采用Annexin V/PI双染,流式细胞仪检测细胞凋亡。
1.2.7 细胞周期的测定 hep-2细胞经siRNA转染,并用0、2、4、6、8 Gy X线照射后,收集细胞(约1×106个),预冷PBS洗3次。70%的冷乙醇4℃固定过夜。按照细胞周期检测试剂盒说明书操作染色,采用流式细胞仪检测细胞周期。
1.2.8 细胞克隆形成实验 hep-2细胞经siRNA转染,收集细胞铺到6孔板中,每孔2 000个细胞。每组3孔平行样本。 并用0、2、4、6、8 Gy X线照射后,静置于37℃培养箱中培养14天。14天后培养板中出现肉眼可见克隆时,终止培养,用PBS轻轻冲洗2~3遍,1%结晶紫染色20 min,除去染色液,纯水轻轻洗涤2~3遍,晾干,用相机拍照留底,在显微镜下计数克隆个数,≥50个的细胞团作为一个克隆。根据克隆形成计数结果计算每组细胞克隆形成率。
1.3 统计学方法
使用SPSS 22.0软件分析数据。以上所有实验至少重复三次,数据结果以(x±s)表示,通过配对样本t检验进行计算分析。P<0.05为差异有统计学意义。
2 结果
2.1 UBE2N siRNA沉默效果检测
转染48 h后qPCR检测结果显示:UBE2N-siRNA组UBE2N mRNA表达(0.459±0.044)明显受到抑制,与NC组(1.000)比较,差异有统计学意义(F=0.10, P=0.01),见图1A。转染72 h后Western blot结果显示:UBE2N siRNA显著抑制了UBE2N蛋白水平,见图1B。上述结果表明UBE2N siRNA能够有效抑制hep-2细胞UBE2N表达。

图1 qPCR和Western blot法检测siRNA沉默UBE2N后UBE2N mRNA(A)和蛋白水平(B)Figure1 UBE2N mRNA(A) and protein(B) expression detected by qPCR and Western blot after UBE2N siRNA transfection
2.2 沉默UBE2N促进hep-2细胞增殖
CCK8检测结果显示:经siRNA沉默24 h后,UBE2N-siRNA组和NC组细胞活力指数分别为(0.31±0.02)和(0.26±0.02)(P=0.042);48 h后, 细胞活力指数分别为(0.49±0.10)和(0.29±0.02)(P=0.037);72 h后, 细胞活力指数分别为(0.35±0.00)和(0.23±0.02)(P=0.003);96 h后, 细胞活力指数分别为(0.27±0.03)和(0.20±0.00)(P=0.009)。说明沉默UBE2N显著提高hep-2细胞增殖能力,见图2。
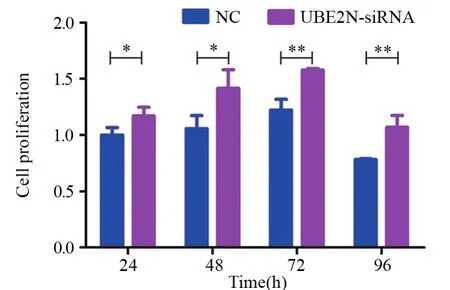
图2 CCK8检测沉默UBE2N后hep-2细胞增殖情况Figure2 Effects of UBE2N silence on hep-2 cell proliferation detected by CCK8 assay
2.3 沉默UBE2N促进辐射后hep-2细胞增殖
经0、2、4、6、8 Gy射线照射48 h后,CCK8法结果显示:4、6 Gy射线照射后,UBE2N-siRNA组hep-2细胞增殖能力显著高于NC组(F4Gy=0.27,P4Gy=0.04; F6Gy=0.63, P6Gy=0.03),见图3。提示沉默UBE2N会增强喉鳞癌细胞放射抵抗。
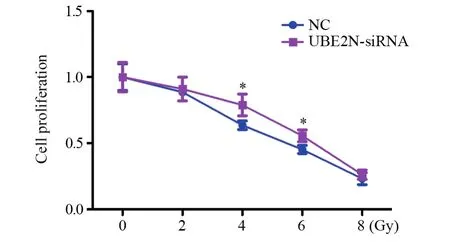
图3 CCK8检测沉默UBE2N后hep-2细胞辐射后细胞增殖情况Figure3 Effect of UBE2N silence on proliferation of hep-2 cells detected by CCK8 assay after UBE2N siRNA transfection and different doses of irradiation
2.4 细胞周期实验结果
经0、2、4、6、8 Gy射线照射后,NC组和UBE2N-siRNA组G1期细胞比例差异无统计学意义(均P>0.05);未经射线照射(0 Gy),UBE2N-siRNA组G2期细胞比例明显高于NC组(P=0.043);但经2、6 Gy射线照射后,UBE2N-siRNA组G2期细胞比例明显低于NC组(均P<0.05);经0、4、6 Gy射线照射后,UBE2N-siRNA组S期细胞比例明显高于NC组(均P<0.05),见图4、表1。结果表明经辐射处理后,沉默UBE2N会促进DNA合成,并部分解除G2阻滞,提示沉默UBE2N会增强喉鳞癌细胞放射抵抗。

表1 沉默UBE2N对经X射线处理后的hep-2细胞周期的影响Table1 Effects of UBE2N silence on cell cycle of hep-2 cells after X-ray treatment
2.5 细胞凋亡实验结果
沉默UBE2N并经0、2、4、6、8 Gy射线照射后,Annexin V/PI双染法结果显示:UBE2N 干扰组细胞总凋亡率(早期凋亡+晚期凋亡)显著低于NC组(均P<0.05),见图5、表2。结果证明沉默UBE2N降低辐射诱导的喉鳞癌细胞凋亡。
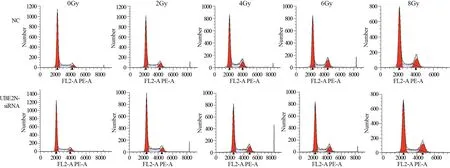
图4 流式细胞术检测沉默UBE2N基因对辐射后hep-2细胞周期的影响Figure4 Effects of UBE2N silence on cell cycle of hep-2 cells detected by flow cytometry after UBE2N siRNA transfection and different doses of irradiation
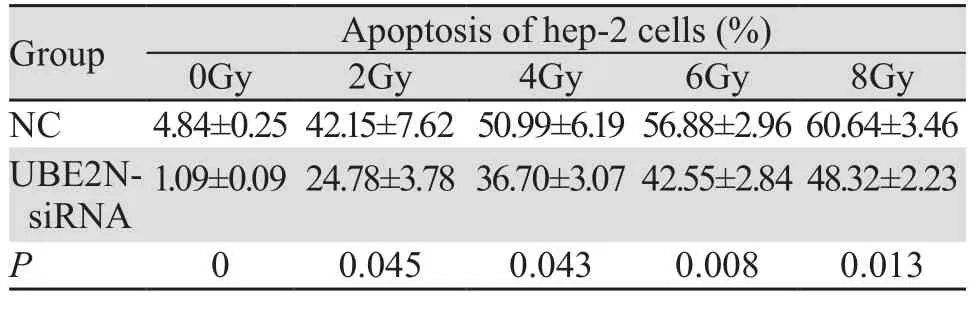
表2 沉默UBE2N对X射线诱导的细胞凋亡的影响Table2 Effects of UBE2N silence on X-ray-induced cell apoptosis
2.6 克隆形成实验结果
沉默UBE2N并经0、2、4、6 Gy射线照射后,UBE2N-siRNA组细胞克隆形成能力显著强于NC组(均P<0.05),见图6、表3。提示沉默UBE2N会增强喉鳞癌细胞放射抵抗。
3 讨论
近年研究显示,泛素交联酶与肿瘤放疗抵抗密切相关。研究发现使用一种特异性抑制小分子抑制剂NSC697923抑制UBE2N后,P53及JNK通路激活,神经母细胞瘤细胞、弥漫性大B淋巴瘤细胞的增殖减慢并促进其凋亡,故而推测UBE2N可能是这两种肿瘤的潜在治疗靶点之一[10-11]。张喜梅等在人喉鳞癌细胞株中发现UBE2N在放疗抵抗株hep-2R中表达明显高于亲本细胞hep-2,提示泛素交联酶UBE2N可能调控肿瘤细胞的放射敏感度[9],但未做相关功能实验进行验证。
细胞周期调控是决定细胞放射敏感度的一个关键因素。辐射诱导DNA损伤,使细胞周期产生阻滞,如G2/M期阻滞[12],为DNA修复提供充足的时间[13]。本研究发现在细胞周期实验中,hep-2细胞转染UBE2N siRNA后,其S期显著延长,而G2期显著缩短,增殖实验也表明沉默UBE2N增强hep-2细胞增殖,因此UBE2N调控细胞增殖和细胞周期可能是调节放射敏感度的重要机制。

图5 流式细胞术检测沉默UBE2N对辐射后hep-2细胞凋亡的影响Figure5 Effects of UBE2N silence on apoptosis of hep-2 cells detected by flow cytometry after UBE2N siRNA transfection and different doses of irradiation
细胞凋亡是影响细胞放射敏感度的重要原因,是一种潜在的放疗增敏机制[14-15],辐射可通过多种途径诱导细胞凋亡。本研究通过AnnexinV/PI双染法证实,经X线照射后,转染UBE2N siRNA较转染阴性对照NC的hep-2细胞凋亡比例明显减少。克隆形成率是反映细胞群体依赖性和增殖能力的重要指标。本研究发现经X线照射后,UBE2N沉默组细胞克隆形成率显著升高,提示沉默UBE2N能显著降低喉鳞癌细胞群体依赖性,并增强喉鳞癌细胞增殖能力。

图6 克隆形成实验检测沉默UBE2N对辐射后hep-2细胞克隆形成能力的影响Figure6 Effects of UBE2N silence on clone formation of hep-2 cells detected by clone formation assay after UBE2N siRNA transfection and different doses of irradiation

表3 沉默UBE2N对X射线处理后的细胞克隆形成能力的影响Table3 Effects of UBE2N silence on cell clone formation ability after X-ray treatment
综上所述,UBE2N通过调控细胞增殖、细胞周期进展、细胞克隆形成能力和细胞凋亡来影响喉鳞癌细胞放射抵抗。本研究在细胞水平探讨了UBE2N对人喉鳞癌细胞放射抵抗的影响,但相关动物实验和机制研究并未完成,因此,在体内外探讨UBE2N在人喉鳞癌细胞放射敏感度的机制是我们下一步需要完成的内容,以期为喉鳞癌放疗增敏提供新的可靠靶点。
