扶正化瘀方对血管紧张素Ⅱ诱导的心肌成纤维细胞miR-29b-5p表达的影响
2019-07-31娄利霞高永红国倩倩吴丹丹高毅洁王曼曼张冬梅
朱 珂,娄利霞,高永红,国倩倩,吴丹丹,高毅洁,王曼曼,张冬梅
(北京中医药大学东直门医院中医内科学教育部和北京市重点实验室,北京 100700)
扶正化瘀方(Fuzheng Huayu recipe,FZHY)由丹参、桃仁、松花粉、五味子、绞股蓝、虫草菌丝6味中药组成,最初是针对肝纤维化的“正虚血瘀”病机而设,具有活血化瘀、益气扶正的功效[1]。本课题组前期研究表明,FZHY可降低心肌胶原表达,改善大鼠心肌梗死后心肌纤维化[2-3]。心肌成纤维细胞(cardiac fibroblasts,CFs)是心肌纤维化的主要效应细胞,其异常增殖并大量分泌细胞外基质是心肌纤维化发生的重要病理学基础[4]。微RNA(microRNA,miRNA)是一类高度保守的非编码小分子RNA,通过抑制mRNA的翻译或促进mRNA降解,在转录后水平调节靶基因的表达。miR-29是新近发现的一种与纤维化疾病紧密相关的小分子RNA家族,其中miR-29b可直接靶向调控细胞外基质相关蛋白基因的表达[5],并且可以作为转化生长因子-β/Smads通路的上游因子调控心肌纤维化[6],具有抗心肌纤维化的潜能。本研究在前期实验的基础上,拟采用差速贴壁法提取乳鼠原代CFs,观察FZHY对血管紧张素Ⅱ(angiotensin Ⅱ,AngⅡ)诱导的CFs增殖、凋亡和miR-29b-5p表达的影响,在体外水平进一步探讨FZHY抗心肌纤维化的分子机制。
1 材料与方法
1.1 实验动物 3 日龄健康Wistar大鼠(雌雄不限),共20只,由北京维通利华实验动物技术有限公司购进,SPF级,许可证编号:SCXK(京)2016-0006。
1.2 试剂与耗材 FZHY浸膏(上海黄海制药有限责任公司提供)由丹参8 g、虫草4 g、桃仁2 g、绞股蓝6 g、松花粉2 g、五味子2 g六味中药组成,得膏率为13.75%,每100毫克浸膏粉溶于1 mL二甲基亚砜(dimethyl sulfoxide,DMSO),用含2%胎牛血清(fatal bovine serum,FBS)的DMEM(Dulbecco′s modification of Eagle′s medium)培养基稀释1 000倍后使用,Neonatal Heart Dissociation Kit(美国美天旎公司,货号:130-098-373),胎牛血清(美国Gibco公司,货号:10099-141),波形蛋白抗体(美国博士德公司,货号:BM0135),α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)抗体(美国博士德公司,货号:BM4172),细胞计数试剂盒8(cell counting kit-8,CCK-8)(中国东仁化学科技有限公司,货号:CK04),AngⅡ(中国中肽生化有限公司,货号:CJ-04-01164),细胞凋亡检测试剂盒(南京凯基公司,货号:KGP902),miRcute miRNA Isolation Kit(中国TIANGEN公司,货号:DP501),miRcute Plus miRNA First-Strand cDNA Synthesis Kit(中国TIANGEN公司,货号:KR211-02),miRcute Plus miRNA aPCR Kit(中国TIANGEN公司,货号:FP411-02)。
1.3 仪器 超净工作台(新加坡ESCO公司),二氧化碳培养箱(德国Heraeus公司),酶标仪(中国Rayto公司),全自动组织处理系统(美国美天旎公司),IMT-2倒置显微镜(日本Olympus公司), 4 ℃低温高速离心机(美国Thermo公司),Agilent Mx3000P PCR仪(美国ABI公司),紫外分光光度计(美国Pharmacia Biotech公司)。
1.4 CFs的培养和鉴定 根据乳鼠心脏分离试剂盒说明书操作,无菌条件下取Wistar乳鼠心脏,采用差速贴壁法提取CFs。待CFs生长近融合状态时以1∶2传代,实验用第3~4代CFs。在倒置显微镜下观察CFs形态,采用免疫细胞化学染色法鉴定CFs,步骤按免疫细胞化学试剂盒说明书进行。
1.5 CCK-8法检测细胞增殖活力 用10%完全培养基调整细胞浓度为5×104/mL,接种于96孔培养板,每孔200 μL。细胞24 h贴壁后,换无血清DMEM继续孵育24 h,使CFs处于同步生长休止期。按如下方案分组:空白对照组(2% FBS-DMEM)、DMSO对照组(0.1% DMSO)、AngⅡ组(10-7mol/L AngⅡ)、25 μg/mL FZHY组(10-7mol/L AngⅡ+25 μg/mL FZHY)、50 μg/mL FZHY组(10-7mol/L AngⅡ+50 μg/mL FZHY)和100 μg/mL FZHY组(10-7mol/L AngⅡ+100 μg/mL FZHY),每组设6个复孔,干预48 h。每孔加入10 μL CCK-8溶液,继续培养2 h,在酶标仪上450 nm处测定各孔的光密度(optical density,OD)值 。
1.6 流式细胞仪检测细胞凋亡率 用10%完全培养基调整细胞浓度为7.5×104/mL, 接种于6孔培养板中,每孔2 mL。细胞24 h贴壁后,换无血清DMEM继续孵育24 h。结合预实验结果,按如下方案分组:空白对照组(2% FBS-DMEM)、AngⅡ组(10-7mol/L)、FZHY组(10-7mol/L AngⅡ+100 μg/mL FZHY),每组设6个复孔,另设1孔为阴性对照组(10%FBS-DMEM),干预48 h。按照细胞凋亡检试剂盒说明书操作,用0.25%胰蛋白酶消化收集细胞,磷酸缓冲盐溶液洗两次,300×g离心5 min,弃上清;加入500 μL的结合缓冲液重悬细胞,并将细胞悬液移入5 mL流式管中;空白对照组、AngⅡ组和FZHY组每孔分别加入5 μL 膜连蛋白V-荧光素异硫氰酸酯和5 μL碘化丙啶混匀,阴性对照组不加,于室温避光孵育15 min,上流式细胞仪进行检测。
1.7 实时荧光定量聚合酶链反应法检测细胞miR-29b-5p的表达 用10%完全培养基调整细胞浓度为7.5×104/mL,接种于6孔培养板中,每孔 2 mL。细胞24 h贴壁后,换无血清DMEM,继续孵育24 h。按如下方案分组:空白对照组(2% FBS-DMEM)、Ang Ⅱ组(10-7mol/L)、FZHY组(10-7mol/L AngⅡ+100 μg/mL FZHY),每组设6个复孔,干预48 h。弃上清,取细胞层用miRcute miRNA Isolation Kit提取miRNA,用紫外分光光度计进行260 nm和280 nm处吸光度值测量。按照miRcute Plus miRNA First-Strand cDNA Synthesis Kit说明书,建立反转录体系将miRNA反转为cDNA。根据miRcute Plus miRNA aPCR Kit说明书操作,将聚合酶链反应条件设定为95 ℃预变性15 min→94 ℃ 20 s,60 ℃ 34 s共40个循环,以U6为内参进行荧光定量。引物序列如下,miR-29b-5p:5′-ATGGTTCGTGCGCTGGTTTCACATGGTGG-3′;U6:5′-CAAGGATGACACGCAAATTCG-3′。所得CT值按照2-△△ct的方法,进行均一化处理后再进行统计学分析。
2 结 果
2.1 CFs的鉴定 倒置显微镜下观察发现,乳鼠CFs生长迅速,1~2 d即呈融合状态。细胞多呈梭形或纺锤形,胞体较大,胞质透明,折光性弱,细胞核呈椭圆形,通常含2~3个核仁,无自发搏动。以波形蛋白蛋白以及α-SMA作为检测指标,对CFs进行标记和鉴定。结果显示,CFs波形蛋白染色呈阳性信号,见图1a、1b;CFs α-SMA染色呈阴性信号,见图2a、2b。细胞纯度达95%以上。
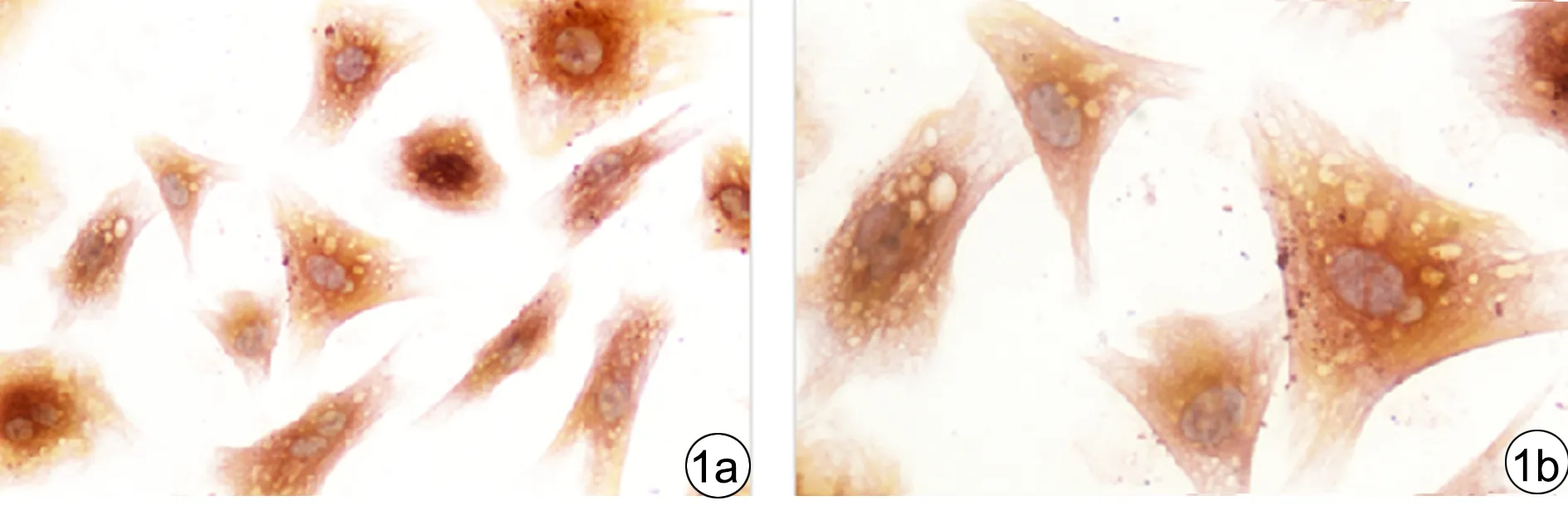
图1 CFs波形蛋白免疫组织化学染色(1a.×200,1b.×400)

图2 α-SMA免疫组织化学染色(2a.×200,2b.×400)
2.2 FZHY对AngⅡ诱导的CFs增殖的影响 各组OD值比较差异有统计学意义(P<0.01),空白对照组与DMSO对照组OD值比较差异无统计学意义(P>0.05);与空白对照组相比,AngⅡ组CFs OD值明显升高(P<0.01);与AngⅡ组相比,25 μg/mL FZHY组、50 μg/mL FZHY组和100 μg/mL FZHY组CFs OD值均降低(P<0.05或P<0.01),并且呈剂量依赖性。见表1。
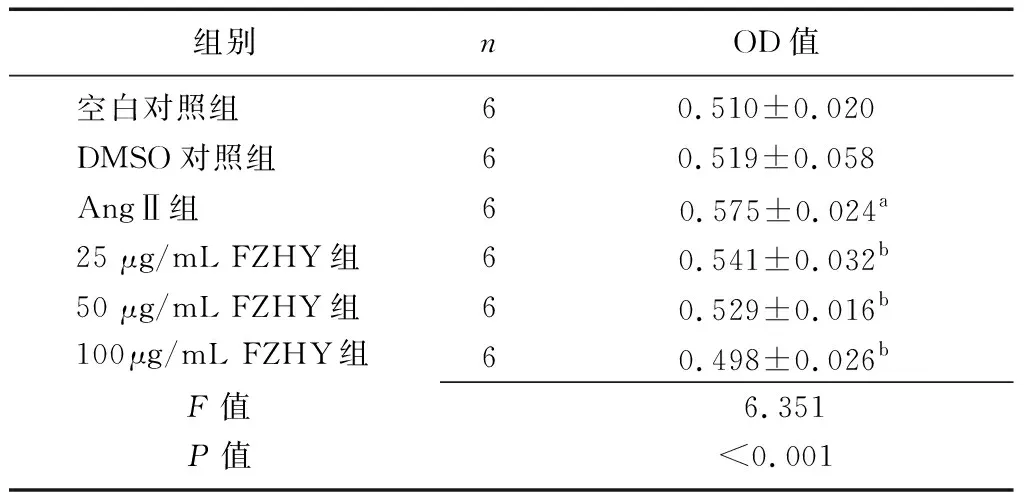
组别nOD值空白对照组60.510±0.020DMSO对照组60.519±0.058AngⅡ组60.575±0.024a25 μg/mL FZHY组60.541±0.032b50 μg/mL FZHY组60.529±0.016b100 μg/mL FZHY组60.498±0.026bF值6.351P值<0.001
FZHY:扶正化瘀方;AngⅡ:血管紧张素Ⅱ;DMSO:二甲基亚砜;CFs:心肌成纤维细胞;OD:光密度;a与空白对照组比较,P<0.01;b与AngⅡ组比较,P<0.05或P<0.01
2.3 FZHY对AngⅡ诱导的CFs凋亡的影响 各组早期凋亡率和总凋亡率比较差异有统计学意义(P<0.05),与空白对照组比较,AngⅡ组CFs早期凋亡率与总凋亡率降低(P<0.01);与AngⅡ组相比,FZHY组CFs早期凋亡率与总凋亡率升高(P<0.01);各组中晚期凋亡率比较差异无统计学意义(P>0.05)。见表2、图3。
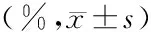
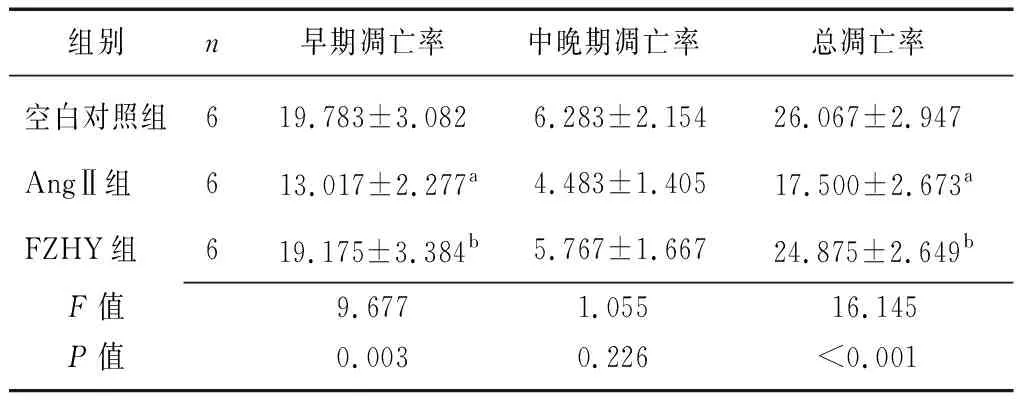
组别n早期凋亡率中晚期凋亡率总凋亡率空白对照组619.783±3.0826.283±2.15426.067±2.947AngⅡ组613.017±2.277a4.483±1.40517.500±2.673aFZHY组619.175±3.384b5.767±1.667 24.875±2.649bF值9.6771.05516.145P值0.0030.226<0.001
FZHY:扶正化瘀方;AngⅡ:血管紧张素Ⅱ;CFs:心肌成纤维细胞;a与空白对照组比较,P<0.01;b与AngⅡ组比较,P<0.01
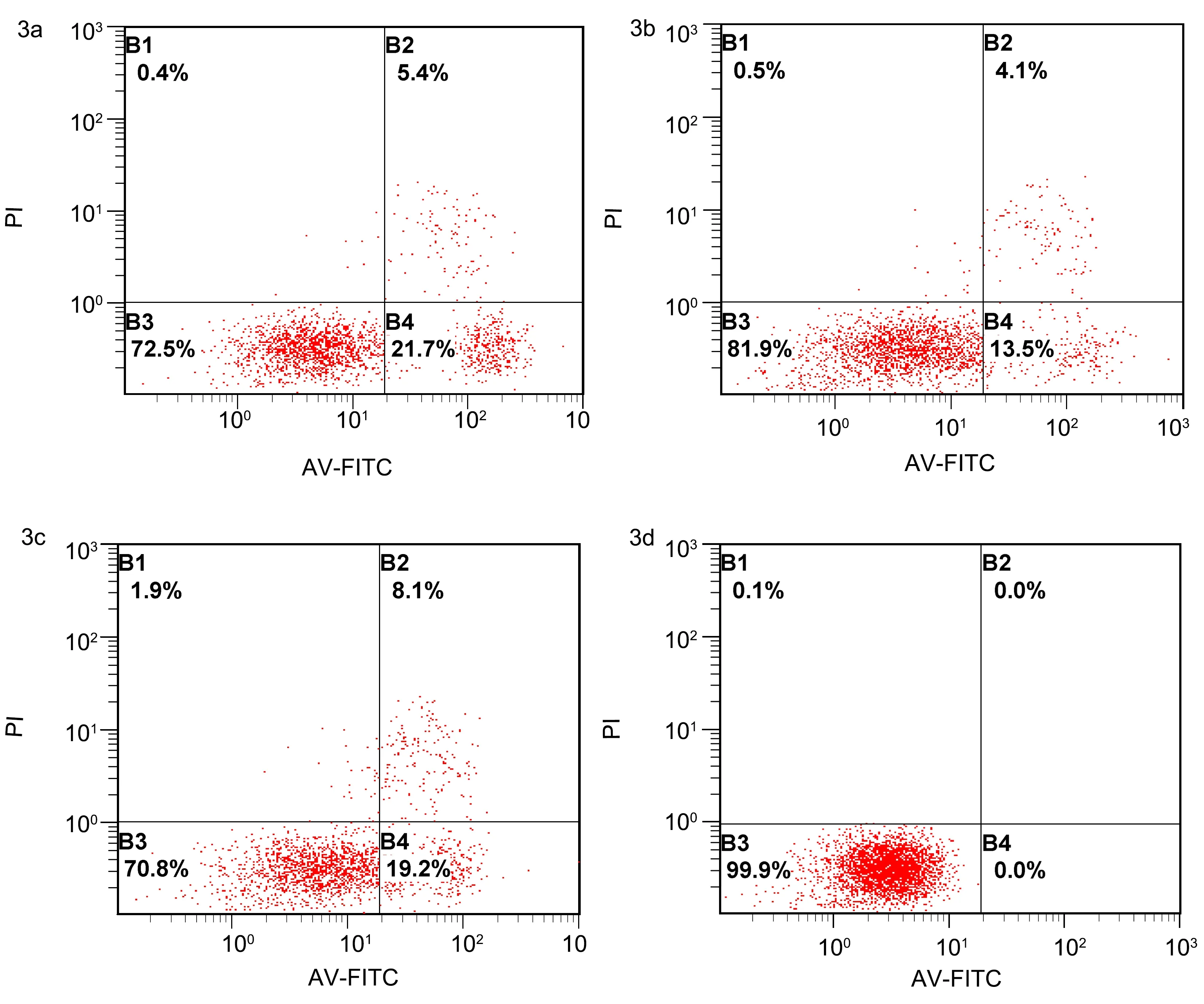
3a.空白对照组; 3b.AngⅡ组; 3c.FZHY组; 3d.阴性对照组; AV-FITC:荧光素异硫氰酸酯; PI:碘化丙啶; FZHY:扶正化瘀方; AngⅡ:血管紧张素Ⅱ; CFs:心肌成纤维细胞
图3 FZHY对AngⅡ诱导的CFs凋亡的影响
2.4 FZHY对AngⅡ诱导的CFs miR-29b-5p表达的影响 空白对照组、AngⅡ组、FZHY组miR-29b-5p的表达分别为(1.017±0.218)、(0.729±0.119)、(1.033±0.235),各组CFs miR-29b-5p表达比较差异有统计学意义(F=4.033,P=0.046)。与空白对照组比较,AngⅡ组CFs miR-29b-5p表达降低(P<0.05);与AngⅡ组相比,FZHY组CFs miR-29b-5p表达升高(P<0.05)。
3 讨 论
FZHY具有活血化瘀,益气扶正的功效。研究发现,FZHY不仅对肝纤维化疗效显著,还可以不同程度地改善肺及肾的纤维化[7-9]。各脏器纤维化虽然是相对独立的疾病,但基本病理改变相似,均是由纤维生成细胞活化、致纤维化因子增加、细胞外基质合成与降解失衡所致[10]。故药理学上可以相互借鉴,用FZHY达到异病同治的效果。在此理论指导下,本课题组前期研究证实,FZHY可抑制心肌胶原表达,改善心功能,具有缓解心肌梗死后心肌纤维化的作用[11]。
正常心肌组织中约2/3的细胞是非心肌细胞,其中CFs占90%以上[12]。CFs是一种具有增殖和多向分化潜能的细胞,在压力负荷等条件刺激下过度增殖,引起细胞外基质蛋白、细胞因子和生长因子等分泌增加,导致心肌纤维化[13]。凋亡是机体清除衰老及异常细胞的过程[14],CFs的凋亡减少是心肌纤维化的成因之一。纤维化过程中CFs的过度增殖也意味着其凋亡程序的减弱[15]。因此,抑制CFs的异常增殖并促进其凋亡可能是防治心肌纤维化的有效途径之一。AngⅡ是CFs的重要生长调节因子,通过与其表面的AngⅡⅠ型受体结合,刺激CFs增殖的改变[16]。故本实验采用AngⅡ刺激CFs建立心肌纤维化细胞模型。本研究结果显示,AngⅡ 可以明显刺激CFs的增殖,降低CFs的早期凋亡率与总凋亡率;而FZHY可以逆转AngⅡ的促增殖作用并使CFs的早期凋亡率与总凋亡率显著升高,提示FZHY改善心肌纤维化的作用机制可能与其抑制AngⅡ诱导的CFs增殖并促进CFs凋亡有关。
miRNA是一类高度保守的非编码小分子RNA,通过抑制mRNA的翻译或促进mRNA降解,在转录后水平调节靶基因的表达[17]。研究表明,miRNA可通过参与细胞的增殖、凋亡及细胞外基质合成等多个环节调控纤维化进程[18-20]。miR-29主要表达于CFs,是心肌纤维化的调节因子之一,其家族成员包括miR-29a、miR-29b(miR-29b1/2)、miR-29c[21]。研究证实,miR-29可直接靶向抑制细胞外基质等纤维化相关蛋白的表达而改善心肌纤维化[5]。此外,miR-29b还可作为转化生长因子-β/Smads等致纤维化相关通路的上游因子调控心肌纤维化的发展[22-25]。Wang等[26]研究发现了miR-29抗纤维化过程中存在的Smad3依赖机制。以上结果均提示miR-29具有抗心肌纤维化的作用。
miR-29b1与miR-29a的基因簇同位于染色体7q32.3,而miR-29b2与miR-29c的基因簇同位于染色体1q32.2[27],因此miR-29b1和miR-29b2可分别与miR-29a和miR-29c共表达。由此推断,miR-29b可能更具代表性[6]。Zhang等[6]观察到AngⅡ刺激可使CFs中的miR-29a和miR-29c表达降低,而过表达或抑制miR-29b表达对miR-29a和miR-29c的表达并无明显影响,提示miR-29b在AngⅡ诱导的心肌纤维化过程中具有特殊地位。本实验以miR-29b-5p 为研究对象,结果表明AngⅡ的刺激使CFs的miR-29b-5p表达水平降低,而FZHY促进miR-29b-5p表达升高,提示FZHY改善心肌纤维化的作用机制与其上调CFs中的miR-29b-5p表达有关。
本研究在细胞水平初步探讨了FZHY抗心肌纤维化的分子机制,证实FZHY抗心肌纤维化的作用可能与其抑制AngⅡ诱导的CFs增殖、促进凋亡,提高miR-29b-5p表达有关。然而miR-29b-5p的表达与CFs增殖及凋亡之间的具体关联尚不清楚。综合前期的实验结果推测,FZHY抗心肌纤维化的作用机制可能与miR-29b-5p靶向抑制细胞外基质蛋白相关基因或调控转化生长因子-β/Smads信号通路,从而减少Ⅰ、Ⅲ型胶原的沉积,维持细胞外基质代谢平衡有关。本课题组将在在今后的实验中,采用细胞转染等技术进一步验证FZHY改善心肌纤维化的分子机制。
