影响t(8;21)急性髓系白血病M2患者预后的相关因素
2019-07-31杜小清吴红卫
杜小清,吴红卫,何 英
(成都医学院第一附属医院,四川成都 610500)
急性髓系白血病(AML)为患者造血干细胞在进行增殖分化期间出现突变所致,是一种血液系统出现恶性异质病变疾病[1].而t(8;21)则是AML患者染色体异常的一种形式,约有40%M2分型患者会出现t(8;21),t(8;21)是AML-M2患者位于8号染色体上ETO基因与21号染色体AML1基因发生变异,导致ETO/AML1融合基因出现,该融合基因同样具备转录活性[2].有研究[3]显示:ETO/AML1阳性表达的AML-M2患者治疗效果较好,完全缓解概率较高,预后情况较好,患者接受大剂量阿糖胞苷治疗可使患者5 a生存率达到55%.但是近期有研究[4]显示:t(8;21)AML出现一定异质性,有患者化疗效果不佳,化疗后病情容易反复,同时t(8;21)AML患者还出现其他染色体异常,患者预后情况未知.本研究通过对52例t(8;21)AMLM2患者资料进行回顾性分析,以了解影响患者预后相关因素.
1 资料和方法
1.1 一般资料
回顾性分析2012年1月—2016年1月成都医学院第一附属医院收治的52例t(8;21)AML-M2患者资料.其中,男29例,女23例;年龄19~81岁,中位年龄45岁;发病时患者血红蛋白(25~161)g/L,中位血红蛋白 72 g/L;白细胞计数(2.35~169.27)×109/L,中位白细胞计数26.42×109/L;血小板计数(6~117)×109/L,中位白细胞计数 28×109/L.
纳入标准:患有AML病,且FAB分型为M2型并伴有t(8;21);病情经骨髓形态学证实且诊断依据相关标准[5],染色体异位经过检测证实;患者资料完整且同意其资料用于本研究.
排除标准:患有骨髓增生异常综合征;并发髓系肉瘤;患有骨髓增殖疾病;患者治疗未达1疗程;患者资料不全.
1.2 方 法
1.2.1 实验室检查方法
患者细胞计数使用全自动血细胞分析仪,瑞氏吉姆萨染色用于患者外周血和骨髓细胞形态学分析;核型分析使用G显带技术,并按照相关命名要求命名;融合基因使用RT-PCR检测,PCR产物使用琼脂糖凝胶电泳分析.
1.2.2 治疗方法
患者诱导治疗使用标准剂量阿糖胞苷(Ara-C)化疗方法,该方法中含有MA,IA,DA以及HA等几种化疗方式,其中A即为剂量为100 mg/(m2·d)×7 d的Ara-C,而M表示剂量为8 mg/(m2·d)×3 d注射用盐酸米托蒽醌(江苏恒瑞医药股份有限公司;国药准字H32020964,规格:5 mg),I表示剂量为8 mg/(m2·d)×3 d的注射用盐酸伊达比星(浙江海正药业股份有限公司;国药准字 H20050144,规格:10 mg),D表示45 mg/(m2·d)×3 d的注射用盐酸柔红霉素(深圳万乐药业有限公司;国药准字H44024361,规格:20 mg(按 C27H29NO10 计)),H表示2.5 mg/(m2·d)×3 d的高三尖杉酯碱注射液(福州海王福药制药有限公司;国药准字H35020457).患者治疗前1~3 d注射M,I,D以及H等,治疗前1~7 d注射Ara-C.患者病情缓解后采用标准含量为100 mg/(m2·d)×3 d,以Ara-C或者加大剂量 100 mg/(m2·d)×7 d Ara-C,以巩固治疗效果.
1.3 观察指标
以总生存期(OS)为患者预后指标,对患者各项资料如性别、年龄(以60岁为界线)、血红蛋白量(以60 g/L为界线)、白细胞计数(以1.0×109/L为界线)、血小板计数(以40×109/L为界线)、外周血细胞及等同细胞比例(以50%为界线)、骨髓原始细胞及等同细胞比例(以50%为界线)、染色体核型、核磷蛋白1(NPM1)基因(野生和突变)、CCAAT/增强子结合蛋白-α(CEBPA)基因(野生和突变)、FMS样酪氨酸激酶-3-内部串联复制(FLT3-ITD)基因(野生和突变)、C-KIT基因(野生和突变)、诱导治疗疗效(完全缓解、部分缓解和未缓解)进行单因素以及多因素分析.
1.4 评价标准
诱导治疗疗效评价.完全缓解:白血病症状和体征消失,外周血血小板计数>100×109/L,中性粒细胞>1.0×109/L,无癌细胞存在;骨髓可以正常造血,无Auer小体存在,髓外浸润疾病消失.部分缓解:白血病症状和体征部分消失,血常规检测一项未达标;骨髓原始细胞比例在5%~25%之间,与治疗前下降超过50%.未缓解:白血病症状、血常规和骨髓原始细胞比例均未达到部分缓解指标.患者总生存期(OS)为病情确诊到死亡或者随访结束时间.所有患者均随访2 a,随访结束时间为2018年1月31日.
1.5 统计学分析
应用SPSS 20.0软件进行数据分析,正态分布计量资料以均数±标准差(珋x±s)表示,应用t检验比较,非正态分布计量资料应用中位数表示,应用秩和检验比较,计数资料应用χ2检验比较,单因素分析使用Log-rank检验,多因素分析使用Cox回归分析,以P<0.05为差异具有统计学意义.
2 结 果
2.1 影响t(8;21)AML-M2患者预后单因素分析
单因素分析结果显示:性别、血红蛋白量、血小板计数、外周血细胞及等同细胞比例、骨髓原始细胞及等同细胞比例、NPM1基因和CEBPA基因与预后无相关性(P>0.05),年龄、白细胞计数、染色体核型、FLT3-ITD基因以及诱导治疗疗效是否达到完全缓解与患者OS关系密切(P<0.05).见表1.

表1 影响t(8;21)AML-M2患者预后单因素分析Tab.1 Single-factor analysis of prognosis in patients with t(8;21)AML-M2
2.2 影响t(8;21)AML-M2患者预后多因素分析
Cox回归分析结果显示:年龄、染色体核型以及诱导治疗疗效为t(8;21)AML-M2患者预后独立影响因素(P<0.05).见表 2.
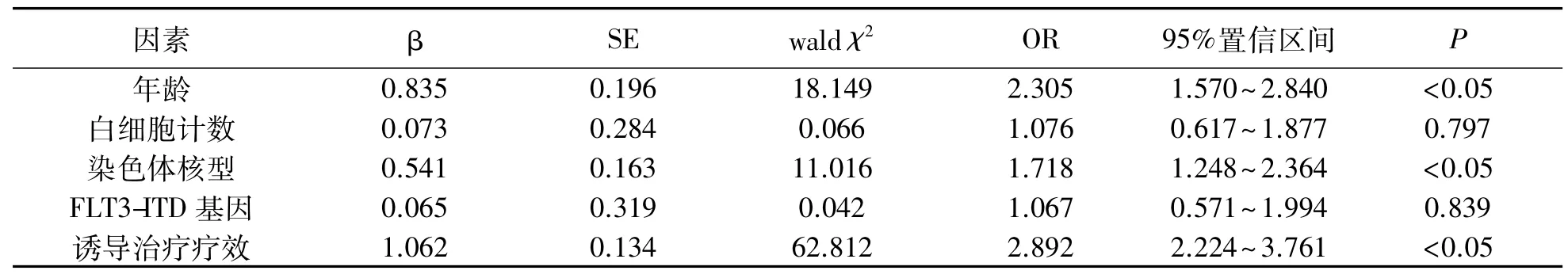
表2 影响t(8;21)AML-M2患者预后多因素分析Tab.2 Multivariate analysis of prognostic factors in patients with t(8;21)AML-M2
3 讨 论
相关研究[5-6]显示:t(8;21)AML患者预后较好,但是也有研究者认为有一些t(8;21)AML患者预后情况不佳,表明对于t(8;21)患者预后情况判断不能仅考虑t(8;21),还需要考虑其他因素.本研究结果显示:年龄>60 岁患者 2 a OS 率为(26.67±1.35)%,显著低于年龄≤60岁患者,而多因素分析也显示:年龄>60岁为影响患者预后相关因素.年龄导致患者预后较差可能与以下因素有关:患者年龄越大,细胞遗传不良物质占正常细胞比例逐渐上升;年龄过大患者身体状态差,各种基础疾病和并发症较多;化疗容易破坏患者免疫系统,导致患者免疫力下降,而老年患者免疫能力更差,在治疗过程中容易出现感染影响患者预后,上述这些因素均会导致老年患者预后较差.Tawfilk等[7]研究显示:中位年龄为70岁患者中位生存期为8.7个月,而中位年龄为47岁患者中位生存期为23.1个月,与本研究类似结论,年龄越大患者其预后越差.
陆亚岚等[8]研究显示:染色体核型正常AML患者治疗总缓解率显著优于核型异常AML患者,认为染色体异常可能是引起患者遗传学异常的主要原因,同时还会影响患者FAB分型.t(8;21)AML患者一般会存在染色体异常情况,而较常见异常为性染色体缺失,其次为del(9q).有研究[9]显示:仅t(8;21)异常与其他染色体异常5 a生存率差异不显著.而刘艳春等[10]研究同样表明:t(15;17)核型异常AML患者其化疗疗效也较好,其缓解率甚至优于 t(8;21)组患者.Schoch等[11]认为,染色体复杂畸形容易导致AML患者治疗效果不佳.
本研究结果显示:染色体核型也是影响患者预后重要危险因素,单纯t(8;21)异常患者预后优于其他染色体异常.Ara-C作为特异性抗肿瘤药物可以缩短患者化疗时间,改善患者缓解率.本研究结果显示:患者首次诱导治疗达到完全缓解患者预后较好,2 a OS率较好.赵婷等[12]研究结果显示:患者在接受化疗前两个疗程就已至完全缓解患者OS时间显著长于接受化疗3个疗程至完全缓解患者,认为AML患者化疗早日达到完全缓解,患者远期生存期越好.但是宋立孝等[13]则认为AML患者化疗缓解后接受进一步巩固治疗则可使患者预后得到改善.有研究[14-15]显示:发病时白细胞计数≥100×109/L是影响患者预后危险因素,认为患者外周血白细胞含量过高时容易导致血栓或出血发生,而化疗致使白细胞被破坏,引起多种黏附以及促凝因子释放,导致出现肿瘤溶解综合征,影响患者预后.而本研究中白细胞计数并不是影响患者预后危险因素,可能是由于本研究中白细胞计数(分界线1.0×109/L)偏小所致.
t(8;21)AML-M2患者预后容易受到多因素影响,本研究结果显示:患者年龄过大、染色体核型异常患者预后较差,而在诱导治疗时早日至完全缓解可以延长患者生存期,预后较好.
