秸秆掺杂与煅烧改性沸石吸附铜锌离子的特性
2019-07-30李见云崔节虎郑宾国许可罗旭化全县
李见云,崔节虎,郑宾国,许可,罗旭,化全县
(1.郑州航空工业管理学院 资源与环境研究所,河南 郑州 450015;2.郑州大学 化工与能源学院,河南 郑州 450001)
随着传统产业的集约发展,土壤重金属污染越来越严重,污染预防控制和修复已成为当前研究热点[1-3]。吸附法是近年来最为活跃的消减重金属污染的处理方法[4-6]。天然沸石是一族具有复杂三维空间结构的吸附材料,在重金属污染治理中得到了广泛应用[7-8],但因其孔径狭小、孔穴杂质等而降低吸附性,高温焙烧是扩展孔径、清除杂质常用的方法[9-12]。高温焙烧农业秸秆所制备的活性炭对去除重金属有显著作用[13-15]。
本文将小麦秸秆与天然沸石进行混杂、高温焙烧,制备改性沸石,并研究对去除模拟废液中Cu2+和Zn2+的性能,为天然沸石和农业秸秆在治理重金属污染的应用提供科学依据。
1 实验部分
1.1 材料与仪器
小麦秸秆,郑州市郊农田;天然沸石,采自河南省信阳市,其主要化学组成见表1;Cu(NO3)2、Zn(NO3)2、Ca(NO3)2均为分析纯。
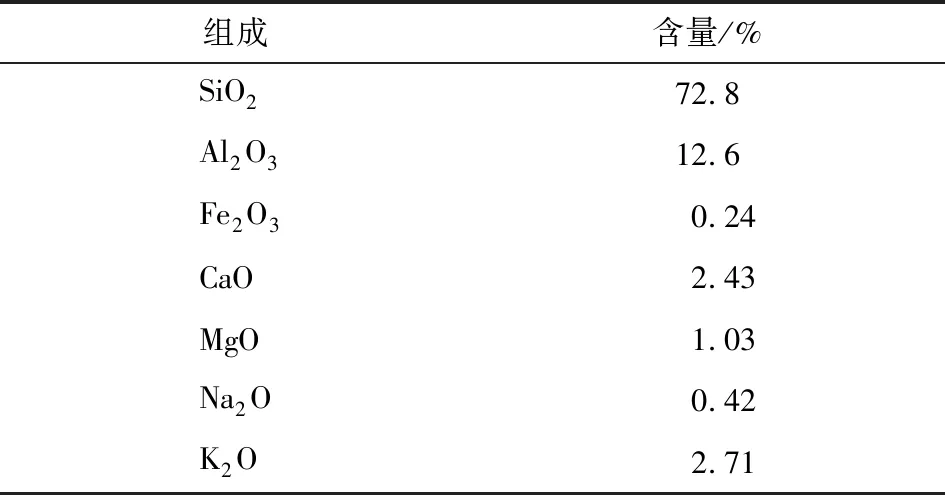
表1 天然沸石的主要化学组成
JJ-1精密增力电动搅拌器;SHZ-82回旋气浴恒温振荡箱;SX-5-12马弗炉;TAS-990F火焰原子吸收光谱仪;TSM-7500F场发射扫描电子显微镜;Axio scope A1蔡司金相显微镜。
1.2 实验方法
1.2.1 沸石改性 小麦秸秆、天然沸石分别以去离子水洗涤后于378 K烘干,过0.180 mm筛。准确称取小麦秸秆10 g和沸石粉100 g于500 mL烧杯中,混合均匀,加入去离子水,调至浆状,200 r/min搅拌,混合60 min。于383 K干燥120 min,装入具盖陶瓷坩埚,半掩,以使秸秆缺氧碳化,转移到马弗炉内,程序升温至723 K,焙烧120 min。冷却,取出,粉碎,过0.180 mm筛,即为小麦秸秆掺杂和煅烧联合改性沸石。改性沸石形貌通过场发射扫描电子显微镜表征,粒径通过蔡司金相显微镜测定。
1.2.2 吸附实验 Cu2+、Zn2+溶液均用0.01 mol/L Ca(NO3)2溶液配制。将改性沸石与模拟废水以1∶20 固液比加入100 mL具塞塑料离心管中,以200 r/min混合振荡24 h后低速离心,取上清液,通过火焰原子吸收光谱仪测定Cu2+、Zn2+含量。实验数据利用ORIGIN软件进行统计分析。
2 结果与讨论
2.1 初始浓度与吸附等温线
温度298 K时溶液振荡24 h使改性沸石与Cu2+、Zn2+离子充分接触,吸附量与初始浓度的变化见图1。
由图1可知,改性沸石对溶液中Cu2+、Zn2+吸附量随离子初始浓度的升高而增加,且呈明显的两段式变化。初始浓度为200~600 mg Cu/L时,Cu2+吸附量与初始浓度间相关系数为0.992,呈显著线性相关(n=3,r0.1=0.988);初始浓度为20~400 mg Zn/L时,Zn2+吸附量与初始浓度呈极显著线性正相关,相关系数为0.995(n=6,r0.001=0.974),均为快速吸附过程。初始浓度为600~1 000 mg Cu/L、400~800 mg Zn/L时,改性沸石对Cu2+、Zn2+吸附量增加缓慢,为慢速吸附过程。
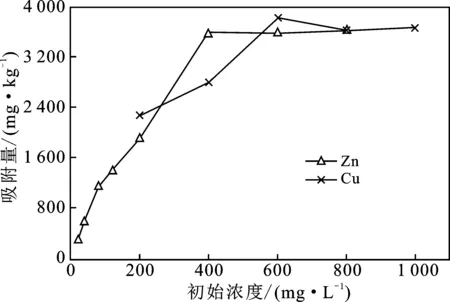
图1 Cu2+、Zn2+离子初始浓度对改性沸石吸附过程的影响Fig.1 Effects of initial concentration on adsorption of Cu2+,Zn2+ ions onto modified zeolite in water solutions
天然沸石是一族含水的多孔道架状结构铝硅酸盐粘土矿物,其内部存在大量的排列有序、孔径大小均匀及相互连通的孔道和孔穴。同时,Al3+与Si4+同晶置换使沸石带有永久性负电荷,从而使得天然沸石具有多孔穴、孔道、阳离子交换等特性,对重金属离子表现出显著的吸附性[16]。
用方程Langmuir、Freundlich和Dubinin-Radushkevich拟合改性沸石对Cu2+、Zn2+的等温吸附结果见表2。
Langmuir方程:
Ce/Qe=Ce/Qm+1/kLQm
Freundlich方程:
lnQe=lnkF+(1/n)lnCe
Dubinin-Radushkevich方程:
lnQe=lnQm-kDε2
式中Ce——吸附反应平衡后溶液中Cu2+、Zn2+含量,mg/L;
Qe——吸附平衡时改性沸石对吸附质的吸附量,mg/kg;
Qm——改性沸石对吸附质的理论吸附容量,mg/kg;
kL、kF、kD、n——均为常数;
ε=RT(1+1/Ce)
R——理想气体状态常数;
T——反应温度,K。
由表2的R2可知,该吸附符合Langmuir,Freundlich的R2≥0.927,说明改性沸石对Cu2+、Zn2+的吸附存在多种机制[17],改性沸石对Cu2+、Zn2+最大吸附容量Qm分别为4 043 mg Cu/kg和 4 087 mg Zn/kg。
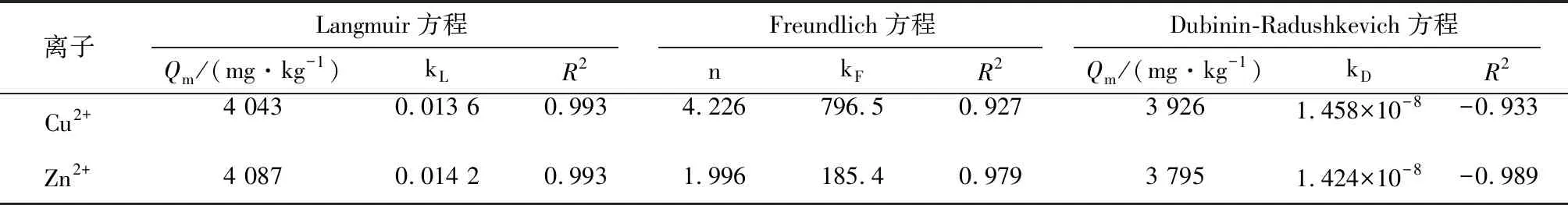
表2 等温吸附方程参数
由图2可知,改性沸石中76.4%的颗粒分布在0~3 μm之间,且近似均匀分布。天然沸石中颗粒主要集中在0~1 μm,为全部颗粒组成的66.3%。经过723 K高温和缺氧处理,小麦秸秆形成的活性炭纤维和高温的黏结作用使得天然沸石颗粒有所增长。小麦秸秆和天然沸石中有机物质逸散,疏通了沸石孔道,增强了沸石比表面积。由图3可知,沸石是由许多细小的纤维棒状晶粒和层片状晶粒不规则堆叠而成,形成大量的细小孔隙。改性沸石比天然沸石表面较为平整,孔道内杂质少。
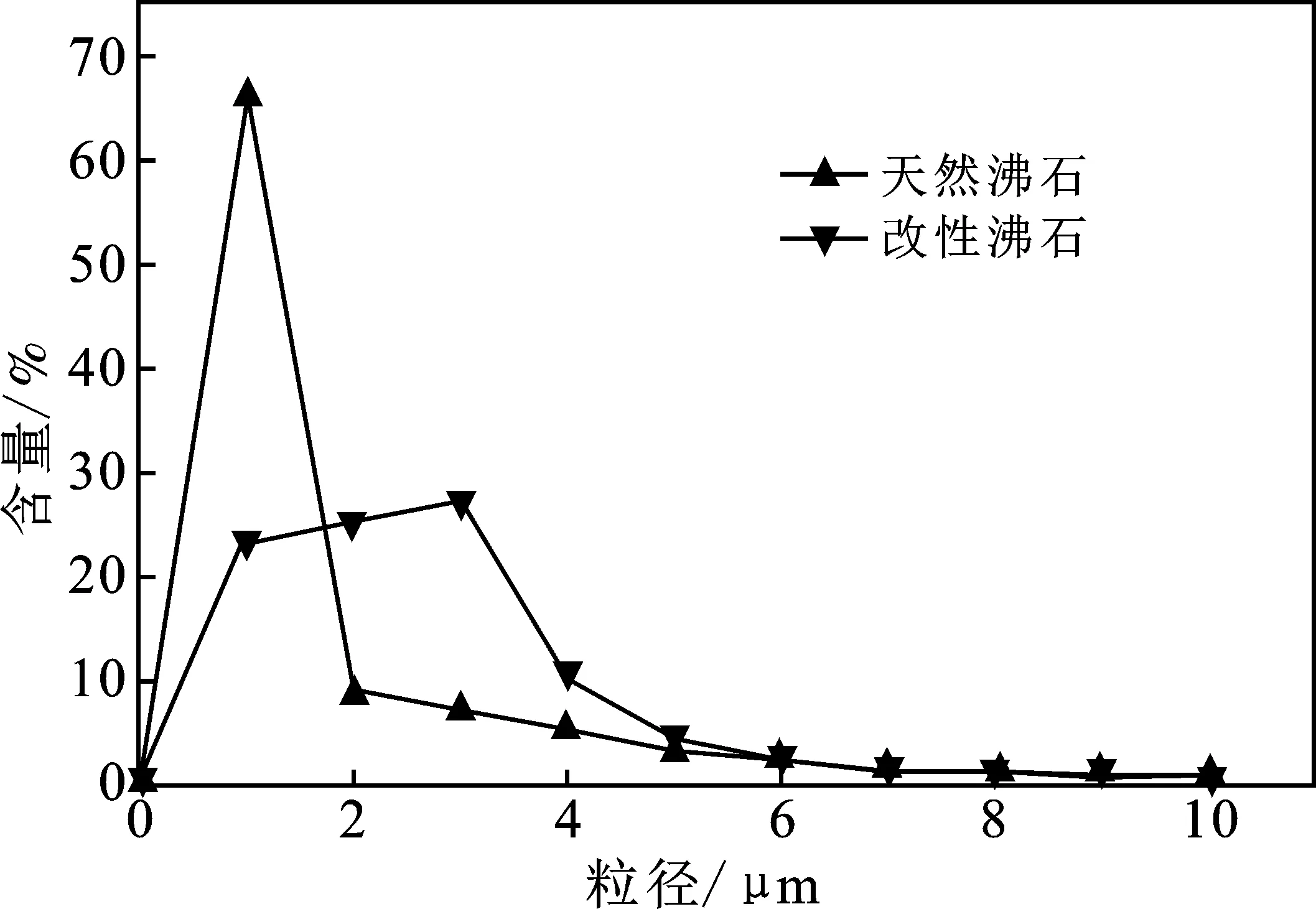
图2 天然沸石和改性沸石粒度分布Fig.2 Distribution of raw and modified zeolite particles

图3 天然沸石(a、b)和改性沸石(c、d)SEMFig.3 SEM of raw and modified zeolite
2.2 接触时间与吸附动力学
由图4可知,接触时间30 min和180 min时,改性沸石对Cu2+、Zn2+的吸附分别达到平衡,平衡吸附量分别为3 454 mg Cu/kg、816 mg Zn/kg。改性沸石对Cu2+的吸附能力约是Zn2+的4.23倍,主要是由两种离子的一级水解常数、电负性、离子半径以及电荷数/半径比等理化性质差异引起[18-19],水体表层沉积物、生物活性炭、磷灰石等吸附剂对Cu2+、Zn2+的吸附过程表现出类似规律[20-22]。
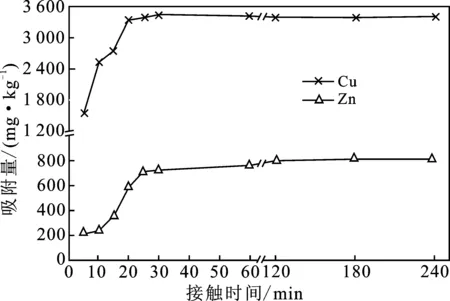
图4 接触时间对改性沸石吸附Cu2+、Zn2+过程的影响Fig.4 Effects of contact time on adsorption of Cu2+,Zn2+ ions on modified zeolite in water solutions
用准一级动力学方程、准二级动力学方程、Elovich方程和双常数方程[23]对改性沸石吸附Cu2+、Zn2+过程进行拟合,结果见表3。
准一级动力学方程:
ln(Qe-Qt) = lnQe-k1t
准二级动力学方程:
t/Qt=1/(k2Qe2) + (1/Qe)t
Elovich方程:
Qt=(1/b)lnab+(1/b)lnt
双常数方程:
lnQt=lnk3+(1/p)lnt
式中t——接触时间,min;
Qt——改性沸石在t时刻的吸附量,mg/kg;
Qe——吸附达到平衡时刻的吸附量,mg/kg;
k1、k2、k3、a、b、p——吸附常数。
由表3可知,准一级动力学方程拟合Cu2+、Zn2+在改性沸石中理论平衡吸附量Qe远远偏离于实验值,不适合改性沸石对Cu2+、Zn2+的吸附动力学过程描述。准二级动力学方程可用来描述改性沸石对Cu2+、Zn2+的吸附过程,表明该吸附行为存在化学吸附。Elovich方程和双常数方程均为经验式方程,表明改性沸石对Cu2+、Zn2+的作用过程为反应较复杂和多界面的动力学过程。

表3 改性沸石吸附Cu2+、Zn2+动力学过程拟合模型及参数
注:当n = 10,P<0.01时,线性相关系数r临界值为0.765。
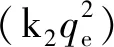
2.3 环境温度与吸附热力学
由表4可知,随反应温度的升高,改性沸石对Cu2+、Zn2+的吸附量呈正相关变化,当温度升高至328 K时,改性沸石对Cu2+、Zn2+的吸附量比温度为298 K时增加了48.1%和54.4%。表明环境温度的升高有利于推进吸附反应,增加了改性沸石对Cu2+、Zn2+的吸附量,有利于改性沸石去除溶液中的Cu2+和Zn2+。
当吸附自由能变ΔG低于40 kJ/mol时,反应以物理吸附为主,反之则以化学吸附为主。吸附自由能变ΔG可通过Gibbs方程得到。
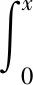
式中x——溶液中Cu2+、Zn2+的摩尔分数;
Qe——吸附平衡时的吸附量,mg/kg;
T——反应温度,K;
R——理想气体状态常数。
代入Freundlich方程,可得到公式:
ΔG=-nRT
其中,n为Frendlich方程的参数。
计算可得改性沸石与Cu2+、Zn2+吸附反应的吸附自由能变ΔG,为负值,改性沸石对Cu2+、Zn2+的吸附过程为以物理吸附为主的自发反应。
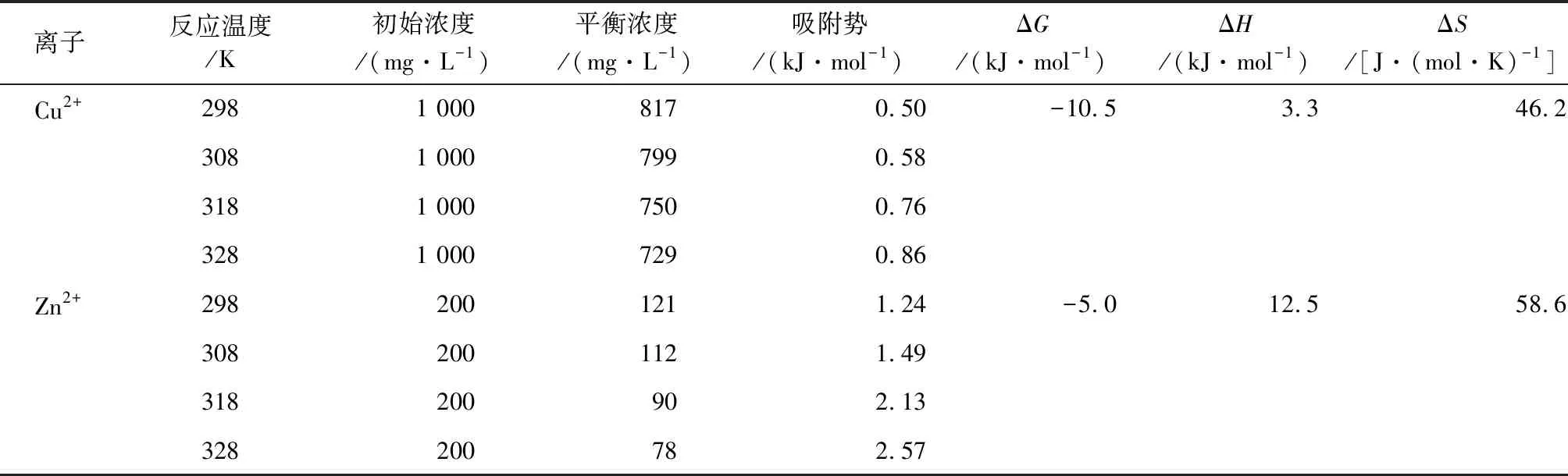
表4 反应温度对改性沸石吸附Cu2+、Zn2+过程的影响
由Clausius-Clapeyron方程计算吸附焓变ΔH:
lnCe=ΔH/RT+lnK0
式中Ce——吸附平衡时溶液中吸附质离子浓度,mg/L;
R——理想气体状态常数;
T——反应温度,K;
K0——常数。
以lnCe对1/T做图、拟合,计算可得吸附焓变ΔH,为正值,表明改性沸石对Cu2+、Zn2+的吸附反应为吸热过程,吸附量与环境温度呈正相关变化。
吸附熵变ΔS可由Gibbs-Helmholtz方程计算:
ΔS=(ΔH-ΔG)/T
计算可得,改性沸石对Cu2+、Zn2+吸附熵变为正值,表明吸附过程是以熵为推动力的反应过程。
利用Polanyi吸附理论公式可计算吸附势(E):
E=-RTln(Ce/C0)
式中E——吸附势,kJ/mol;
R——理想气体状态常数;
T——反应温度,K;
C0、Ce——吸附质溶液的初始浓度和平衡浓度,mg/L。
吸附势(E)是区分物理吸附和化学吸附的重要参数,当E<8 kJ/mol时,吸附过程为物理吸附;当E介于8~16 kJ/mol时,吸附过程为离子交换吸附;当E>20 kJ/mol时,吸附过程为化学吸附。改性沸石对Cu2+、Zn2+吸附过程的吸附势均低于8 kJ/mol,为物理吸附过程。
3 结论
通过小麦秸秆混杂和高温煅烧对天然沸石进行改性,改性沸石对溶液中Cu2+、Zn2+的等温吸附过程符合Langmuir模型,理论饱和吸附容量分别为4 043 mg Cu/kg和4 087 mg Zn/kg。吸附动力学过程符合准二级动力学方程。吸附热力学参数ΔG<0、ΔH>0、ΔS>0,吸附势低于8 kJ/mol。改性沸石对Cu2+、Zn2+的吸附过程为自发、吸热的物理吸附过程。
