MMP-9蛋白的抗原表位分析及单克隆抗体制备
2019-07-29许映雪尹焕才
许映雪 尹焕才
(1. 中国科学院苏州生物医学工程技术研究所,苏州 215163;2. 中国科学院大学,北京 100049)
细胞外基质对于维持细胞内环境稳定至关重要,它们通常分布在细胞表面或细胞之间,是由细胞合成并分泌到胞外的大分子,主要是一些多糖和蛋白,或蛋白多糖。这些物质构成复杂网架结构,支持并连接组织结构,参与细胞的各种生理活动。在炎症、肿瘤等病理情况下,正常的细胞外基质结构遭到破坏,进一步加剧炎性细胞浸润、肿瘤细胞浸润转移等病理进程,这些病理进程通常与基质金属蛋白酶(Matrix metalloproteinases,MMPs)息息相关[1]。
迄今为止,在人体中已发现超过20种MMPs。MMPs作为一类Zn2+依赖性内切酶家族,是分解细胞外基质的蛋白酶类中最重要的一类。根据其降解底物的不同,可将人源性MMPs分为胶原酶类(MMP-1、-8、-13和 -18)、明胶酶类(MMP-2和 -9)、间质溶解素(MMP-3、-10和 -11)、膜型MMPs(MMP-14、-15、-16、-17、-24 和 -25)及其他MMPs五大类[2]。正常生理条件下,MMPs活性很低并受到转录水平上的严格调控,同时受到金属蛋白酶组织抑制剂(TIMP)的调节,其以酶原的形式被分泌到细胞外基质中,被激活后特异性作用于细胞外基质[3]。而在某些疾病病程中MMPs活性却显著增强,如动脉粥样硬化、肾炎、纤维素炎等[4]。
MMP-9,又称明胶酶B,是MMPs家族中相对分子质量最大的酶,其基因定位于20q11.2-13.1[5],可由单核细胞、巨噬细胞、中性粒细胞、成纤维细胞及多种肿瘤细胞分泌[6],其表达受到多种正常细胞及肿瘤细胞分泌的多种细胞因子及生长因子的调控,如白介素[7-9]、干扰素[10]、EGF[11]、NGF[12]、FGF[13]、VEGF[14]、PDGF[15]、TGF-β[16-18]等,其活化形式的作用底物也十分广泛,包含明胶、部分类型的胶原蛋白,弹性蛋白以及层粘连蛋白等。MMP-9的主要结构包括MMPs家族共有的氨基端前肽区、羧基端类血红蛋白结构域和一个高度保守的含有Zn2+结合位点的催化区,其催化区还有一个能与明胶及纤维蛋白高度亲和的嵌入式区域[19]。正常生理条件下,MMP-9与其他MMPs协同作用,共同参与正常组织的发育及重塑,如胚胎发育、血管生成、骨骼塑型、伤口愈合等,另一方面也通过破坏局部组织结构和基膜屏障,促进肿瘤新生血管的形成和肿瘤生长,利于肿瘤的侵袭转移等病理过程[20-21]。
目前,市场上已有的MMP-9抗体产品中,国外单克隆抗体占据主要市场,但因其价格较为昂贵,临床大批量使用成本较高。国内的MMP-9抗体以多克隆抗体为主,且只用于科研使用,尚未出现临床产品。本研究旨在初步开发MMP-9单抗临床试剂盒,为MMP-9的肿瘤临床筛查应用奠定基础。
1 材料与方法
1.1 材料
人源cDNA为本实验室保存,TOP10和BL21(DE3)为本实验室保存。Taq DNA聚合酶及其相应的PCR反应用试剂购自TaKaRa公司;限制性内切酶BamHI、XhoI、T4 DNA连接酶及其相关试剂购自 Fermentas公司;1.5 kb DNA ladder marker、PCR产物纯化和DNA片段胶回收试剂盒购自Axygen公司;TIANprep快速质粒小提试剂盒(离心柱型)购自北京天根生物技术公司;HRP交联的兔抗鼠二抗购自Rockland公司;化学发光底物检测试剂购自Millipore公司;胎牛血清(Fetal Bovine Serum)、胰酶Trypsin-EDTA购自GIBCO公司;HAT培养基购自Sigma公司;基因合成测序由上海生工生物工程公司完成。
1.2 方法
1.2.1 MMP-9蛋白的抗原表位预测及引物设计 通过uniport数据库获取MMP-9基因全长序列,利用DNAstar-Protean、PBD对其跨膜区、亲水性等性质进行分析,筛选其抗原表位区,命名为Δmmp9。通过分析抗原表位区序列,钓取最终目的基因的片段,设计引物序列,并在5′端和3′端分别引入BamH I和XhoI的酶切位点。
1.2.2 重组表达载体pET28α(+)-Δmmp9构建 以人源cDNA为模板,以人工合成引物扩增目的片段,引物序列为Primer1:5′-CGGGATCCATGCAGGACGG CAATGCTGAT -3′(下划线序列为BamH I酶切位点),Primer2 :5′-CGCTCGAGCGCCACGAGGAACAAACT-3′(下划线序列为XhoI酶切位点)。PCR扩增反应条件 :94℃ 5 min ;94℃ 1 min,56℃ 30 s,72℃ 45s,40个循环;72℃ 5 min。PCR产物与原核表达载体pET28α(+)质粒用BamHI和XhoI进行双酶切,将两者的双酶切产物用T4 DNA连接酶连接。将连接产物转化到TOP10,筛选阳性克隆,提取重组表达载体pET28α(+)-Δmmp9后送往上海生工测序。
1.2.3 重组蛋白诱导表达 将分析结果正确的重组载体 pET28α(+)-Δmmp9 转化至 BL21(DE3),选用终浓度为1 mmol/L的IPTG,37℃,220 r/min,诱导4 h,阴性对照组不加IPTG诱导剂。5 000 r/min 10 min,弃上清,收集菌体沉淀,并用PBS溶液重悬,冰浴超声,参数为time 20 min,pluse 5 s,超声5 s,功率39%。超声后4℃,16 000 r/min 1 h,分别收集并标记上清液及沉淀。用包涵体溶解液溶解沉淀,分别取上清液和包涵体溶解液的样品进行SDSPAGE电泳验证,分析结果。
1.2.4 重组蛋白扩增培养及纯化 将上步含有重组载体 pET28α(+)-Δmmp9的 BL21(DE3)菌液及时扩增培养,按照同样诱导条件诱导表达,离心收集菌体沉淀,重悬后冰浴超声破碎,离心取沉淀,溶解后离心取上清液,此上清液即为溶解的重组蛋白。过0.22 μm膜后用Ni柱纯化,将洗脱液咪唑浓度按照 100 μmol/L → 300 μmol/L → 500 μmol/L 梯度调节,保留流穿样品及纯化样品进行SDS-PAGE电泳验证。按照电泳结果将含目的蛋白的洗脱液进行透析复性、超滤浓缩,过滤除菌后-80℃保存。
1.2.5 重组蛋白免疫小鼠 将纯化后的重组蛋白作为抗原与弗氏完全佐剂1∶1混合,对5只7-10周龄的BALB/c小鼠按照常规免疫程序进行首免,首免抗原浓度为1 mg/mL,免疫剂量为0.1 mL/只。二免-四免抗原与弗氏不完全佐剂混合,抗原浓度为0.5mg/mL,免疫剂量为0.1 mL/只,首免后第21 d进行二免,二免到三免,三免到四免间隔时间为14 d。四免后第7 d小鼠眼眶采血,10 000 r/min 10 min,取上清做抗体检测时的阳性对照,阴性对照取免疫前小鼠血清。
1.2.6 单克隆杂交瘤细胞株的建立及筛选 已经免疫的BALB/c小鼠无菌条件下摘取脾脏,制成脾细胞悬液,与骨髓瘤细胞SP2/0按5∶1比例混合,采用PEG1500作为融合剂,按照常规融合方法。待细胞集落长至孔底1/2时吸出所有克隆生长孔的上清用间接ELISA法进行抗体检测,挑取特异性好的阳性孔及时冻存和克隆化,筛选出单克隆细胞株。
1.2.7 腹水制备、纯化及效价检测 取3-6只BALB/c小鼠提前7 d腹腔注射灭菌液体石蜡,0.5mL/只,用无血清RPMI-1640培养液调整待接种的杂交瘤细胞密度至8×105个/mL,腹腔注射,1 mL/只。密切观察小鼠的腹水征象,每隔1-3 d取一次腹水。用亲和层析柱纯化腹水,收集纯化的单抗,用间接ELISA法进行抗体效价测定。
1.2.8 配对单抗的筛选 采用双抗夹心ELISA法筛选配对抗体。从得到的单抗中取出两种单抗,一种作为捕获抗体,一种作为标记抗体(经过HRP酶标记),将捕获抗体包被抗原板,加入稀释的重组蛋白作为抗原,再加标记抗体,最后加入显色液显色。根据配对实验结果调整后续配对实验,最终筛选出合适的配对抗体并确定其有效工作浓度。
2 结果
2.1 MMP-9蛋白的抗原表位预测
通过uniport数据库获取MMP-9基因信息,其数据显示该蛋白经成熟化后,包含的氨基酸序列为第94-707位,为了避免产生针对信号肽和前导肽的抗体副产物而影响最终抗体的总效价,重组蛋白抗原的最终片段必须包括第94-707位氨基酸中。通过DNAstar-Protean软件分析重组蛋白的氨基酸序列分布情况,预测结果(图1-A)表明:该蛋白主要以亲水性氨基酸为主,α螺旋结构较少,该蛋白整体亲水性较强,选取该蛋白中亲水性较强又具有较小空间位阻的氨基酸序列区段,通过该蛋白现有的不完全晶体结构利用PBD等数据库同源建模得到MMP-9蛋白的空间立体结构图(图1-B)表明:该蛋白具有一个较长的信号肽末端,同时含有4个明显的二级结构,二级结构之间有几条完全暴露在外的强亲水性的氨基酸序列。基于以上信息,选取包含暴露在二级结构外的、具有较强亲水性的多肽序列,即包括第288-389位氨基酸的多肽序列(图1-C),即选取包含第278-399位氨基酸多肽作为最终基因钓取片段,命名为Δmmp9。
2.2 重组表达载体pET28α(+)-Δmmp9构建
以人源cDNA为模板,以人工合成的引物扩增目的基因片段,结果(图2-A)显示该片段大小为581 bp,质粒pET28α(+)大小为5 369 bp,重组表达载体pET28α(+)-Δmmp9转化抽提后,使用BamH I和XhoI进行双酶切后进行琼脂糖凝胶电泳,结果(图2-B)显示有2条DNA条带,分别获得581 bp的目的基因和5 369 bp的载体片段。将基因测序的结果与NCBI中MMP-9序列对比,无碱基突变,表明目的基因片段已正确插入pET28α(+)载体中。
2.3 重组蛋白诱导表达
重组表达载体 pET28α(+)-Δmmp9转化至BL21(DE3),以终浓度为1 mmol/L的IPTG,37℃,220 r/min,诱导表达4 h。离心取菌体沉淀冰浴超声破碎,高速离心分离上清液和包涵体,对其进行SDS-PAGE分析,结果(图3)显示包涵体样品中在15 kD左右有一条清晰明显的深色条带,其蛋白大小与预期重组蛋白大小一致,证明该蛋白即为重组蛋白Δmmp9,且在BL21的包涵体中表达成功。
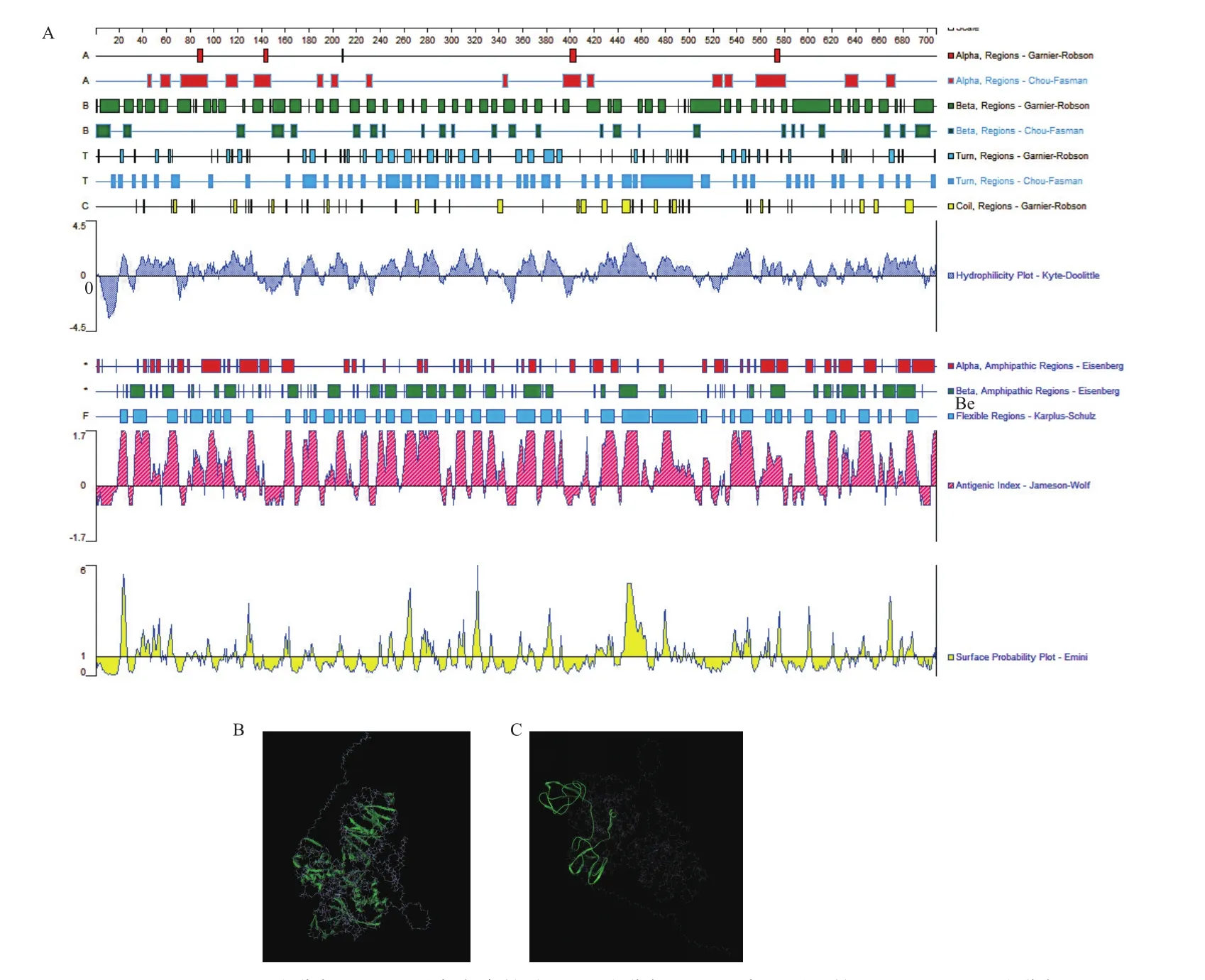
图1 抗原表位区预测
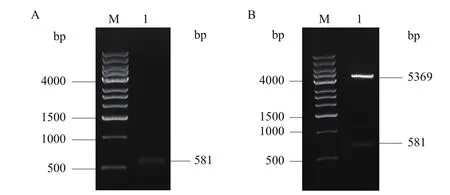
图2 重组表达载体pET28α(+)-Δmmp9鉴定
2.4 重组蛋白扩增培养及纯化
将含有重组载体pET28α(+)-Δmmp9的BL21(DE3)菌液扩增培养,按照同样诱导条件诱导表达,离心收集菌体沉淀,重悬后冰浴超声破碎,离心取沉淀,溶解后离心取上清液,过0.22 μm膜后用Ni柱纯化,保留流穿样品、纯化样品进行SDS-PAGE电泳验证,结果(图4)发现在流穿样品中含有很少的重组蛋白,300 μmol/L咪唑洗涤液洗脱重组蛋白效果最好,可见15 kD处有明显条带,纯化成功。
2.5 单克隆杂抗体交瘤细胞株建立
取免疫后小鼠脾脏细胞与SP2/0骨髓瘤细胞,通过PEG1500融合获得杂交瘤细胞,经过HAT培养基初步筛选培养,对阳性孔采取有限稀释法挑选单克隆抗体杂交瘤细胞株,最终获得7株稳定分泌单克隆抗体的杂交瘤细胞株,分别命名为C3B3B11、D10D8、B4-4、D6G7、5-9、B8C5G10 及 A6A10。
2.6 腹水制备及效价检测
BALB/c小鼠依次标记并接种7株杂交瘤细胞株后,收集腹水,经过亲和柱层析法对抗体进行纯化,通过间接ELISA法对收集的7种纯化抗体进行效价检测,结果(图5)显示7种单克隆抗体效价均在1∶240 000以上,符合要求。
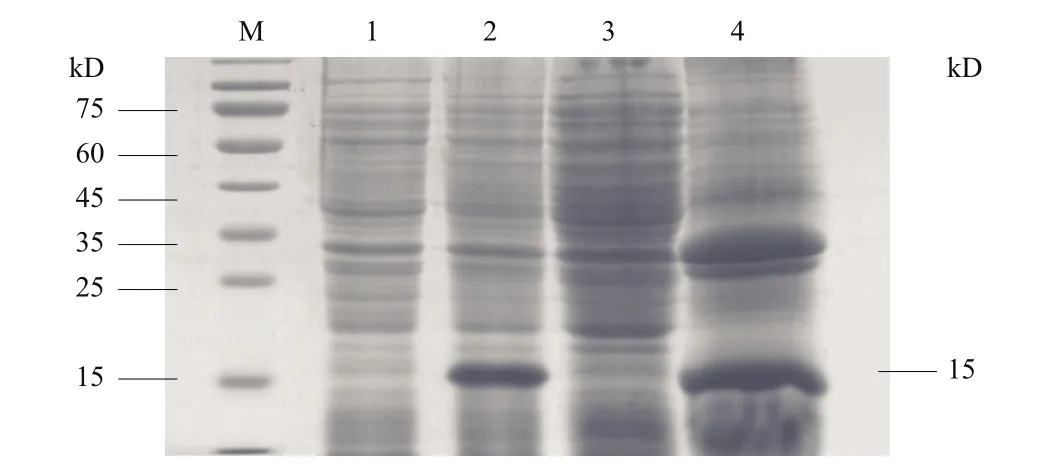
图3 重组蛋白Δmmp9的诱导表达
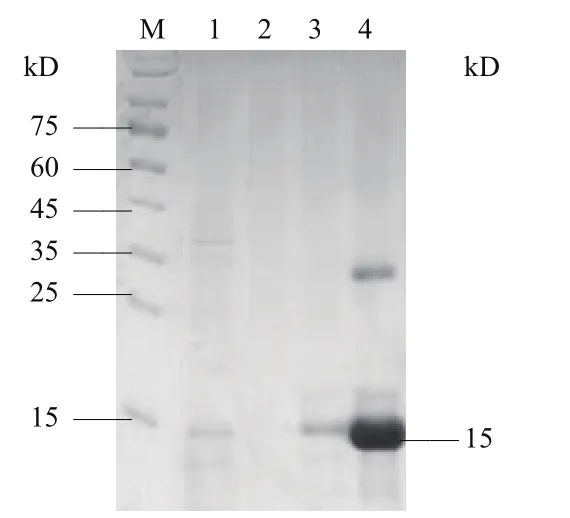
图4 重组蛋白纯化
2.7 配对单抗的筛选
采用双抗夹心ELISA法筛选配对抗体。首先选择C3B3B11作为捕获抗体,分别以1∶5 000和1∶10 000的稀释度包板,标记抗体为HRP标记后的7种单抗,标记抗体以1∶10 000和1∶50 000稀释,其他抗体对以此类推。初步配对实验结果为:B4-4与其他6种单抗都有配对可能,可作为捕获抗体,其他抗体作为其标记抗体;D6G7与C3B3B11、5-9、A6A10有配对可能,D6G7可作为捕获抗体,C3B3B11、5-9、A6A10可作为其标记抗体;B8C5G10与C3B3B11、5-9、A6A10有配对可能,B8C5G10可作为捕获抗体,C3B3B11、5-9、A6A10可作为其标记抗体。
后续调整配对实验条件,对3种捕获抗体及其配对标记抗体的工作浓度进一步调整,结果见图6。图6-A显示,B4-4以1∶2 000作为捕获抗体包板效果较好,其配对的标记抗体稀释度依次为 :C3B3B11-HRP 为 1∶5 000-1∶10 000;5-9-HRP为 1∶5 000-1∶10 000;A6A10-HRP为 1∶5 000;B8C5G10-HRP为1∶5 000;D10D8-HRP为1∶5 000-1∶10 000。图6-B显示,D6G7以1∶1 000-1∶2 000包板效果较好,其配对的标记抗体稀释度依次为:C3B3B11-HRP为1∶5 000-1∶10 000;5-9-HRP为1∶1 000-1∶5 000;A6A10-HRP为1∶1 000-1∶5 000。图6-C显示,B5C5G10以1∶5 000包板效果较好,其配对的标记抗体稀释度依次为:C3B3B11-HRP为 1∶5 000-1∶10 000;5-9-HRP为1∶5 000-1∶10 000;A6A10-HRP 为 1∶5 000。
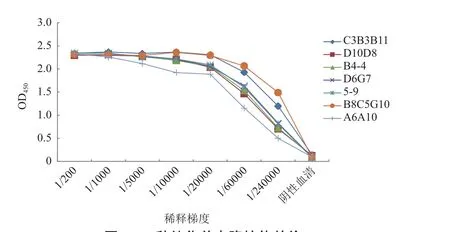
图5 7种纯化单克隆抗体效价
3 讨论
近年来的临床研究表明,MMP-9可以作为部分癌症发展和转移的指标,甚至对一些癌症和疾病具有预后诊断参考价值。王璐、王小侠等[22-23]对胃癌的临床研究表明MMP-9高表达对肿瘤浸润、转移都具有促进作用。高晨[24]的研究也指出MMP-9基因表达水平有作为原发性肝癌复发、侵袭和转移指标的可能,同时部分临床研究表明MMP-9有可能成为监测慢性阻塞性肺疾病严重程度及恶化的更精确的指标[25]。有研究证明通过监测血清中MMP-9和TIMP-1的表达不止有助于确定乳腺癌的转移情况[26],对结直肠癌的预后诊断也有一定价值[27]。单体臻等[28]的临床研究表明血清中MMP-2、MMP-9水平可成为阿尔茨海默病诊断的参考因子。在子宫内膜癌的研究中,尿激酶型纤溶酶原激活剂(UPA)与MMP-9在子宫内膜癌组织的阳性表达率显著高于正常子宫内膜组织(P<0.05),且两者表达水平正相关,提示临床联合检测二者有可能为评估子宫内膜癌病变程度提供参考[29]。在膀胱移行细胞癌研究中,骨桥蛋白(OPN)和MMP-9在膀胱组织中表达升高与肿瘤细胞转移有密切关系,检测OPN和MMP-9对膀胱移行细胞癌的诊断和预后判断具有重要参考价值[30]。因此,在临床上MMP-9有作为新型肿瘤诊断标记的潜能。
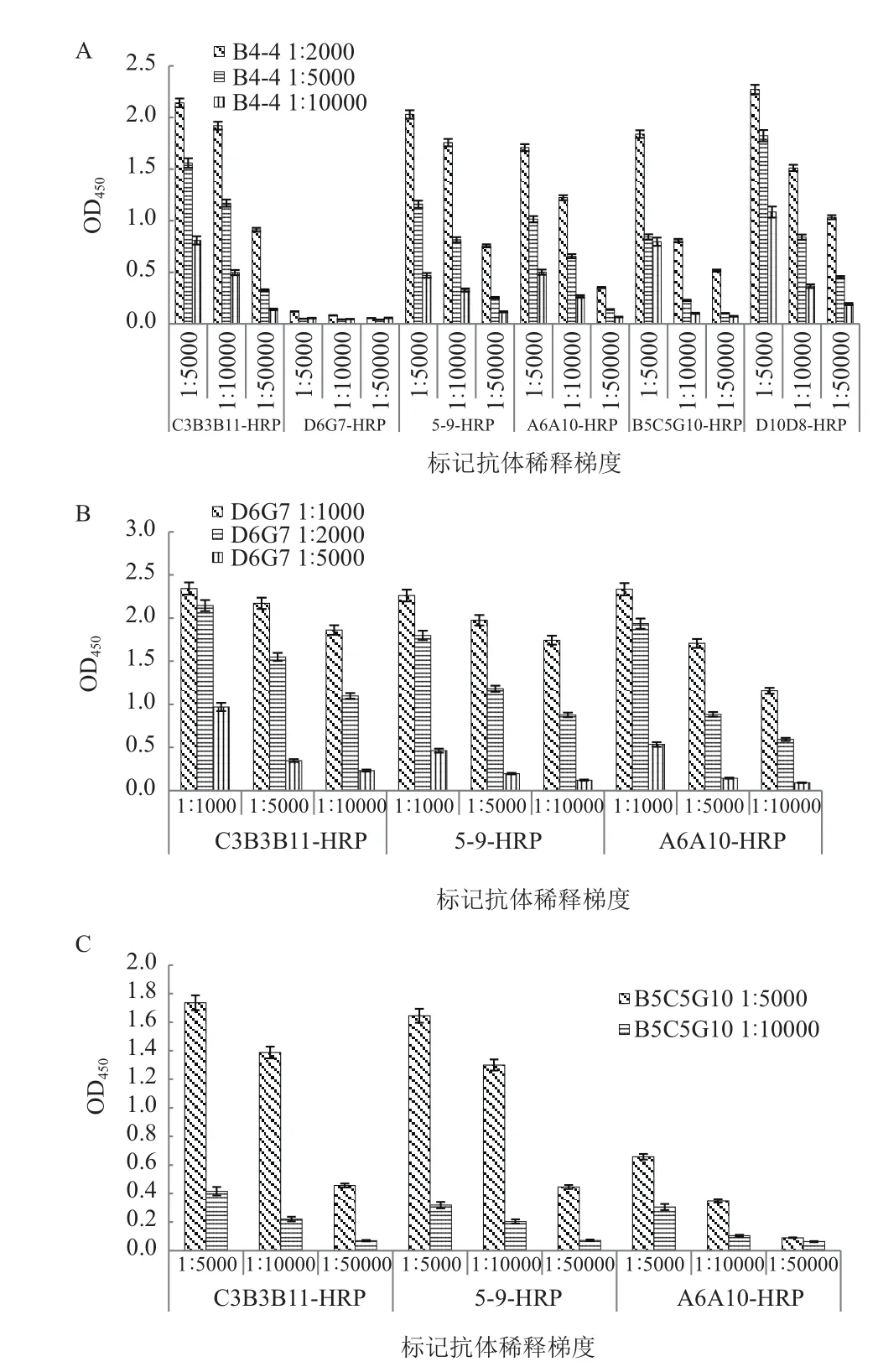
图6 配对抗体稀释度判定结果
本研究通过uniport数据库获取MMP-9基因序列,运用生物信息学的方法通过DNAstar-Protean、PBD分析其跨膜区、亲水性、表面可及性、抗原指数[31-32],预测出其抗原表位区。构建原核重组表达载体,经过诱导表达得到符合预期的重组蛋白Δmmp9,并获得能稳定分泌单克隆抗体的7株杂交瘤细胞株,效价均能达到1∶240 000,效价优于abcam公司的MMP-9单克隆抗体(https://www.abcam. cn/mmp9-antibody-5g3-ab119906-references.html#active-tab.)。运用双抗夹心ELISA法将所得7种单抗进行配对抗体筛选,筛选出能与重组蛋白Δmmp9同时结合的配对抗体,下一步研究工作将采用医院临床样本验证优化筛选出的配对抗体。本研究中的Δmmp9抗体可采用双抗夹心法对不同类型样本中MMP-9进行定性或定量检测,为研发MMP-9的临床检测试剂盒奠定了基础。
4 结论
本研究通过生物信息学的方法预测MMP-9的抗原表位区,构建原核表达载体,并在大肠杆菌BL21(DE3)中实现高效表达。通过纯化其重组蛋白,免疫动物、单克隆筛选获得7株稳定分泌单抗的杂交瘤细胞株,检测其单抗效价均达到1∶240 000。通过抗体配对实验,得到3种捕获抗体及其对应的标记抗体,且确定了其有效工作浓度。
