预处理对ABO血型不相合肾移植受者免疫功能的影响
2019-07-26王显丁刘金鹏李亚梅徐子林吕远航宋涂润蒋亚梅黄春妍
王显丁 刘金鹏 李亚梅 徐子林 吕远航 宋涂润 蒋亚梅 范 钰 黄春妍 王 莉 林 涛
肾移植是终末期肾病(ESRD)的最佳治疗方式[1]。目前,短缺的供肾远远无法满足ESRD患者对肾移植的需求。为了扩大供肾来源,国内外已经探索出固定的预处理方案,使ABO血型不相合(ABOi)活体肾移植成为现实[2-5]。
T细胞、B细胞、细胞因子、免疫球蛋白和补体在移植肾排斥反应及感染过程中发挥重要作用,是肾移植受者免疫状态的重要评估指标[6-9]。但ABOi肾移植对外周血淋巴细胞及细胞因子的影响仍不清楚。因此,我们进行了一项前瞻性队列研究,通过比较ABO血型相合(ABOc)和ABOi肾移植受者外周血淋巴细胞、细胞因子及免疫球蛋白的变化,探究ABOi肾移植及其预处理对受者免疫状态的影响。
对象和方法
研究人群 选取2014-09-12~2018-11-11华西医院泌尿外科采用基于受者初始血型抗体效价的个体化预处理方案,已成功开展ABOi肾移植55例,并取得良好的临床结果。纳入2018年3月至2018年9月在华西医院接受ABOi活体肾移植的9例受者及同时期ABOc受者18例。所有供受者均成年,其关系为直系亲属或配偶,所有供肾者系自愿、无偿将其一侧肾脏捐献给受者,并经四川大学华西医院伦理委员会和四川省卫生健康委员会审批同意。
研究方案 本研究将纳入人群分为两组:ABOi组(n=9例)及ABOc组(n=18例),检测受者预处理前后、移植前后T细胞和B细胞计数、细胞因子、免疫球蛋白和补体的水平,比较两组受者免疫状态的变化差异,评估ABOi肾移植及其预处理对受者短期免疫状态的影响。
个体化预处理及免疫抑制方案 对于初始血型抗体(IgG和IgM)效价≤1∶8的受者,在移植前仅口服免疫抑制剂进行预处理;初始血型抗体效价等于1∶16的受者,采用口服免疫抑制剂+血浆置换/双重血浆滤过;对于初始血型抗体效价≥1∶32的受者,采用口服免疫抑制剂+利妥昔单抗+血浆置换/血浆双重滤过,以保证移植当天血型抗体效价≤1 ∶8~16[10-12]。
ABOi受者在移植前2~4周开始口服他克莫司(Tac)+吗替麦考酚酯(MMF)/吗替麦考酚钠(ECMPS)+泼尼松。Tac初始剂量为3 mg/d,MMF初始剂量为2 000 mg/d(EC-MPS为1 440 mg/d),泼尼松为5 mg/d,根据Tac及霉酚酸的血药浓度调整剂量。根据受者免疫风险选择不同的免疫诱导药物。移植当天停用Tac和泼尼松,术中静脉注射甲泼尼龙500 mg,术后1~3d静脉注射甲泼尼龙200 mg/d,术后第4天改用口服泼尼松60 mg/d,逐渐减量,维持剂量为0~10 mg/d。术后第2天重新开始口服Tac,Tac谷浓度维持在 5~10 μg/L,霉酚酸药时曲线下面积维持在30~60(mg·h)/L。
ABOc受者移植前一天晚上开始口服MMF/ECMPS,MMF初始剂量为 2 000 mg/d(EC-MPS为1 440 mg/d),术中静脉注射甲泼尼龙500 mg,术后1~3天静脉注射甲泼尼龙200 mg/d,术后第4天改用口服泼尼松60 mg/d,逐渐减量,维持剂量为0~10 mg/d,术后第二天开始口服Tac,Tac初始剂量为3 mg/d,Tac和霉酚酸维持浓度同ABOi受者。所有受者在移植前均无供者特异性HLA抗体。
预防感染方案:所有受者手术当天至术后1周静脉给予二代头孢预防细菌感染,术后2周左右受者开始口服磺胺预防肺孢子菌感染,预防用药9个月;有条件的患者可以口服缬更昔洛韦预防病毒感染。
检测指标 ABOi组中,对于未使用利妥昔单抗的受者在预处理前,手术当天,术后1周,术后2周,术后1月检测血型抗体效价、T细胞绝对计数(CD3+、CD4+、CD8+)、B 细胞绝对计数 (CD19+CD5+)、细胞因子[白细胞介素2(IL-2)受体、IL-6、IL-8、肿瘤坏死因子 α(TNF-α)]、免疫球蛋白(IgG、IgA、IgM、IgE、IgG4)和补体(C3、C4、备解素因子 B)水平;使用利妥昔单抗的患者在用利妥昔单抗前、使用后1周,移植当天,术后1周,术后2周,术后1月检测上述指标。ABOc组受者在术前,术后1周,术后2周,术后1月检测上述指标。检测受者移植后3天、1周、2周、1月血清肌酐(SCr)水平和估算肾小球滤过率(eGFR);排斥反应和感染的发生率。受者eGFR采用MDRD公式计算。
检测方法 T细胞、B细胞绝对值计数和T细胞亚群的检测:检测样本来自肾移植受者不同时点的肝素抗凝外周全血。严格按照四川大学华西医院实验医学科的标准化操作流程进行检测,采用流式细胞术(美国BD公司,FACSCanto II流式细胞仪)的方法检测T、B细胞绝对计数,CD19+CD5+B细胞百分比和CD3+、CD4+、CD8+T细胞亚群百分比。使用的流式抗体主要有:美国BD公司CD3-PerCP,CD4-FITC,CD8-APC-Cy7。于流式上样管中分别加入 CD3 3 μl、CD4 3 μl,CD8 3 μl,抗体和肝素 50 μl抗凝全血,充分混匀后于4℃避光环境中孵育30 min,加入 2ml溶血剂(NH4CL,0.15 mol/L),充分混匀后室温静置溶血10 min,PBS洗涤并重悬细胞后上机检测。细胞因子IL-2受体,IL-8,TNF-α的检测采用化学发光免疫分析仪及其配套试剂(德国西门子公司,IMMULITE 1000);IL-6的检测采用电化学发光分析仪及其配套试剂(Roche,e601)。速率散色比浊法检测血清免疫球蛋白IgG,IgA,IgM,IgE和C3,C4,备解素因子B的水平(Beckman-counlter公司,IMMAGE 800全自动免疫浊度分析仪);免疫球蛋白IgG4采用定时散色比浊的方法(德国西门子公司,BN II)。
统计学分析 采用《SPSS 22.0(IBM,USA)》统计软件,连续性变量用均数±标准差表示,分类变量用绝对或相对率描述。连续变量间的比较采用独立样本Student's t检验,分类变量的比较采用卡方检验。P<0.05为差异有统计学意义。
结 果
两组患者基线资料 两组受者及其供者的基线特征均无差异(P<0.05,表1)。受者中位随访时间127d(31~227d)。
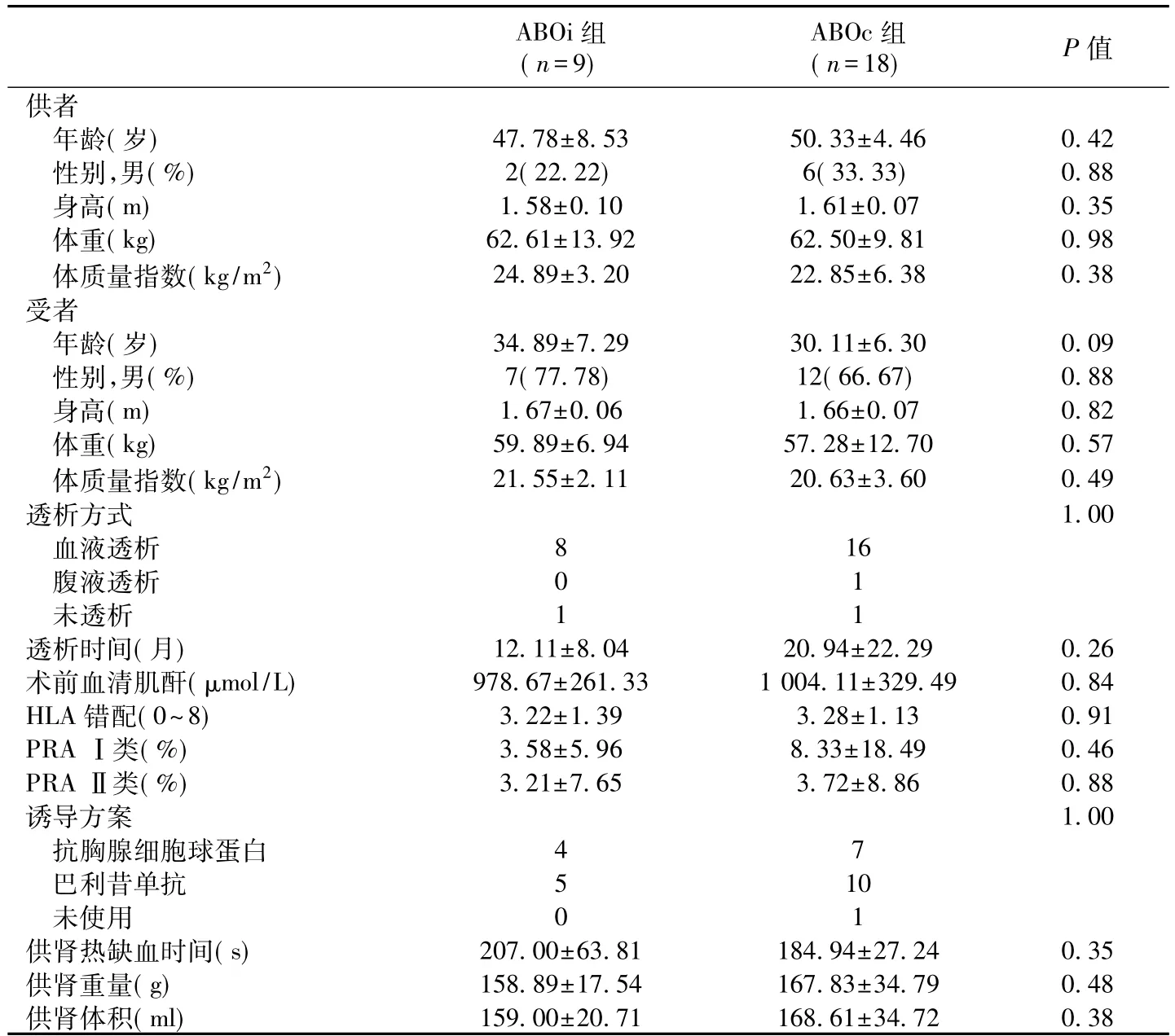
表1 两组供受者基线资料
ABOi组受者个体化预处理方案及血型抗体效价变化 ABOi组9例受者均在术前1月开始口服免疫抑制剂,3例受者接受利妥昔单抗200 mg+1次双重血浆滤过,2例受者接受利妥昔单抗200 mg+2次双重血浆滤过,2例受者接受利妥昔单抗300 mg+2次双重血浆滤过,1例受者接受利妥昔单抗300 mg+4次双重血浆滤过,1例受者接受利妥昔单抗200 mg+1次血浆置换+2次双重血浆滤过。所有受者移植当天血型抗体效价≤1∶16,所有受者移植后2周内密切监测血型抗体效价,术后2周内血型抗体效价反弹均不超过1∶16。受者血型抗体水平变化如图1所示。
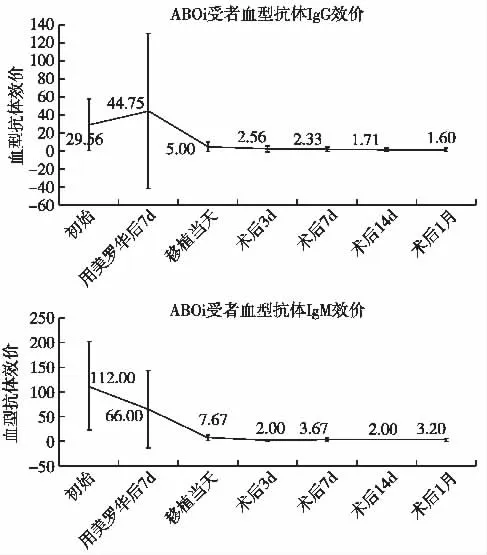
图1 ABO血型不相合(ABOi)组受者血型抗体效价IgG和IgM变化(平均值
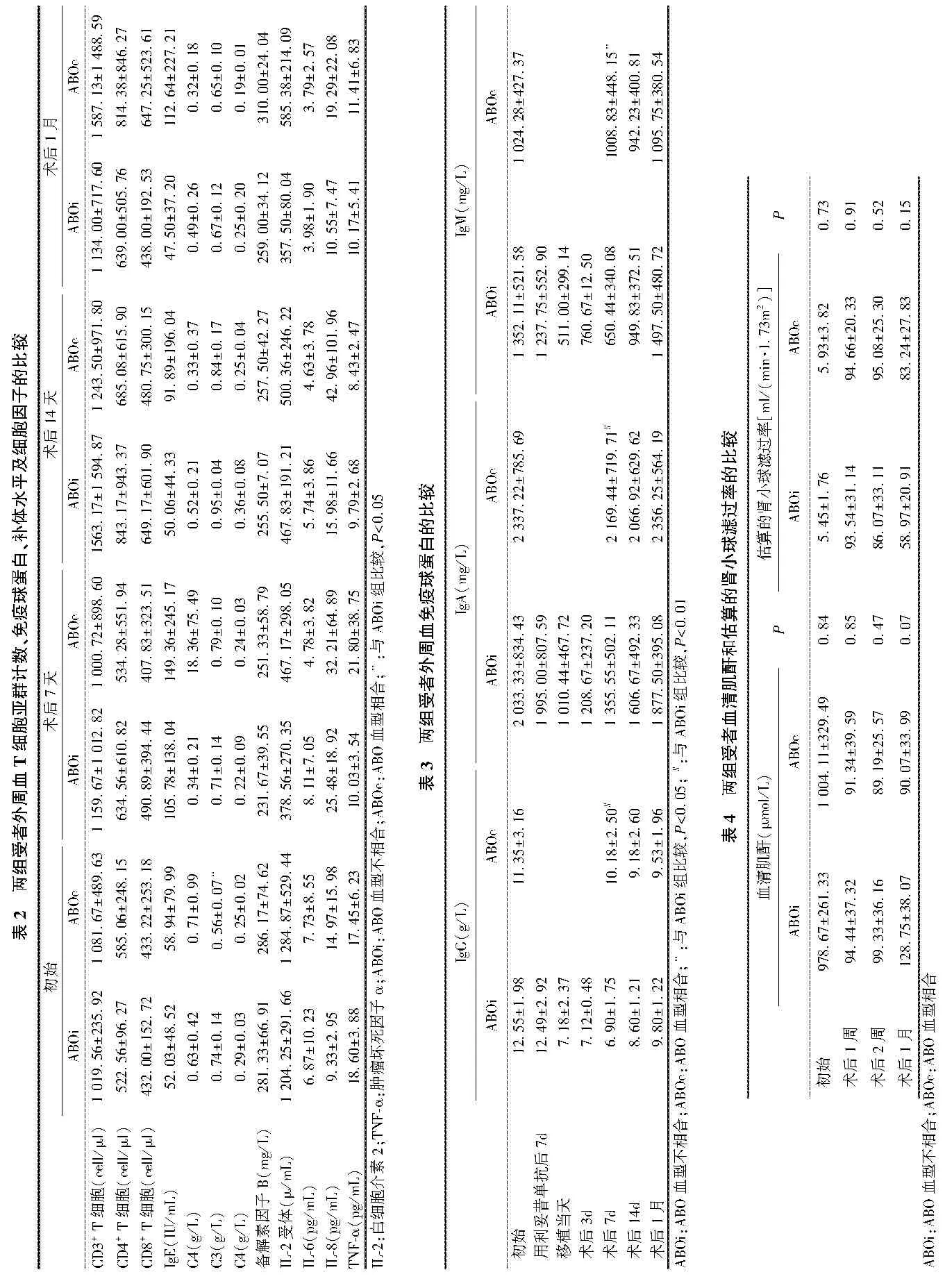
两组受者外周血T细胞、B细胞、细胞因子、免疫球蛋白和补体水平的比较 ABOi组受者外周血初始C3水平显著高于ABOc组(0.74±0.14 g/L vs 0.56±0.07 g/L,P=0.03),两组受者初始 T 细胞亚群计数、B细胞计数、细胞因子、免疫球蛋白、C4和备解素因子B水平均没有显著差异(P>0.05);ABOi组受者在术后7d、14d及1个月时外周血B细胞计数均显著低于ABOc组受者(2.56±2.40 cell/μl vs 342.06±216.59 cell/μl,P < 0.001;11.67±19.02 cell/μl vs 273.42±221.07 cell/μl,P=0.002;1.50±1.73 cell/μl vs 363.75±385.82 cell/μl,P=0.03);ABOi组受者术后7天IgG、IgA及IgM水平显著低于 ABOc组(6.90±1.75 g/L vs 10.18±2.50 g/L,P=0.002;1 355.55±502.11 mg/L vs 2 169.44±719.71 mg/L,P=0.006;650.44±340.08 mg/L vs 1 008.83±448.15 mg/L,P=0.04);其余各项指标均没有统计学差异(表2)。
ABOi组受者B细胞计数在使用利妥昔单抗7d后明显降低,并维持至术后1月,而ABOc组受者则一直趋向平稳(图2)。ABOc组受者外周血IgG、IgA及IgM水平在移植前后并未发生显著改变,而ABOi组受者IgG、IgA及IgM在预处理后至移植当天显著下降,直至术后1月恢复至初始水平(表3)。
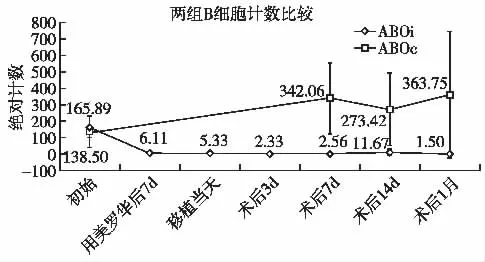
图2 两组受者B细胞绝对计数变化趋势
两组受者短期移植效果 两组受者短期肾功能如表4所示,两组并没有差异(P>0.05)。随访期间没有患者死亡,没有发生移植肾丢失、排斥反应及感染。
讨 论
本研究通过比较ABOi和ABOc肾移植受者外周血T细胞和B细胞计数、细胞因子、免疫球蛋白和补体水平,发现ABOi受者经过血型不合预处理后外周血B细胞计数显著持续减少,IgG、IgA及IgM水平短暂下降后恢复至ABOc受者水平,血型不相合并不影响肾移植受者外周血T细胞、细胞因子及补体水平,两组受者短期肾功能、存活率、排斥、感染发生率均没有显著差异。
淋巴细胞和细胞因子在肾移植免疫反应中发挥关键作用。CD3是T细胞表面标志物,能够转导T细胞活化信号,CD3+T细胞间接表示T淋巴细胞总数。T细胞经抗原信号刺激后活化为CD4+和CD8+T细胞,CD4+T细胞具有识别外来抗原、放大免疫反应、协同活化CD8+T细胞和B细胞的功能,CD8+T细胞则有细胞杀伤作用[13-14]。B 细胞在抗原刺激下活化为浆细胞,继而产生免疫球蛋白,包括血型抗体,其与抗原形成抗原-抗体复合物,沉积于移植肾小管和内皮表面,是体液免疫反应的终末部分[8,15]。细胞因子和补体参与免疫和炎症反应,是急性感染和机体免疫反应的重要组成[9,16]。
?
本研究中ABOi受者均接受利妥昔单抗和双重血浆滤过。利妥昔单抗使受者外周血B细胞快速减少,并可较长时间维持B细胞的低水平状态。血浆置换和双重血浆滤过清除受者血浆中血型抗体的同时,也一定程度上清除血浆中免疫球蛋白,引起外周血免疫球蛋白减少,但移植术后不再进行血浆置换和双重血浆滤过后,受者血浆中免疫球蛋白将再次升高至正常水平。在本研究中ABOi肾移植并没有改变受者的外周血T细胞、各种细胞因子及补体水平,未对受者短期免疫状态产生显著影响,与免疫状态密切相关的排斥反应的发生并无变化。B细胞可作为抗原呈递细胞,是T细胞活化的重要组成部分,清除B细胞后,ABOi受者体内体液免疫和细胞免疫反应均受损,但经过有效地抗感染预防,两组受者短期内均未发生感染事件。ABOi肾移植并不会增加排斥反应和感染的短期发生率。
这是我国第一个评估ABOi肾移植受者免疫状态的研究,填补了我国ABOi肾移植相关研究空白。完善ABOi受者免疫状态的评估,为更多的ABOi受者预后提供进一步保障,也为及时发现、诊断和治疗排斥反应及感染奠定坚实的基础。在我们的研究中,ABOi与ABOc受者免疫状态相近,使开展ABOi肾移植更具说服力。
本研究缺点是随访时间过短,样本量较小,在本研究期间尚未出现排斥反应和感染事件,我们的研究更多的是反映ABOi肾移植受者免疫指标变化的趋势,但这种变化趋势和排斥反应及感染之间的联系,还需要进一步扩大样本量,延长随访时间才能明确。
通过对外周血淋巴细胞和细胞因子的研究,我们发现ABOi肾移植受者外周血B细胞显著减少,IgG、IgA及IgM水平短暂下降,但T细胞、细胞因子及补体水平并不受影响,经过有效抗感染预防,ABOi肾移植未增加短期内排斥反应和感染的发生。
