孤立肾的研究现状
2019-07-26周伟欣张文君景梦怡综述王俭勤审校
周伟欣 张文君 景梦怡 综述 王俭勤 审校
由于先天或后天获得性因素导致一侧肾缺失,对侧肾称为孤立肾(solitary kidney,SK)。先天性孤立肾(congenital solitary kidney,CSK)是先天性肾脏及尿路发育畸形(congenital anomalies of the kidney and urinary tract,CAKUT)常见的表型之一,也是儿童终末期肾病(ESRD)的主要原因,患病率约0.5‰~2‰,左肾缺失的发病率较高,同年龄段的男性患病率高于女性[1-3]。获得性孤立肾(acquired solitary kidney,ASK)多由于后天原因造成的一侧肾脏切除所致。
因肾脏具有强大的代偿能力,孤立肾早期阶段常无明显的临床表现,肾功能多数在正常范围,部分患者和医师会忽视对孤立肾功能的监测和保护。近年来研究发现,CSK患儿出现高血压、蛋白尿或肾小球滤过率(GFR)降低等肾脏损害的比率不断上升,甚至部分患者可进展至ESRD[4]。为提高患者及医师对残余肾功能的重视、保护及长期随访,本文将对孤立肾的病因及其伴随疾病、临床结局、相关危险因素、残肾患者随访及保护等方面进行总结。
孤立肾的病因
先天性孤立肾 肾脏的正常发育过程是以输尿管芽(uretericbud,UB)与肾间充质组织(metanephric mesenchyme,MM)之间的相互诱导为中心环节,前肾-中肾序列启动及UB形成障碍,UB及MM之间的相互诱导作用发生缺陷,可导致肾、输尿管缺失[5]。泌尿、生殖系统在胚胎发育上具有同源性,故CSK常伴随生殖系统发育畸形,女性生殖系统畸形主要为Muller管畸形,常见类型包括单角子宫和双角子宫、双阴道和双子宫等[6]。男性主要表现为Wolff管畸形所致的精囊、输精管和附睾的缺失或闭锁等[7]。CSK可伴发肾外系统畸形,包括心血管、耳鼻喉、胃肠道、神经系统等。在一部分综合征及其伴随的染色体异常(如Zinner综合征、45X染色体嵌合体异常等)所致的畸形中也可出现单肾缺失[1,3,8]。
在肾脏发育过程中,导致单肾缺失的致病基因和环境因素被越来越多的研究证实,如HNF1B、PAX2、Wnt家族、Wt1 和 DSTYK 等基因发生突变[9-12],其中Wt1在前肾、中肾及未诱导分化的MM中即开始表达,提供MM对UB信号发生增殖反应的分子基础,维持MM细胞增生、肾小球足细胞发育及其功能;PAX2在肾源间质中短暂表达,诱导后肾间质间充质转化为肾源性上皮,是MM被诱导并开始分化的最重要早期标志之一;HNF1B为后肾发育的转录因子之一,主要控制肾脏与其他器官的空间位置及肾小管形成。环境因素主要为孕产妇疾病、胎儿宫内发育迟缓、妊娠早期服用激素类、氨基糖苷类抗生素(如庆大霉素)、非甾体类抗炎药(如吲哚美辛、布洛芬)、免疫抑制剂(如硫唑嘌呤、霉酚酸酯)、血管紧张素受体抑制剂、降尿酸药物(秋水仙碱、别嘌醇)及化疗药物[3,13]均与单肾缺失的发病相关。
获得性孤立肾 ASK是指各种肾脏疾病造成一侧肾脏切除术后所致,包括先天性结构异常[14],如肾盂输尿管连接部梗阻(pelviureteric junction obstruction,PUJO)、膀胱输尿管反流(vesicoureteric reflux,VUR)、巨输尿管症 (megaureter)、重复肾(duplex kidney);肾脏肿瘤,如Wilms'肿瘤、神经母细胞瘤、透明细胞癌、多房囊性肾细胞瘤等;外伤、活体肾脏捐献等。
孤立肾功能损伤的机制
目前多认为孤立肾患者肾损伤的主要病理生理基础为高滤过机制。单肾切除术后,功能性肾单位数量减少,残余肾代偿性血流量增加,肾小球毛细血管压及滤过压增加,短期内可以维持相对正常的肾脏滤过和排泄功能,但持续的自适应超滤失代偿后可导致肾小球损伤,进而进一步加剧高滤过程度,形成恶性循环[15]。而动物模型表明,胎儿期仍处于肾单位形成期,先天性孤立肾患儿功能性肾单位丢失可刺激肾脏发生,导致残余肾脏肾单位数目增至正常单肾的75%左右,并伴有肾脏体积代偿性增大至152%~175%[16-17]。在孤立肾模型研究中发现,孤立肾可刺激肾小球旁器分泌肾素[18],进而激活肾素-血管紧张素-醛固酮系统(RAAS),对于高血压、蛋白尿及肾小球硬化的发生发展有潜在的推动作用。
孤立肾动物模型的病理组织学特征提示残肾均匀代偿,其一般形态及皮质髓质组织大体正常,无明显炎症细胞浸润及纤维化,随病程延长可见皮质增厚,可达1.47倍;肾小球和S形小体数目不断增加,但直径不变,密度降低;肾小管及集合管明显扩张等[18]。
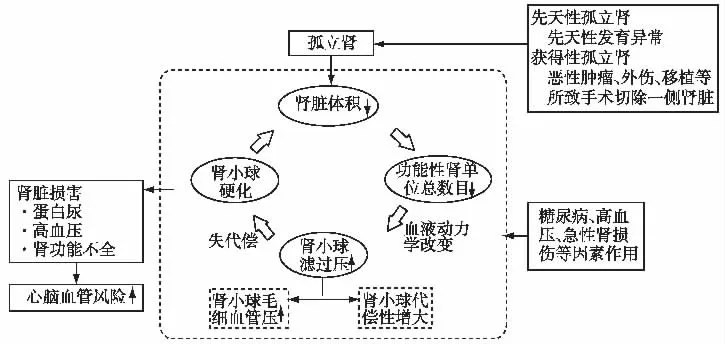
图1 孤立肾肾损害机制图
孤立肾的长期预后
Verma等[19]对594例获得性孤立肾(包括根治性肾切除、单纯性肾切除及供肾者)随访6年后发现,41%、13%、4% 出现蛋白尿,前两者中分别有41.6%、8.69%的患者发展为慢性肾脏病(CKD)3期。目前而言,其长期预后仍是具有争议的话题,本文主要就后天性孤立肾预后情况展开叙述。
肿瘤切除所致孤立肾 现有数据表明,我国肾细胞癌新增病例约7万例/年,因肾癌死亡2.4万例,临床上公认的肾癌治疗金标准为肾癌根治术(radical nephrectomy,RN)[20]。 多 因 素 分 析 显示[21],RN是肾癌术后发生CKD的独立危险因素[eGFR<60 ml/(min·1.73m2),HR 3.82,95%CI 2.75~5.32;eGFR<45 ml/(min·1.73m2),HR 11.8,95%CI 6.24~22.4)],肾癌患者 RN术后 eGFR下降约24 ml/(min·1.73m2),且研究表明与RN相关的eGFR每下降7 ml/(min·1.73m2),死亡风险约增加17%(95%CI 12%~27%);与其他原因所致孤立肾不同的是,肾癌患者的心血管死亡风险较高,相关数据提示RN相关过度肾单位丢失可导致心血管死亡风险增加25%(95%CI 3%~73%),且存在术后复发及转移的可能。孤立肾患者行部分肾切除术时需更多关注,因残余肾脏的代偿性肥大可致严重出血,甚至出现灾难性事件。
肾移植供者和外伤性孤立肾 相对而言活体供者和外伤性肾切除者均为较单纯的一侧肾脏切除。活体供者的长期安全性是目前器官移植最为关注的问题之一,供者捐肾后失去约50%的肾单位,残肾虽有一定的代偿能力,但可能会出现高滤过损害导致GFR下降,国外大样本研究显示肾脏捐献会增加供者ESRD的发生率,尤其年轻供者。研究进一步表明,以供者生存至80岁计算,估计ESRD终生风险为0.9%,高于健康对照(0.14%);而挪威学者报道活体供者ESRD风险比健康非供者增加11倍(HR 11.38)[22-23]。肾外伤的治疗目标是最大限度的保留肾组织,患者需根据美国创伤外科协会(AAST)标准进行分级,现多认为对于V级肾损伤伴有血流动力学异常、进行性增大的肾周血肿患者需行手术治疗,动物实验表明5/6肾切除模型大鼠在4周和8周时尿蛋白水平显著增加,且发生CKD的风险高[24]。
影响孤立肾长期预后的因素
评估肾损害的危险因素有助于判断孤立肾患者是否存在CKD风险。既往研究表明同侧CAKUT、肾脏体积的减小、低出生体重、早产及泌尿道感染、性激素水平,贫血、高磷血症、身材矮小等临床指标和低生活水平等社会经济因素,均与孤立肾合并CKD有关[25]。下面就孤立肾同侧CAKUT、肾脏体积、体质量指数(BMI)等方面具体展开。
合并同侧CAKUT 研究发现32%的孤立肾患者合并CAKUT,其中最常见的是膀胱输尿管反流(24%),易并发频繁尿路感染而影响肾功能[25]。同侧CAKUT被认为是导致儿童肾脏损伤发展的危险因素,与不伴CAKUT的患者相比,出现肾脏损伤的比例较高,并且肾功能下降较快(分别为12.8和15.9年)[26],合并同侧 CAKUT患者代偿性肾肥大显著,且回归分析发现CAKUT的存在与否是GFR最强的预测因子,其10年生存率明显降低(54%vs 88%)[5,27]。
肾脏体积 肾脏体积大小是eGFR下降的独立危险因素之一。既往研究表明,肾脏长径及横截面积较小的孤立肾患者更易进入 CKD 4~5期。Sharma等[28]对50例肾部分切除术后的患者进行分析,发现术后所保留的肾实质体积与GFR有显著正相关性,研究进一步发现肾长<120 mm的孤立肾患者发展为肾功能不全的风险是正常人的5倍[29]。
BMI 肥胖可增加肾脏的负荷,进而导致肾脏损害,肥胖相关性肾病常伴蛋白尿的出现,病理活检通常表现为肾小球肥大和局灶节段性肾小球硬化。动物肥胖模型显示,脂质沉积会损伤肾脏,在慢性肾衰的发展中起着重要作用[30],在成人孤立肾患者的观察性研究中进一步发现[31],CKD发病率与体重呈正相关,是肾功能进展的危险因素之一。
孤立肾的随访及保护
因孤立肾患者发生蛋白尿、高血压和肾功能不全的风险明显增加,故密切的长期随访及多学科治疗以保持残肾的最佳功能尤为重要。
先天性孤立肾患儿 产前筛查及长期随访可及早发现CSK并对其进行保护以延缓肾脏病的发生,保护措施主要为非药物方案(控制蛋白和钠的摄入以避免加重孤立肾负荷,强烈建议体重管理,限制烟草接触)。终生监测应包括血压、GFR和蛋白尿评估,在没有危险因素的情况下,建议5年进行1次评估,合并危险因素者频率可适当增加[19]。
肾癌切除术后患者 目前认为肾癌所致的SK患者应积极、个体化随访监测,慎重等待观察。术前严格评估手术风险,制定最佳手术方案,最大程度保留健存肾单位。术后监测血清肌酐及尿蛋白、血压、血糖、血脂、尿酸等指标,必要时完善肾组织穿刺活检术,明确组织病理学并预测预后、有无合并CKD及其分期及进展、指导临床诊治;对高龄、伴合并症、术前肾功能不全、肿瘤的原发灶-淋巴结-远处转移(TNM)分期高的患者应加强随访,每3~6月复查CT或超声检查,研究表明术后前3年,转移性疾病进展的风险<2%,若无转移可延迟干预,预期管理的监测间隔可增加至6~12个月复查US,随疾病进展调整干预及治疗方法,同时需关注肿瘤转移的情况,必要时应联合多学科专家会诊综合管理[32-33]。孤立肾合并肿瘤患者行部分肾切除术CKD风险更高,需在积极手术和安全保守之间取得平衡,强调远期生存率。
肾移植供者及外伤肾切除患者 建议术前评估分肾功能等各项指标。随访通常在术后6个月、12个月、24个月进行,随访指标包括血压、BMI、血清肌酐、蛋白尿、健康生活方式的管理、心理健康和身体健康的评估和指导、捐献对供者的社会经济学状态的长期影响等。肾损伤远期随访目的是评估肾脏功能、有无并发症等,暂无明确的随诊内容及随诊时限,但个体化的影像学及肾功能测定是必要的。监测肾功能达到CKD诊断标准的供者,应依据2012年 KDIGO-CKD 指南进行管理[22,34-35]。

图2 孤立肾患者的随访及残肾保护策略
综上所述,孤立肾患者可出现蛋白尿、高血压等表现,甚至逐渐进展至ESRD需肾脏替代治疗维持生命,目前其生理病理机制、相关危险因素及远期预后尚未完全阐明,需进一步探索机制并研究其影响其预后的相关因素。应提高对残肾保护的认识,制定合适的手术方案并改善手术相关因素,术后定期随访,及时干预相关危险因素,严格避免肾毒性药物的使用,以最大程度的保护残肾功能,改善患者长期预后。
