土壤主要理化性质对湘粤污染农田镉稳定效果的影响①
2019-07-26吴龙华王文艳
崔 旭,吴龙华,王文艳
土壤主要理化性质对湘粤污染农田镉稳定效果的影响①
崔 旭1,2,3,吴龙华1,2*,王文艳1
(1中国科学院土壤环境与污染修复重点实验室(南京土壤研究所),南京 210008;2中国科学院大学,北京 100049;3山西农业大学资源环境学院,山西太谷 030801)
利用盆栽试验研究了稳定剂(石灰、海泡石联合施用)对湖南、广东两省区不同性质土壤上生长的小青菜(L.)生物量、重金属吸收以及土壤pH和重金属提取态含量的影响,探讨了影响镉(Cd)稳定修复效果的土壤性质参数。结果表明:施加稳定剂对增加酸性土壤上小青菜生物量效果显著,土壤pH、有机质(OM)、全量Cd和黏粒是影响小青菜生物量变化的主要因素;土壤pH、阳离子交换量(CEC)、OM、黏粒是影响小青菜Cd含量变化的主要因素;土壤pH、CEC、全量Cd和黏粒是影响土壤提取态Cd含量变化的主要因素。
稳定修复;重金属;土壤性质;小青菜
近年来,我国农田土壤重金属污染形势日趋严重。据2014年4月17日环境保护部和国土资源部联合发布的《全国土壤污染状况调查公报》报道,我国土壤污染物总的点超标率为16.1%,无机污染物超标点位占全部超标点位的82.8%,其中主要污染物为镉(Cd)、汞(Hg)、砷(As)、铅(Pb)、铜(Cu)等重金属污染物[1]。Cd等重金属污染物在土壤中移动性差、滞留时间长,不能被降解且容易被植物吸收,通过食物链进入人体,从而危害人体健康[2-3]。因此,对Cd污染农田土壤进行治理修复已成为急需解决的问题,并引起了土壤学和环境科学领域工作者广泛的关注。
在众多治理土壤重金属污染的修复技术中,稳定修复由于其简单、快速和廉价等优点,能够满足中轻度重金属污染土壤修复治理的需求[4-6]。该技术的关键在于选择合适的稳定剂,常用的稳定剂种类包括碱性材料、含磷材料、黏土矿物、铁锰氧化物以及有机物料等[7]。其中,黏土矿物海泡石和碱性材料石灰是近年来研究和应用较多的稳定修复材料。海泡石(Mg4Si6O15(OH)2×6H2O)是一种具有链式层状结构的纤维状富镁硅酸盐黏土矿物,具有巨大的表面吸附和离子交换能力,对Cd污染土壤具有良好的稳定修复效果[8-10]。施用石灰主要是通过提高土壤pH,从而促进土壤胶体表面对重金属离子的吸附作用以及重金属形成氢氧化物或碳酸盐结合态等盐类沉淀[11]。研究表明,海泡石和石灰的联合施用可以提高修复效果,减少土壤中有效态重金属,降低作物对Cd的吸收[12-15]。现有的报道侧重于对一种或几种土壤类型的研究,对一定区域内大量不同类型土壤上稳定剂施用效果及影响稳定效果的土壤理化性质的系统研究则鲜有报道。
本研究选取我国Cd污染较为严重的南方湖南、广东地区,采集两省Cd中低污染农田土壤,添加相同水平稳定剂,研究其对污染土壤Cd的修复效果,以期探明在不同土壤上Cd的稳定效果及影响因素,揭示稳定剂对土壤重金属的稳定修复规律,探讨Cd的稳定机理,为农田土壤Cd污染的稳定修复提供理论依据。
1 材料与方法
1.1 试验材料
供试土壤采自湖南、广东中轻度Cd污染农田0 ~ 15 cm耕层,自然风干,弃去杂质,过10目尼龙筛备用。供试28个土壤的具体采样地点及基本性质见表1。海泡石购买于河北石家庄,基本性质为:pH 8.75,矿物组成(以质量分数计)为方解石48%、海泡石15%、滑石9%、蒙脱石8%、长石6%、蛭石4% 等,研磨过200目筛备用。供试作物为小青菜(L.),品种为上海青,购于南京市场。
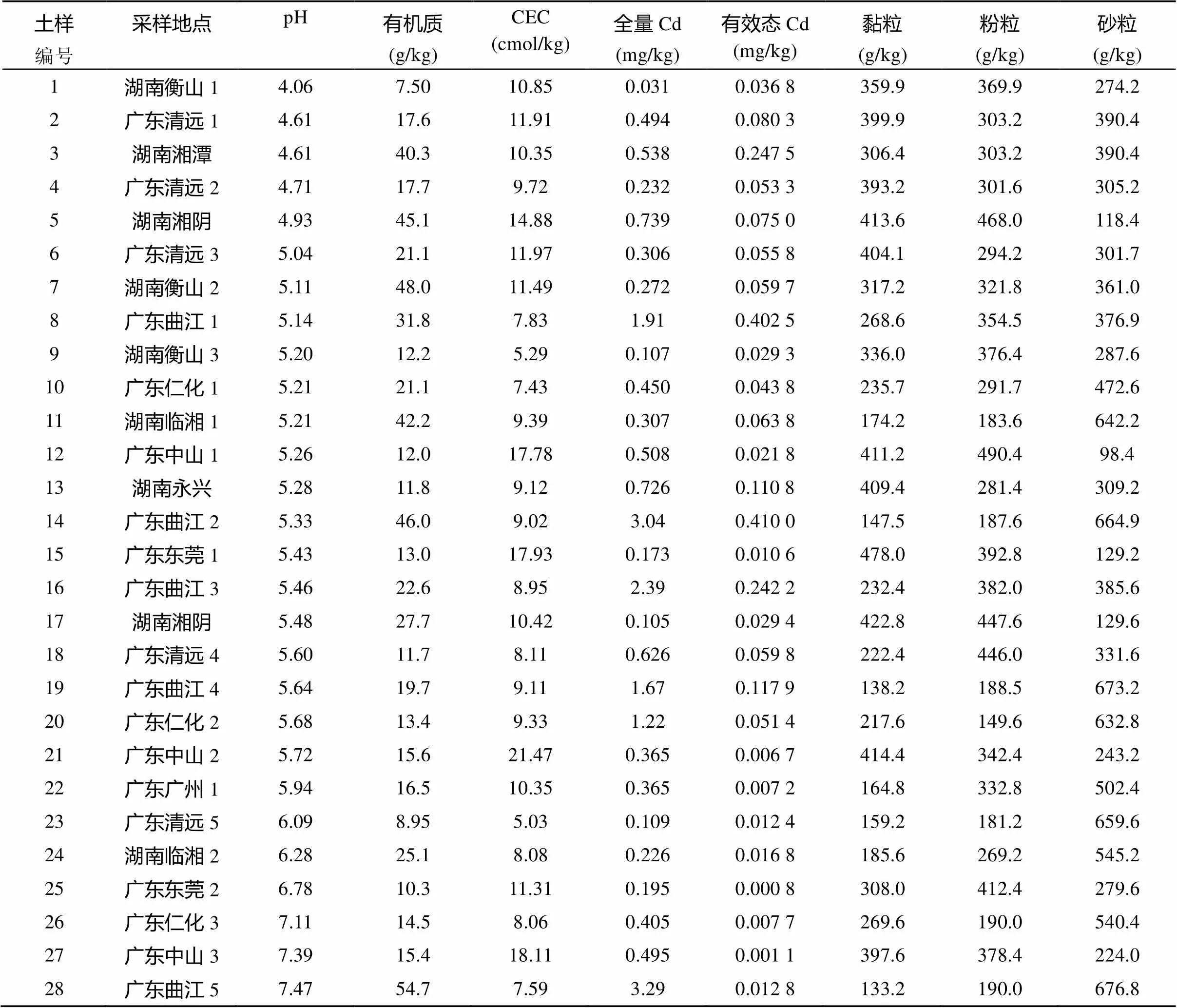
表1 供试土壤基本性质
注:土壤编号按pH升序排列。
1.2 试验方法
采用室外盆栽试验,通过在供试土壤中添加稳定剂来设置稳定修复处理。试验共设两个处理,分别为:①CK(对照:不添加稳定修复材料);②T(添加1 g/kg 石灰+ 20 g/kg海泡石),每处理4次重复。
将稳定修复材料与土壤混匀后装入花盆(上下口内径为13.5、8.5 cm,高10 cm)中,每盆装土1.5 kg,同时施入尿素0.65 g/kg和磷酸氢二钾0.39 g/kg(以风干土壤质量计)作为底肥。平衡10周后,于2015年5月10日播种,在初期出苗阶段进行不定期的间苗,最后每盆保留4株长势相当的幼苗。试验于中国科学院南京土壤研究所温室培养,自然光照。小青菜生长过程中,每日以去离子水浇灌,控制土壤含水量为最大田间持水量的60% 左右。小青菜生长45 d后收获地上部分,同时采集对应的土壤样品。
1.3 样品分析与数据处理
植物样品带回实验室后,称量鲜重,然后用自来水和去离子水洗净,滤纸擦干后放入烘箱105℃杀青30 min,然后在70℃烘干至恒重。使用小型粉碎机粉碎后称取0.500 0 g左右样品,加8 ml HNO3-H2O2(3∶1,)混合液105℃高压消化6 h后赶酸,定容,过滤,待测。
土壤采回后自然风干,磨碎后分别过10目、60目和100目筛,进行pH和提取态重金属、全量重金属的测定。土壤pH用酸度计(上海雷磁仪器,PHS-3B)测定。土壤提取态Cd含量采用0.01 mol/L CaCl2溶液提取(土液比1∶10,振荡2 h,离心,过滤)待测。称取0.200 0 g左右100目土壤样品,加10 ml HCl-HNO3(1∶1,)混合液105℃消化6 h后,赶酸,定容,过滤,待测土壤全量Cd。所有样品溶液中的重金属用原子吸收分光光度计(Varian SpectrAA 220FS火焰,220FZ石墨炉)进行测定。
分析过程所用试剂均为优级纯,试验用水为超纯水。土壤分析过程中加入国家标准物质土壤GBW 07416,植物分析过程加入国家标准参比物质GBW 10015。本试验测定结果均符合质量控制要求。土壤基本理化性质按照土壤农化常规分析方法测定[16]。海泡石的矿物组成采用X射线衍射(XRD)法测定。
试验数据采用Excel 2010与SPSS 16.0进行处理和分析。
2 结果与分析
2.1 添加稳定剂对小青菜生长和地上部镉含量的影响
不同土壤中添加稳定剂对小青菜地上部干物质量及重金属含量的影响见图1和图2。由图1可见,不同性质土壤添加相同量稳定剂对小青菜地上部干物质量影响不同。与不添加修复剂的对照相比,28个土壤中有11个土壤上添加稳定剂处理能够显著提高小青菜生物量(<0.05),其中在3、4号土壤上增加量最大,增幅分别达到546%、562%;在4个土壤(1、2、9、24号)的对照处理中不能生长小青菜,添加稳定剂处理中能够生长小青菜;在13个土壤上,添加稳定剂处理小青菜生物量增加不显著。总体来看,在酸性土壤中添加稳定剂的效果优于中性土壤。
由图2可见,施加相同量稳定剂,小青菜体内Cd含量在不同性质土壤中表现出一定的差异性。与对照相比,在12个土壤中施加稳定剂后可以显著降低小青菜地上部Cd含量(<0.05),且12个土壤中降低不显著。总体来看,相同稳定剂处理对酸性土壤中小青菜Cd含量的降低效果优于中性土壤。

图1 施加稳定剂后对小青菜生物量的影响
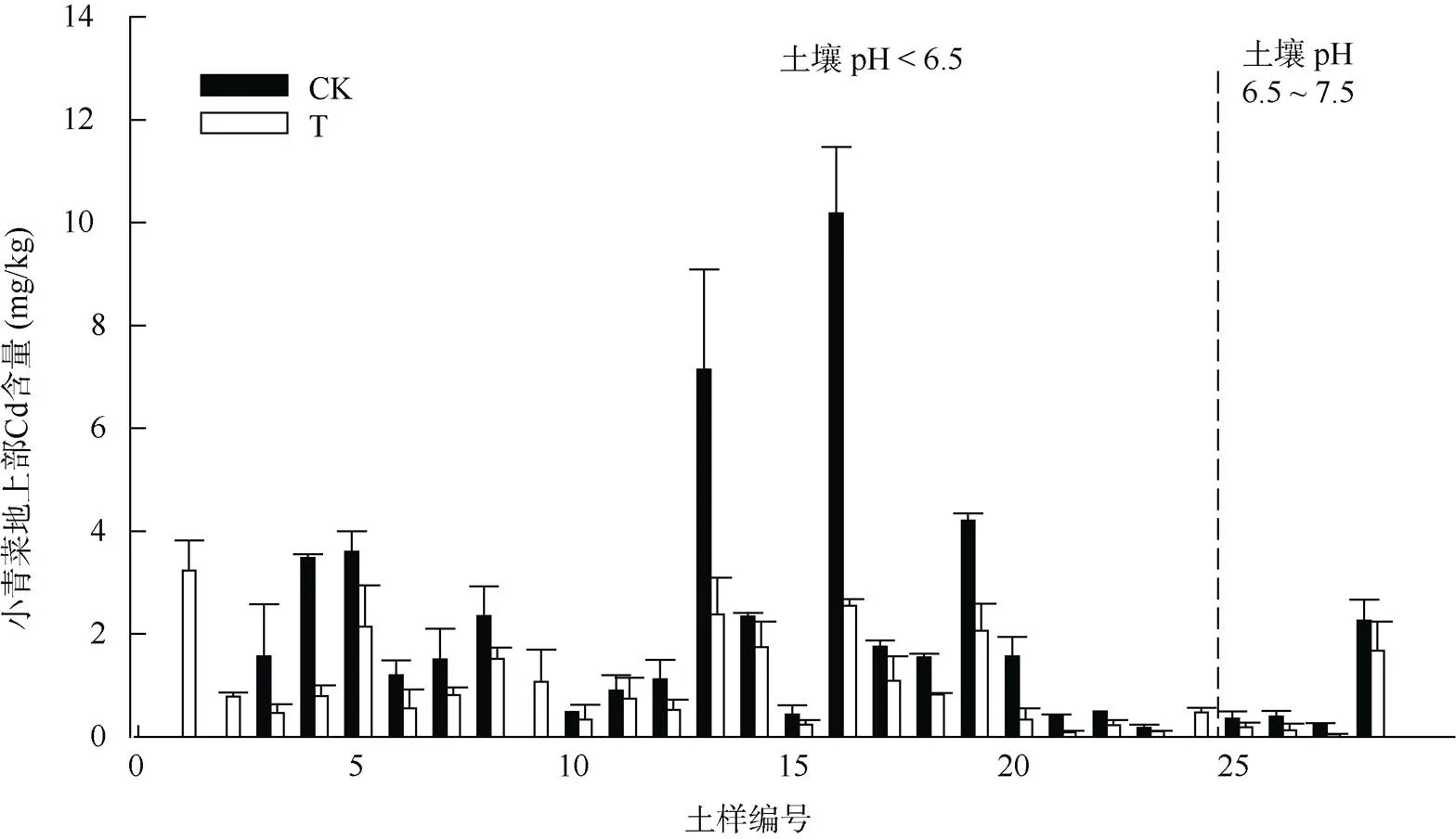
图2 施用稳定剂后小青菜Cd含量的变化
2.2 添加稳定剂对土壤pH和提取态镉含量的影响
图3为小青菜收获后,不同土壤的pH变化。从图3可以看出,相比中性土壤,在酸性土壤中添加稳定剂更能显著提高土壤pH,随着对照土壤pH的升高,土壤pH升高幅度逐渐变小。
图4显示了施加稳定剂对不同性质土壤提取态Cd含量的影响。结果表明,施加稳定剂后23个土壤提取态Cd含量显著降低(<0.05)。施加稳定剂在不同Cd含量的土壤中表现出一定的差异性:高污染土壤提取态Cd含量降低显著,低污染土壤提取态Cd含量降低不显著。

图3 施加稳定剂后土壤pH变化
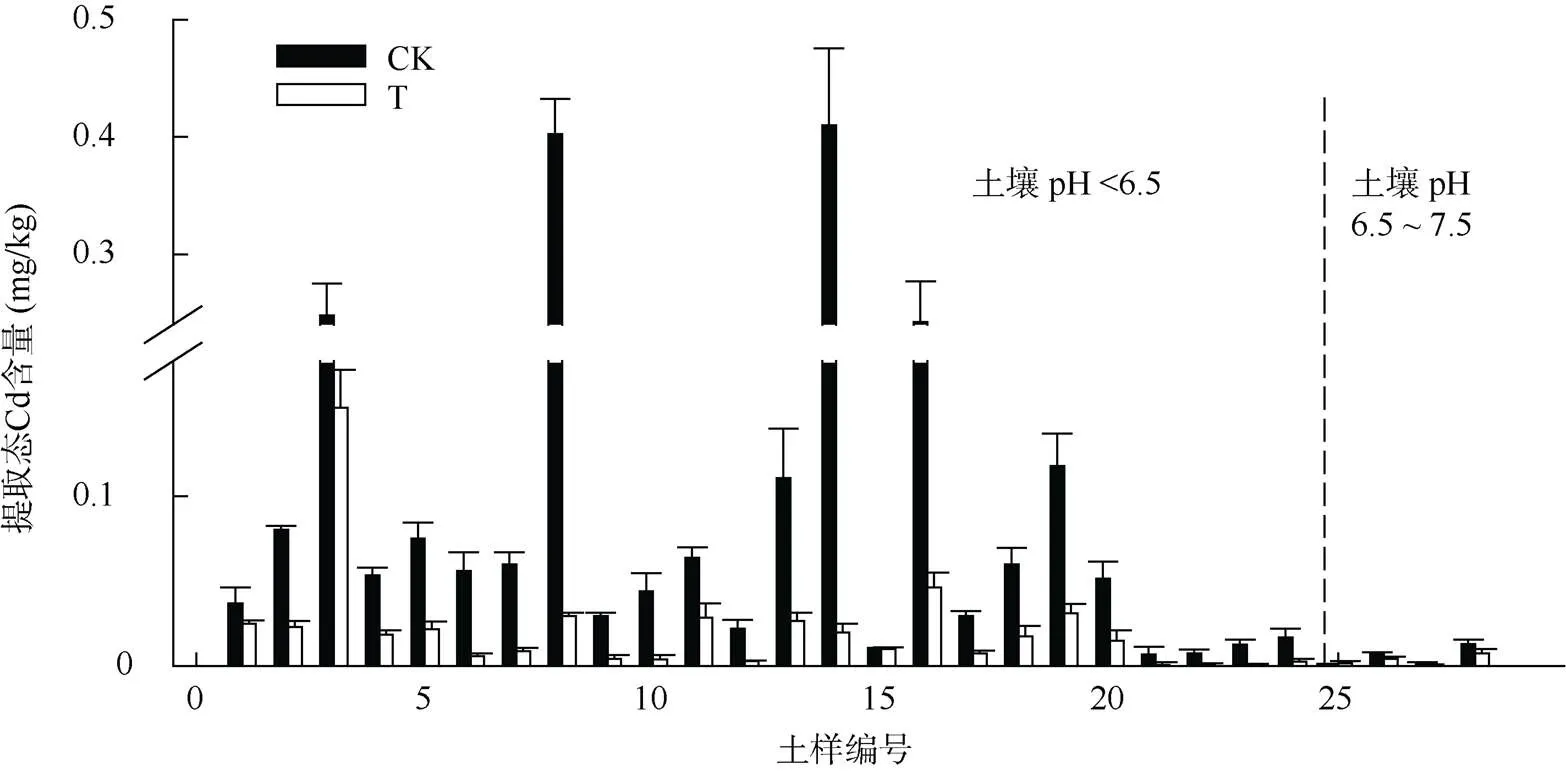
图4 施加稳定剂对土壤氯化钙提取态Cd含量的影响
2.3 小青菜相对生物量、相对镉含量、土壤相对提取态镉含量与土壤理化性质的关系
稳定剂的加入显著影响了土壤pH、提取态Cd含量、小青菜生物量和体内Cd含量,将添加稳定剂处理各测定值与对照测定值比值作为响应值[17],即相对值,对各相对值与土壤理化性质(除土壤pH以外,其他数据均取以10为底的对数)做相关分析,结果如表2所示。由表2可见,施加相同量稳定剂后,不同土壤中小青菜相对生物量与土壤初始pH、有机质(OM)、全量Cd、黏粒含量呈显著相关关系,相关系数分别为–0.633、0.215、–0.271和0.318;小青菜地上部相对Cd含量与土壤初始pH、CEC、OM和黏粒含量呈现显著相关关系,相关系数分别为–0.195、–0.277、0.307和 –0.235;土壤中相对提取态Cd含量与土壤初始pH、CEC、全量Cd和黏粒含量呈显著相关关系,相关系数分别为0.206、0.256、–0.195和0.210。

表2 土壤基本性质与小青菜相对生物量、相对镉含量、土壤相对提取态Cd含量之间的相关系数
注:*、**和***分别代表在<0.05、<0.01和<0.001水平显著相关。
3 讨论
土壤性质影响着稳定剂的重金属修复效果,其中土壤pH的变化和稳定剂的修复效果密切相关。随着土壤pH的升高,土壤胶体和黏粒吸附重金属离子的能力增强,同时增加了土壤表面的可变负电荷,有利于重金属以氢氧化物或碳酸盐的形式沉淀[18-19]。有研究表明,石灰可显著提高土壤pH[20],添加石灰可以增加酸性土壤上作物的生物量[21-23],但对中性碱性土壤上作物生物量影响不大[24],本试验研究结果与之相似,其原因可能是所用的稳定剂为碱性物质,能显著提高酸性土壤pH,而对中性土壤pH提高不明显。土壤pH上升,增加土壤胶体和黏粒表面负电荷,增强其对土壤中Cd离子的吸附能力,从而降低交换态Cd含量及其生物有效性,减少植物的吸收;土壤pH的升高,也使土壤中Cd由活性较高的可提取态向活性较低的有机结合态、铁锰氧化态结合态及残渣态转化,且交换态Cd含量与土壤pH之间存在显著负相关关系[9,25-26],本研究中土壤有效态Cd含量随着pH增加而下降的趋势与这些研究结论一致。
施加稳定剂不仅能提高土壤pH,同时还能增加土壤胶体的阳离子交换量(CEC),这是由于海泡石具有较大的比表面积,能够增加土壤胶体的吸附性能,其层状结构之间含有大量的可交换的阳离子(Ca2+、Mg2+、Si4+)[9, 27]。林大松等[28]的试验研究表明,提高土壤pH,使海泡石表面可变负电荷数增加,促进海泡石与重金属离子的吸附或络合物的形成,减弱重金属离子的有效性。施加稳定剂导致土壤pH升高,使土壤CEC增加,降低了土壤重金属有效性,减少了Cd在小青菜体内的迁移与积累。本试验结果表明,CEC与小青菜相对Cd含量呈显著负相关,而与土壤相对提取态Cd含量呈显著正相关。土壤中CEC越高,其重金属有效性越低,植物的Cd吸收量相应也越小。
土壤有机质对重金属在土壤中的转化也有重要作用。土壤有机质含量是影响土壤重金属有效性重要的因素,对重金属吸收的影响程度与土壤类型、特性和污染物的种类及含量等有关[29]。一般认为,结构简单的小分子有机酸与土壤重金属形成溶解度较高的有机络合物时,会提高土壤重金属的移动性和生物活性;而当大分子有机酸与重金属生成溶解度低的有机螯合物时,重金属被土壤胶体吸附,生物有效性下降[30]。本试验中,有机质与植物相对生物量以及Cd的吸收显著正相关,表明在有机质含量较高的土壤中植物的生物量也比较大,同时也可能造成Cd吸收量的增大。
土壤中污染物含量的高低也是影响稳定修复效率的一个因素,本试验研究显示土壤中Cd含量与小青菜相对生物量和土壤相对提取态Cd含量呈显著负相关,表明较高的污染物含量会降低稳定修复效果。土壤中黏粒含量也是影响稳定修复效率的一个因素,合适的黏粒组分能够使植物正常生长,同时固定重金属元素,减轻重金属对植物的毒害,从而提高植物生物量。
4 结论
石灰和海泡石施用能提高土壤pH,降低土壤中有效态重金属的含量,减少植物体内重金属含量,并对作物有一定增产作用。在酸性土壤中施用的效果要好于中性土壤。
土壤pH、有机质、全量Cd、黏粒是控制小青菜生物量变化的主要因素,土壤pH、CEC、有机质、黏粒是影响小青菜Cd含量变化的主要因素,土壤pH、CEC、全量Cd和黏粒是影响提取态Cd含量变化的主要因素。
[1] 环境保护部和国土资源部.全国土壤污染状况调查公报[Z].2014-4-17.http://www.zhb.gov.cn/gkml/hbb/qt/201404/ W020140417558995804588.pdf
[2] Cai Q Y, Mo C H, Li H Q, et al. Heavy metal contaminations in urban soils and dusts in Guangzhou, South China[J]. Environmental Monitoring and Assessment, 2013, 185(2): 1095–1106
[3] Turgut C, Pepe M K, Cutright T J, et al. The effect of EDTA and citric acid on phytoremediation of Cd, Cr, and Ni from soil using[J]. Environmental Pollution, 2004, 131(1): 147–154
[4] Guo G L, Zhou Q X, Ma L N. Availability and assessment of fixing additives for the in situ remediation of heavy metal contaminated soils[J]. Environmental Monitoring and Assessment, 2006, 116(13): 513–528
[5] 王立群, 罗磊, 马义兵, 等. 重金属污染土壤原位钝化修复研究进展[J]. 应用生态学报, 2009, 20(5): 1214–1222
[6] Jurate K, Anders L, Christian M. Stabilization of As, Cr, Cu, Pb and Zn in soil using amendments-A review[J]. Waste Management, 2008, 28(1): 215–225
[7] 王林, 徐应明, 孙国红, 等. 海泡石和磷酸盐对镉铅污染稻田土壤的钝化修复效应与机理研究[J]. 生态环境学报, 2012, 21(2): 314–320
[8] 杭小帅, 周健民, 王火焰, 等. 粘土矿物修复重金属污染土壤[J]. 环境工程学报, 2007, 1(9): 113–120
[9] 孙约兵, 徐应明. 海泡石对镉污染红壤的钝化修复效应研究[J]. 环境科学学报, 2012, 32(6): 1465–1472
[10] Sun Y B, Sun G H, Xu Y M, et al. Assessment of sepiolite for immobilization of cadmium-contaminated soils[J]. Geoderma, 2013, s193/194(2):149–155
[11] Derome J. Detoxification and amelioration of heavy-metal contaminated forest soils by means of liming and fertilization[J]. Environmental Pollution, 2000, 107(1): 79– 88
[12] 史新. 海泡石对镉污染土壤钝化修复效应研究[D]. 长春: 吉林大学, 2013
[13] 周歆, 周航, 曾敏, 等. 石灰石和海泡石组配对水稻糙米重金属积累的影响[J]. 土壤学报, 2014, 51(3): 555–563
[14] 朱维, 周航, 吴玉俊, 等. 组配改良剂对稻田土壤中镉铅形态及糙米中镉铅累积的影响[J]. 环境科学学报, 2015, 35(11): 3688–3694
[15] 朱奇宏, 黄道友, 刘国胜, 等. 石灰和海泡石对镉污染土壤的修复效应与机理研究[J]. 水土保持学报, 2009, 23(1):111–116
[16] 鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2000
[17] Dayton E A, Basta N T, Payton M E, et al. Evaluating the contribution of soil properties to modifying lead phytoavailability and phytotoxicity[J]. Environmental Toxicology & Chemistry, 2006, 25(25): 719–725
[18] Friesl W, Friedl J, Platzer K, et al. Remediation of contaminated agricultural soils near a former Pb/Zn smelter in Austria: Batch, pot and field experiments[J]. Environmental Pollution, 2006, 144(1): 40–50
[19] Singh B R, Myhr K. Cadmium uptake by barley as affected by Cd sources and pH levels[J]. Geoderma, 1998, 84(1): 185–194
[20] 何飞飞, 曾建兵, 吴爱平, 等. 改良剂修复利用镉污染菜地土壤的田间效应研究[J]. 中国农学通报, 2012, 28(31): 247–251
[21] 张青, 李菊梅, 徐明岗, 等. 改良剂对复合污染红壤中镉锌有效性的影响及机理[J]. 农业环境科学学报, 2006, 25(4): 861–865
[22] 陈晓婷, 王果, 张亭旗, 等. 石灰与泥炭配施对重金属污染土壤上小白菜生长和营养元素吸收的影响[J]. 农业环境科学学报, 2002, 21(5): 453–455
[23] 杜志敏, 郝建设, 周静, 等. 四种改良剂对铜和镉复合污染土壤的田间原位修复研究[J]. 土壤学报, 2012, 49(3): 508–517
[24] 郭利敏, 艾绍英, 唐明灯, 等. 不同改良剂对土壤-叶菜系统Cd迁移累积的调控作用[J]. 农业环境科学学报, 2010, 29(8): 1520–1525
[25] Pardo T, Bernal M P, Clemente R. Efficiency of soil organic and inorganic amendments on the remediation of a contaminated mine soil: I. Effects on trace elements and nutrients solubility and leaching risk[J]. Chemosphere, 2014, 107: 121–128
[26] Bolan N, Kunhikrishnan A, Thangarajan R, et al. Remediation of heavy metal(loid)s contaminated soils – To mobilize or to immobilize?[J]. Journal of Hazardous Materials, 2014, 266(4): 141–166
[27] 徐应明, 梁学峰, 孙国红, 等. 酸和热处理对海泡石结构及吸附Pb2+、Cd2+性能的影响[J]. 环境科学, 2010, 31(6): 1560–1567
[28] 林大松, 刘尧, 徐应明, 等. 海泡石对污染土壤镉、锌有效态的影响及其机制[J]. 北京大学学报(自然科学版), 2010, 46(3): 346–350
[29] Kirkham M B. Cadmium in plants on polluted soils: Effects of soil factors, hyperaccumulation, and amendments[J]. Geoderma, 2006, 137(1): 19–32
[30] Hartley W, Dickinson N M, Riby P, et al. Arsenic mobility in brownfield soils amended with green waste compost or biochar and planted with Miscanthus[J]. Environmental Pollution, 2009, 157(10): 2654–2662
Effects of Soil Properties on Cadmium Immobilization of Contaminated Soils in Guangdong and Hunan Provinces Using Sepiolite and Lime
CUI Xu1,2,3, WU Longhua1,2*, WANG Wenyan1
(1 Key Laboratory of Soil Environment and Pollution Remediation, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China; 2 University of Chinese Academy of Sciences, Beijing 100049, China; 3 College of Resources and Environment, Shanxi Agricultural University, Taigu, Shanxi 030801, China)
In this study, a pot experiment was conducted and pH value and CaCl2extractable cadmium (Cd) were determined to investigate the effects of combined amendments (lime and sepiolite) on the plant dry biomass and Cd accumulation ofL. The results showed that the remediation effects in acid soils were greater than those in calcareous soils. Correlation analysis showed that soil pH, organic matter (OM) contents, clay contents and total Cd were the key factors affecting the biomass of. Soil pH, CEC, OM and clay contents were the key factors affecting Cd concentration in. Soil pH, CEC, total Cd and clay contents were the key factors controlling soil extractable Cd concentrations.
Immobilization;Heavy metals; Soil properties;L.
国家自然科学基金项目(41325003)资助。
(lhwu@issas.ac.cn)
崔旭(1978—),男,山西介休人,博士,主要从事土壤污染与修复研究。E-mail: sxaucx@126.com
X171.5;X131.3
A
10.13758/j.cnki.tr.2019.03.016
