绝经后活动性类风湿性关节炎患者低骨密度的相关危险因素分析
2019-07-26方梓青舒高
方梓青 舒高
广州中医药大学第三临床医学院,广东广州510006
骨质疏松和骨折风险增加是类风湿性关节炎(rheumatoid arthritis,RA)患者常见的并发症[1]。研究表明,骨密度(bone mineral density,BMD)、年龄、性别和体质量指数(body mass index,BMI)也是类风湿性关节炎的临床危险因素[2]。对RA患者生化骨转换标志物(bone turnover marker,BTM)的评估可能是预测骨折并监测治疗的有用独立工具。国际骨质疏松基金会和国际临床化学和检验医学联合会骨标记标准工作组支持BTM在骨质疏松症患者治疗中的作用[3]。然而,由于缺乏基于人群的前瞻性研究,BTM目前尚未纳入FRAX。在RA患者中,各种发病机制可能导致系统性骨丢失,但生活方式因素和抗风湿治疗可能起作用[4]。炎症细胞在RA中骨质疏松症的发生和发展中起重要作用,并直接或通过促炎细胞因子诱导骨吸收,其中TNF-α和IL-6是介导骨丢失的重要细胞因子[5]。抵抗素通过强烈上调IL-6和TNF-α而具有促炎特性[6]。这种脂肪细胞衍生的蛋白在RA患者的炎症关节和外周血单个核细胞中也可检测到,提示它在炎症过程中可能起作用。它通过刺激成骨细胞和破骨细胞分化,可能通过核因子κB(NF-κB)途径在骨代谢中发挥重要作用[7]。骨桥蛋白(osteopontin,OPN)最近被认为是潜在的促炎细胞因子[8],OPN由多种细胞表达,包括活化的T细胞和巨噬细胞以及骨细胞,它对绝经后骨质疏松症至关重要。这种细胞因子激活NF-κB通路在单核细胞中的转录,其参与许多炎症因子的产生,并在几种生理和病理过程中起重要作用[9]。在没有RA的绝经后妇女中,体重是骨丢失率的重要决定因素[10]。此外,已经发现,较高的BMI与RA中较少的X线摄影关节损伤独立相关[11]。因此,在本研究中,笔者研究了具有活动性RA的绝经后妇女中骨转换标志或骨密度与炎症和肥胖之间的关系。
1 材料和方法
1.1 一般临床资料
笔者研究了106例根据风湿病学会标准诊断为女性绝经后RA患者,年龄50~65岁,平均(56.3±4.8)岁,她们于2015年5月至2017年6月在我院接受治疗。患者按BMI分组:Ⅰ组为18.5~24.9 kg/m2,消瘦(n=36);Ⅱ组为 25.0~29.9 kg/m2,超重(n=35);Ⅲ组为>30.0 kg/m2,肥胖(n=35)。排除已经进行激素替代疗法和已知影响骨代谢疾病的患者,如糖尿病、甲状腺功能亢进症和甲状旁腺功能亢进症和在过去3个月中使用缓解疾病的抗风湿药物(DMARDs)和糖皮质激素治疗;甚至有人接受过生物治疗。使用标准设备测量所有受试者的体重和身高,BMI=体重(kg)除以高度(m)的平方(kg/m2)。使用肿胀和压痛关节的数量,患者的全局视觉模拟评分(visual analogue score,VAS)和血沉(erythrocyte sedimentation rate,ESR)评估每例患者的疾病活动评分DAS28。该研究方案经我院伦理委员会批准,所有参与者均表示同意。
1.2 血清指标检测
上午7:00至9:00从肘前静脉取血样。样品在5 000 r/min和4℃状态下进行离心。将血清分离并储存在-70℃。使用Medlab产品试剂盒(波兰)测量 ESR;用高灵敏比浊法(Orion Diagnostica,Finland)测定血清 C-反应蛋白(CRP)浓度,使用BioSystems试剂盒(西班牙)检测类风湿因子(RF)。使用免疫酶学 ELISA方法(Bender MedSystems,Austria,Immunodiagnostic Systems Nordic,Inc;测定灵敏度=0.2 ng/mL)测定骨转换标志物的血清浓度:骨钙素(osteocalcin,OC)和胶原I型交联C-端肽片段(collagen type I crosslinked C-terminal peptide fragment,CTX)(测定灵敏度均为0.02 ng/mL)。通过免疫酶学ELISA检测血清抵抗素、TNF-α、IL-6及OPN的水平(抵抗素、TNF-α、IL-6和OPN的测定灵敏度分别为 0.010 ng/mL、0.190 pg/mL、0.110 pg/mL 和50 pg/mL;R&D Systems,德国)。
1.3 骨密度检测
使用Lunar Prodigy Advance密度计(Lunar Corp.,Madison,WI,USA),通过髋部(总计和颈部)的双X射线吸收测定法(DXA)测定骨密度。DXA测量结果表示为BMD(g/cm2)和T评分(与具有峰值骨量的同性正常受试者比较)。
1.4 统计学方法
数值以均值±标准差,中位数和四分位数表示。Shapiro-Wilk检验用于检查数据的正态分布,而Levene方差齐性检验用于每个亚组的参与者。通过使用单因素方差分析(ANOVA)和事后分析,将3组患者在年龄、血液生化参数和骨密度方面进行比较。使用协方差分析(ANOVA)获得体重调整后的BMD测量值差异。使用事后分析使用Kruskal-Wallis检验进行所有生化参数组之间的比较。最后,使用Spearman秩和检验评估变量与所有参与者之间的相关性,以及糖皮质激素使用者和双膦酸盐是否使用亚组。使用逐步回归分析来鉴定血清CTX浓度的显著决定因素。使用线性回归检查股骨BMD(全部或颈部)与骨转换标志物与炎性参数或疾病持续时间的关联,并针对所有参与者和双膦酸盐非使用者亚组的BMI进行调整。结果以b系数和95%CI表示。所有分析均使用SPSS 20.0软件包进行;P<0.05认为差异具有统计学意义。
2 结果
三组的一般临床特征见表1。各组之间在年龄、绝经年龄、疾病持续时间、DAS28和其他炎症生化指标以及骨转换指标方面差异无统计学意义(P>0.05)。表2列出了三组患者的股骨BMD值以及体重调整的单向ANOVA和ANCOVA值。肥胖的女性RA患者的总股骨BMD和T总分显著高于较瘦的患者(P<0.05)。然而,在调整体重后,未发现组间差异有统计学意义(P>0.05)。在股骨颈BMD参数方面,两组之间没有观察到显著差异(P>0.05)。
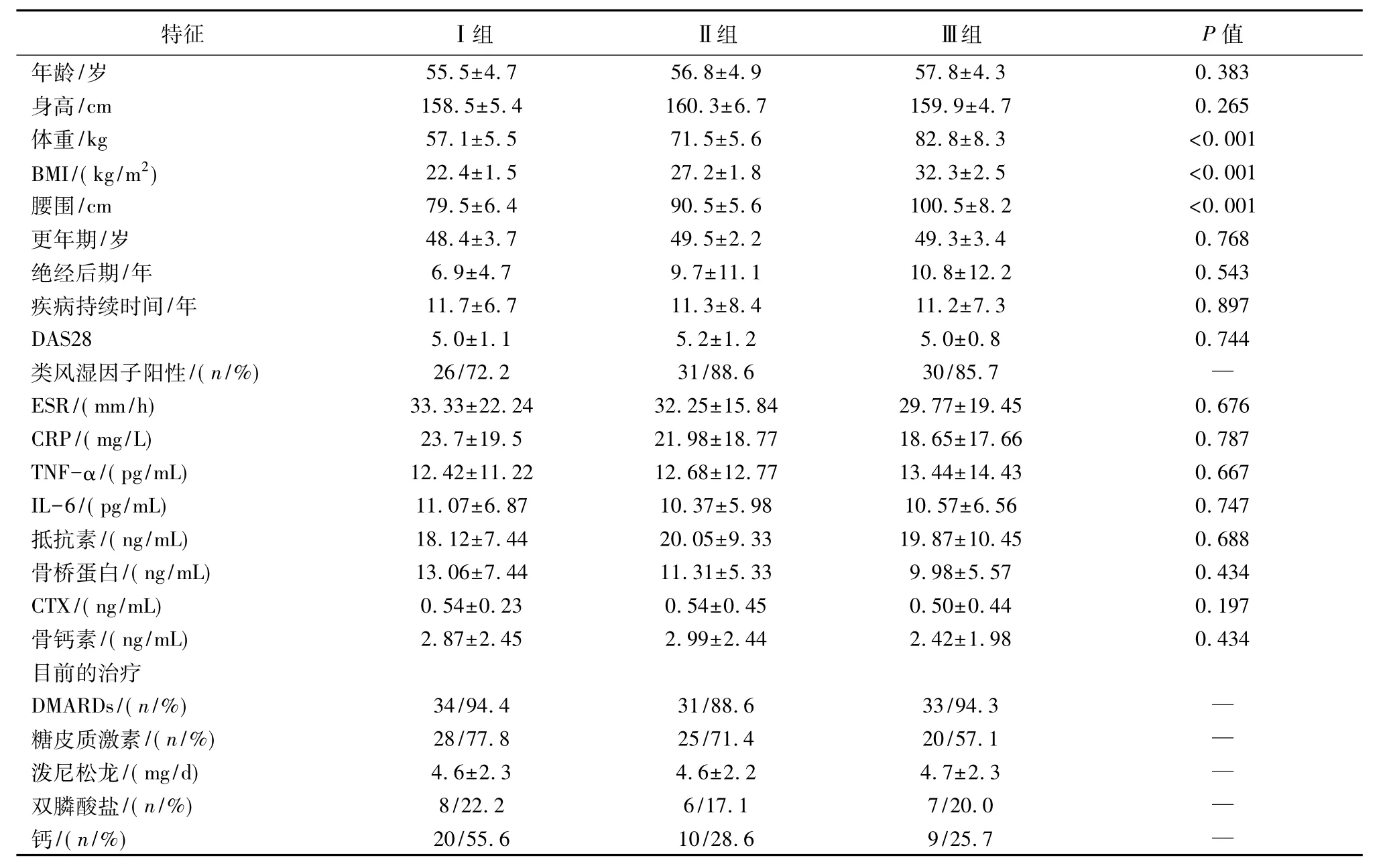
表1 三组患者的特征比较Table 1 Comparison of the characteristics among three groups of women

表2 三组患者的股骨骨密度比较分析Table 2 Comparative analysis of bone mineral density of the femurs among the three groups
股骨BMD(总体和颈部)和体重(分别为r=0.51,P=0.001 和 r=0.36,P=0.002)、BMI(r=0.45,P=0.001 和 r=0.28,P=0.021),以及总股骨BMD和腰围之间(r=0.36,P=0.003)有显著相关性。股骨BMD(全部或颈部)与骨转换标志物或炎症参数和疾病持续时间之间没有显著相关性。然而,线性回归分析显示,调整BMI后,增加TNF-α浓度与颈部BMD较低相关(在所有患者组中:b=-0.005,95%CI:-0.006,-0.003;P=0.0421 和未使用双膦酸盐的患者:b=-0.006,95%CI:-0.009,-0.004;P=0.012),但对于其他炎症因子,未发现任何类似的关联。
发现OC水平与CTX水平呈正相关(r=0.34,P=0.007),但与抵抗素水平呈显著负相关(在所有患者组中:r=-0.36,P=0.005;在不使用双膦酸盐的患者中:r=-0.32,P=0.031)。在将患者分成使用和不使用糖皮质激素的亚组后,仅在类固醇治疗的患者中OC水平与抵抗素显著相关(r=-0.50,P=0.001)。研究发现CTX水平和BMI(r=-0.26,P=0.042)、体重(r=-0.26,P=0.042)之间存在显著的负相关。在CTX和OPN水平之间观察到显著的正相关(在所有患者组中:r=0.41,P=0.001;在不使用双膦酸盐的患者中:r=0.35,P=0.014)。
当逐步回归分析包括BMI和OPN水平时,BMI是CTX水平最重要的决定因素(R2=0.10,P=0.011)。骨转换标志物(OC和CTX)的水平与其他炎症指数以及年龄和疾病持续时间无相关。OPN水平和绝经后时间(r=-0.46,P=0.002)、体重(r=-0.26,P=0.044)、腰围(r=-0.28,P=0.033)之间存在负相关。IL-6和 CRP水平(r=0.44,P=0.002)、ESR(r=0.30,P=0.025)、DAS28(r=0.36,P=0.004)之间存在显著相关性。抵抗素水平与CRP水平显著相关(r=0.29,P=0.022)。TNF-α水平与 DAS28(r=0.33,P=0.011)和 ESR(r=0.31,P=0.012)也显著相关。
3 讨论
本研究发现,BTM和BMD与BMI和几种炎症标志物之间显著相关。然而,未观察到股骨BMD(全部或颈部)与骨转换标志物水平之间显著相关。有研究表明,高水平的BTMs可以独立于绝经后妇女的骨密度预测骨折风险,并且BTMs基线水平与骨丢失率之间的关联在其他部位髋部[12]。股骨骨密度或骨吸收标志物(CTX)与体测参数之间的关系可以证实体重对骨组织的显著影响。本研究结果与以前的研究结果一致,BMI对RA患者的BMD有益作用[13]。
在绝经后妇女中,体重对骨骼的正面影响可能与体重对骨组织的机械负荷或与肥胖相关的激素因子有关。众所周知,炎症对骨代谢有重要影响,导致吸收率增加[14]。来自其他关于RA的研究的数据显示疾病活动的某些指标与骨量减少之间存在关联[13]。本研究中未发现 CRP、IL-6 和 TNF-α 血清水平和骨量与骨转换标志物之间的任何关系,只有在调整BMI后,研究TNF-α水平和股骨颈部BMD之间的关联时才能发现炎症状态对骨组织的不利影响。TNF-α在RA和普通骨质疏松症中起着重要作用,TNF-α在成骨细胞中诱导RANKL,直接促进破骨细胞分化和活化,并与RANKL协同作用;抗TNF-α治疗可以使髋部骨密度增加高达13.1%[15]。
关于BTM,本研究发现CTX和OPN水平之间有显著的正相关,并且OC与抵抗素水平之间也呈负相关,表明炎症因素可能会从不同机制影响骨代谢和抵抗素水平之间的关系。在动物模型中,类固醇增加了脂肪细胞中抵抗素的产生[16]。笔者观察到OC和抵抗素之间的负相关性仅在将他们分成使用糖皮质激素治疗或不使用糖皮质激素治疗的亚组患者中显著相关。因此,不能排除糖皮质激素治疗对骨组织的不利影响与抵抗素有关。有研究[17]已经表明抵抗素可能在骨重塑中发挥作用,进一步研究发现抵抗素与破骨细胞活性增加的标志物I型胶原的羧基末端端肽之间的中度相关性。Seriolo等[18]报道,与匹配的对照组和无活动性RA患者相比,活动性RA患者的血清OC水平显著降低,反映骨吸收的标志物水平更高。因此,RA可能会导致骨吸收增加和骨形成减少。
在本研究中,OPN水平与骨吸收标志物CTX水平呈正相关,而 OPN水平与骨密度无相关性。Chang等[19]研究表明绝经后妇女(无RA)OPN浓度较高,骨质疏松症风险较高,血清OPN和CTX水平呈正相关。在 Go'mez-Ambrosi等[20]的研究中,调整肥胖后,血浆OPN浓度与CRP水平相关。本研究未发现OPN水平与其他炎症标志物之间的关联。这可能表明在RA患者中存在调节OPN血清水平的不同机制。在没有患RA的受试者中,肥胖与低度全身炎症密切相关。此外,据记载,超重和肥胖受试者的血浆OPN水平增加,并与体脂相关[20]。Go'mez-Ambrosi等[20]表明,网膜脂肪组织分泌OPN可能有助于增加肥胖症中观察到的OPN循环水平。本研究发现,BMI与炎症标志物(ESR、CRP、IL-6、TNF-α、抵抗素或DAS28)之间没有显著关系。但是在本研究中,笔者观察到OPN水平与体重和腰围的负相关性,BMI值较高的亚组CRP水平有下降趋势。笔者注意到OPN水平与绝经后期间的负相关。本研究结果可能间接表达更年期的影响,并改变OPN水平上的性激素状态。骨量减少在绝经后几年中最为迅速,可能与雌激素生成减少有关[21]。雌激素缺乏可能是女性RA高发的原因。
总的来说,炎症和肥胖是绝经后活动性类风湿性关节炎女性患者出现骨损伤的危险因素。
