疯草类植物在美国天然草地的分布及其动物中毒病研究现状与展望
2019-07-25浮晶晶郭亚洲黄文颖吴晨晨赵宝玉
浮晶晶, 郭亚洲, 黄文颖, 郭 蓉, 路 浩, 吴晨晨, 赵宝玉,*
(1. 西北农林科技大学动物医学院中国西部有毒植物研究所, 陕西 杨凌 712100;2. 青海省动物疫病预防控制中心, 青海 西宁 810001)
美国天然草地面积3.38亿hm2,占世界草地面积(35亿hm2)的9.70%,位居世界第三[1-2]。美国90.00%天然草地分布于西经100°以西的大平原和西部山间高原、盆地之间[1],其间的北美大草原面积约1.54亿hm2,是世界上面积最大的禾草草地,拥有温带海洋性气候和地中海气候,海拔2 000 m左右,年平均降雨量为1 000~1 500 mm,特殊的地理环境和气候条件为美国草地畜牧业发展提供了丰富的资源[3]。
19世纪60年代初美国西部大开发,是当时内战后美国政治经济发展的必然趋势。但由于盲目开发,西部人口急剧增加、草原超载过牧、人为过度毁草开荒造地,导致地表植被破坏,土壤风蚀加剧,草场荒漠化,疯草(Locoweed)、飞燕草(Consolidaajacis)、羽扇豆(Lupinusmicranthus)、毒人参(Coniummaculatum)等毒草泛滥,给草地畜牧业和草地生态造成严重危害。20世纪30年代美国西部遭遇的沙尘暴袭击,即著名的“黑风暴”,给美国带来巨大的生态灾难[3-4],是西部大开发造成生态破坏的真实反映。据报道,1978年美国西部毒草造成的经济损失超过1.07亿美元,1988年后每年造成的经济损失达2.50亿美元[5-6]。鉴于草地毒草灾害的严重性,促使美国农业部成立有毒植物研究所,专门开展天然草地毒草种类调查、毒性灾害评估和动物中毒病诊断及控制技术研究[7-8]。
疯草是指动物采食毒草后引起以慢性神经机能障碍为特征,表现发疯样症状的一类毒草统称,由此引起的动物中毒称为疯草病[9-12]。疯草是世界范围内危害草地畜牧业健康发展的毒草[13],主要分布在北美洲的美国、加拿大和墨西哥,南美洲的巴西、阿根廷和秘鲁,亚洲的中国、蒙古、哈萨克斯坦和伊朗,欧洲的俄罗斯、西班牙和冰岛,大洋洲的澳大利亚、新西兰等国家[14-18]。本文通过对已有文献资料查阅,就美国疯草类植物的研究历史、种类分布、灾害状况、毒理学和疯草防控技术等方面的进展进行综述,旨在为我国天然草地动物疯草中毒病的致病机制、综合防控与利用技术研究提供借鉴。
1 美国疯草研究历史
回顾美国疯草及其中毒病的研究历史,可追溯到18世纪末[19]。1873年爆发了严重的疯草中毒病,这是美国动物疯草中毒的最早报道[11]。此后关于动物疯草中毒的报道日益增多,引起了草原管理和兽医毒理学工作者的关注。根据文献资料可将美国动物疯草中毒病研究划分四个阶段。
第一阶段:疯草毒性灾害发现。1873年美国首次报道加利福尼亚州南部动物疯草中毒[20],当时确证植物种属为黄芪属(Astragalus),并查明北美300多种黄芪属植物中13种可引起动物中毒;1883年出现的疯草中毒证实植物种属为棘豆属(Oxytropis)[21];1957年和1972年加利福尼亚洪堡县和阿尔伯塔省西南部都出现了疯草中毒[22-23];1982年和1984年出现了牛和麋鹿疯草中毒[24-25];随后在1983—1985年、1991—1993年、1998年美国相继爆发了3次影响范围大的疯草中毒,导致大批动物中毒死亡[26]。Thompson等[27]报道,美国每年由绢毛棘豆(Oxytropissericea)和密柔毛黄芪(Astragalusmollissimus)引起的动物中毒所造成的经济损失超过2.34亿美元。
第二阶段:疯草毒素确证。从1873年发现疯草病到1982年确定苦马豆素(Swainsonine,SW)是疯草的主要毒性成分,美国经历了100多年的漫长过程。1905-1907年Marsh[28]证实动物疯草病与采食黄芪属和棘豆属毒草有关;1926年,Couch[29]首次从兰伯氏棘豆(Oxytropislambertii)中分离出疯草毒素,该毒素可引起猫疯草病,但因当时分离手段所限未鉴定结构;1936年,Fraps等[30]从密柔毛黄芪中分离出一种有毒成分取名洛柯因(Locoin),当时因洛柯因和生物碱试剂反应不明显,未确定为生物碱;70年后病理学研究发现,斑荚黄芪(Astragaluslentiginosus)、绢毛棘豆(Oxytropissericea)与灰苦马豆(Swainsonacanesces)中毒病理组织学变化十分相似,呈现神经及内脏细胞的空泡化,而且同遗传性甘露糖贮积症(Mannosidosis)相似[31];1979年Colegate等[32]利用甘露糖苷酶作靶点,从灰苦马豆中分离出甘露糖苷酶抑制剂生物碱单体,命名苦马豆素。随后,1982年美国Molyneux和Panter等[5,33]依据灰苦马豆和疯草中毒之间的相互联系,用苦马豆素作标准样品,从斑荚黄芪和绢毛棘豆中分离出苦马豆素,从而确定苦马豆素是疯草的主要毒性成分。此后Gardner等[34]和Molyneux[35]等陆续从数10种疯草中检测出苦马豆素;1989年,James等[36]在相关国际会议上指出,苦马豆素是引起动物疯草中毒特征症状的唯一毒素。
第三阶段:苦马豆素毒性研究。1982年,苦马豆素被确定为疯草毒性成分后,许多学者用苦马豆素纯品复制大鼠、绵羊、猪和牛等动物中毒模型,开始苦马豆素毒性与毒理研究。1984年,Tulsiani等[37]在猪饮水中加入100 mg·kg-1·d-1苦马豆素,71 d后猪出现典型疯草中毒症状,组织学检查细胞胞浆空泡变性,肝细胞高尔基体甘露糖苷-Ⅱ降低,组织中低聚糖明显增加;1985年,Novikoff等[38]经大鼠毒性试验证明,苦马豆素能迅速引起肝、肾细胞空泡变性,尿液中低聚糖排泄增加;1991年,James等[39]在海拔3 000 m地区将苦马豆素混入乳中喂给犊牛,复制出犊牛典型的疯草中毒模型,并证明苦马豆素可代谢转移到乳中引起幼畜中毒;1995年,Steglmeier等[40]通过每天给绵羊以1.00 mg·kg-1体重的剂量进行苦马豆素染毒,证明苦马豆素具有蓄积毒性,与疯草中毒需数周或更长时间的研究结果一致。
第四阶段:疯草灾害防控技术研究。20世纪60年代后期,美国为了应对草地退化,在《泰勒放牧法》的基础上颁布了《自然保护区法》、《国家环境政策法》、《公共草地改良法》、《草地革新法》等系列与草地管理相关的法律法规,形成以法管草的良性循环[4,41]。对于疯草等毒害草,最初美国控制手段主要是采用化学性除草剂进行大规模化学防控[42-43]。但因长期依赖化学农药出现药物残留、环境污染等种种弊端,80年代后期开始生物防治的研究工作,陆续开展了种群竞争、生物防控、条件性避食、药物防治、合理放牧、控制放牧期等技术研究,开展了生态治理[44-49]。此外,美国还加大了立法和科研投入,制订了相关法律以积极应对毒草毒性灾害的发生,建立了农业部西部有毒植物研究所,进行草地毒草成灾规律、风险评估,监测预报及治理体系研究,全面开展毒草综合防控工作。到20世纪末草地植被和生态系统恢复重建,疯草毒性灾害发生频率和风险逐渐减少。
2 美国疯草种类与地理分布
美国草地主要分为六大区域,如图1所示[3-4,50]。通过资料查阅发现美国西部豆科黄芪属和棘豆属植物超过300种,大多数是优良牧草或绿肥植物,但有些动物采食后会引起中毒。经毒性分析,美国西部天然草地大约有疯草类毒草49种(含变种),其中黄芪属44种(含变种)、棘豆属5种(含变种),分布广且对草地畜牧业危害严重的疯草主要是黄芪属的密柔毛黄芪及其变种、斑荚黄芪及其变种和沃顿黄芪(Astragaluswootoni),棘豆属的兰伯氏棘豆和绢毛棘豆等。美国西部天然草地疯草类毒草种属及分布见表1[10,13,51-56]。
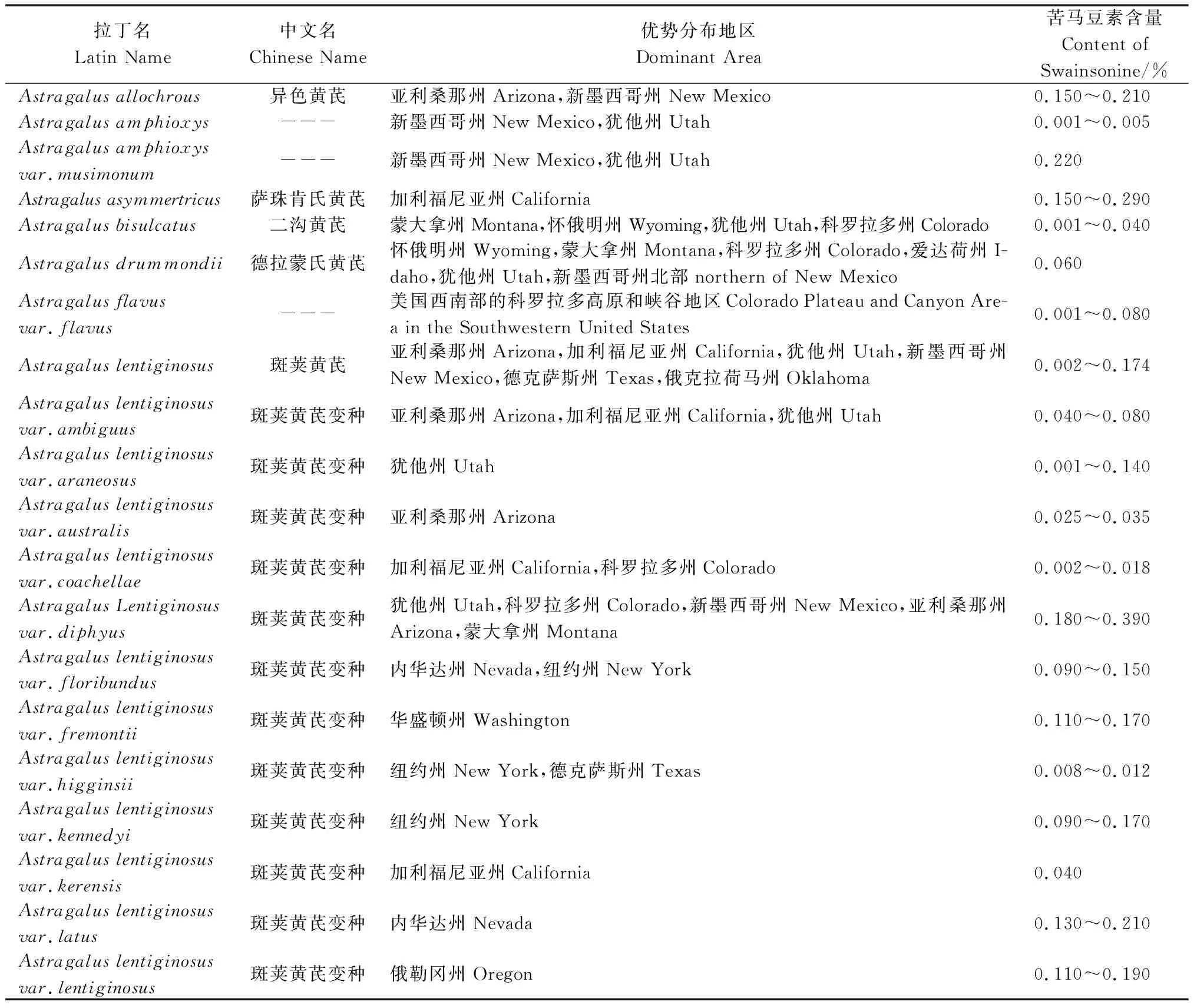
表1 美国西部天然草地疯草类毒草种属及分布Table 1 Species and distribution of locoweed in the natural grassland of the western United States

续表1
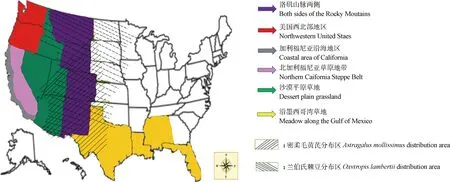
图1 美国草地区域划分示意图Fig.1 Schematic diagram of grassland area division in USA
3 疯草灾害状况
3.1 对草地畜牧业的危害
对草地畜牧业的危害疯草对畜牧业造成多种形式的损失,包括慢性中毒引起动物体重下降和死亡,繁殖效率降低造成畜群结构失衡、机体免疫系统损害和其他慢性病等健康问题[20,27,57],也包括牧场管理、土地价值降低、额外的饲料和药物支出、兽医人员增加和牧草损失等潜在的成本增加。据美国农业部统计,1984年西部17个州毒草灾害造成28.1万头牛和26.4万只羊中毒和繁殖障碍,直接经济损失16910万美元;1992年西部17个州41.7万头牛和32.3万只羊中毒和繁殖障碍,直接经济损失24 509万美元,其中以疯草中毒造成的损失最严重[6,58]。19世纪60年代初到20世纪中期,是美国西部天然草地疯草灾害发生最为严重的时期,给美国畜牧业造成巨大损失。
3.2 对草地生态的危害
由于干旱、过度放牧和乱垦乱挖等自然和人为因素的干扰,优良牧草竞争力减弱,种类和数量减少,疯草以其抗寒旱、抗病虫害、生命力强、繁殖快等特征,快速适应恶劣环境,形成优势物种[5,58],与牧草争夺营养、空间、水分和阳光,使得草地植物种群结构失衡,多样性降低,生态系统被破坏,草地利用价值降低。
3.3 对动物机体的损害
3.3.1 临床表现 马、牛、羊对疯草敏感,啮齿动物有一定耐受性,连续采食疯草2—3周后发病,进程呈慢性经过表现为嗜睡、被毛粗乱、眼神僵直、虚弱、消瘦、呕吐、神经紧张、离群、丧失吃喝能力、随意运动缺乏协调、姿势异常、抑郁和昏迷、后肢无力或僵硬、共济失调。随后,肢体刚度增加,难以维持平衡,多向左卧,痉挛,或走圆圈、划船和角弓反张,前庭耳蜗缺陷。牛会发生水肿,身体骨骼畸形、暴躁、性欲降低、精子和卵子产生减少等,高海拔地区会发生充血性心力衰竭[59-60]。
3.3.2 体液相关指标变化 病畜血液常规检查红细胞数、白细胞数、血红蛋白含量、红细胞压积值下降,中后期血液涂片染色显示外周血淋巴细胞或单核细胞出现空泡化[61];血清谷草转氨酶(Aspartate transaminase,AST)、谷丙转氨酶(Alamine aminotransferase,ALT)和碱性磷酸酶(Alkaline phosphatase,ALP)活性明显升高,血尿素氮(Blood urea nitrogen,BUN)含量升高。α-甘露糖苷酶活性下降,可降低到正常的50%以下[62];病畜中后期尿液低聚糖含量升高,尿低聚糖中的甘露糖明显增加[61,63-64]。
3.3.3 病理学损伤 大体剖检尸体极度消瘦,血液稀薄,肠系膜血管淤血,淋巴结肿胀,切面湿润有渗出。胸腹腔有少量积液,心脏扩张,心肌柔软,肺脏表面有淤血灶,脑膜血管淤血,其余脏器无明显肉眼病变;组织病理学检查可见神经及实质器官细胞呈现广泛空泡变性,特别是小脑浦肯野氏细胞空泡变性最明显[16,17,60,65](图2);超微结构上空泡变性在丘脑和小脑浦肯野细胞和星形胶质细胞中明显,其中大多数是光学空泡被膜限定。在一些空泡中观察到膜碎片、网状或致密颗粒和无定形物[59]。

图2 浦肯野细胞严重空泡(HE 40×)Fig.2 Purkinje cells are heavily vacuolated
4 疯草毒性成分研究
4.1 毒素的吸收与代谢
苦马豆素属吲哚里西啶生物碱,易溶于水,在动物消化道能迅速吸收,并通过尿液、粪、乳汁排出体外[60]。1993年,Bowen等[66]报道,小鼠一次静脉注射苦马豆素,血清中半衰期约32 min;1994年Goss等[67]在人类医学临床研究中,持续静脉注射苦马豆素0.050 mg·kg-1和0.550 mg·kg-1,血清半衰期大约为12 h;1993年,Bowen等给小鼠一次静脉注射氚化苦马豆素,发现肝脏和肾脏中苦马豆素含量最高,但很快移入膀胱中排出,认为慢性疯草中毒导致的肝肾损伤可能与苦马豆素含量高相关;1995年,Steglmeier等[68]发现,采食疯草的绵羊全血、骨骼肌、脑、甲状腺、肝和肾脏均含有苦马豆素,肾和肝脏比其它组织高2~4倍,其他组织苦马豆素含量与血液相近,且苦马豆素在这些组织中的含量与疯草采食量直接相关。经测定绵羊血清苦马豆素清除半衰期约达20 h,肝肾清除较慢,半衰期分别为60 h和51 h。
4.2 疯草产毒机制研究
20世纪30年代牲畜黑麦草(Loliumperenne)中毒事件给畜牧业造成巨大经济损失,究其原因是牲畜采食了携带内生真菌的黑麦草所致,这种内生真菌感染能产生生物碱毒素,掀起了植物次生代谢产物与内生真菌互作关系研究的高潮。20世纪末人们从疯草中分离出内生真菌,初步认为疯草中苦马豆素产生与内生真菌感染密切相关[69]。2003年,Braun等[70]从密柔毛黄芪、绢毛棘豆和蓝伯氏棘豆分离出内生真菌,鉴定为埃里砖格孢属真菌(Embellisia),证实能产生苦马豆素;2004年,Gardner等[71]对蓝伯氏棘豆16个种群比较试验发现,高水平苦马豆素与内生真菌存在有关,低水平苦马豆素与内生真菌缺失有关;2008年,Ralphs等[72]从部分棘豆属和黄芪属植物中分离出内生真菌,发现苦马豆素含量与内生真菌感染程度呈正相关;2009年,Cook等[55,73-76]测定含苦马豆素疯草中内生真菌含量是不含苦马豆素植物的10倍以上,并将埃里砖格孢属真菌重新鉴定为波状芽管蠕孢属(Undifilum)。结果证明,内生真菌主导苦马豆素合成,是疯草类植物苦马豆素的主要来源[77-78](图3)。

图3 疯草-动物-内生真菌三者间的关系Fig.3 The relationship between locoweed, animals and endophytic fungi
5 疯草中毒机理研究
苦马豆素阳离子和甘露糖阳离子的半椅状空间结构十分相似,与α-甘露糖苷酶亲合性很高,是α-甘露糖苷酶特异性抑制剂[36,79]。α-甘露糖苷酶是一种糖苷水解酶,广泛存在于人、鼠、牛、羊、禽类、昆虫和植物等真核细胞的溶酶体、内质网、高尔基体、胞浆和其他细胞器中,主要参与蛋白质糖基化和糖蛋白聚糖水解修饰,在低聚糖降解和糖蛋白成熟过程中发挥重要作用[80]。苦马豆素主要是通过抑制溶酶体α-甘露糖苷酶、高尔基体α-甘露糖苷酶-Ⅱ和内质网/胞质α-甘露糖苷酶活性,使细胞内蛋白的N-糖基化合成、加工、转运以及富含甘露糖的寡聚糖代谢等过程发生障碍[32,81],N-聚糖代谢异常,低聚糖大量蓄积,造成蛋白质的空间结构、理化性质改变,影响细胞黏附、细胞迁移、细胞生长及细胞分化等生理过程[10,81-83]。病理组织学变化主要表现为细胞出现广泛空泡变性,使动物中枢神经系统和实质器官受到损害,造成细胞功能紊乱,尤其是神经细胞,临床上主要表现神经症状[16]。当生殖器官组织细胞发生空泡变性时,可导致繁殖机能障碍。
6 疯草中毒防治技术研究
19世纪60年代初到20世纪中期,是美国疯草灾害发生最为严重的时期,受到了美国草地管理部门的高度重视。1954年,美国农业科学院有毒植物研究实验室在犹他州州立农学院成立;1955年,萨利纳有毒植物研究所并入犹他州有毒植物研究实验室[84];2004年,美国在犹他州州立大学建立了新的有毒植物研究所,是当时世界上有毒植物研究的权威机构,专门从事有毒植物种类调查、毒性灾害评估、有毒植物毒理学、动物中毒病致病机理、牧场管理及预防控制技术等研究[6,8]。目前,美国对疯草及其动物中毒病的防治技术研究,主要是从保护草地生态,从疯草-动物-草地三者相互依存关系出发,开展多种技术手段预防和控制疯草灾害的发生,防治技术分为针对疯草防控、针对动物避免中毒防治和综合防控技术三类(表2)。

表2 美国天然草地疯草及其动物中毒病防治技术Table 2 American natural grassland locoweed and its animal poisoning disease prevention and control technology

续表2
疯草及其中毒病防治技术中,传统的物理和化学防控技术由于存在局限性、特异性、生物安全性以及严重破坏草地植被和造成生态污染等缺点,目前已经不再采用。接种疯草病原菌、放养食疯草类昆虫、种植竞争性牧草以及避食训练虽然在疯草综合防控中显示出良好效果,但要真正应用于实际中生产还需做深入研究;疯草毒素疫苗注射是预防动物疯草中毒的理想方法,但存在疯草毒素疫苗抗原性低、免疫机制不清楚、疫苗成本高等不足,在实际生产中很难推广。随着人们对疯草生态作用认识的深入以及草地管理体制的健全,更多采取合理放牧、控制放牧期、及时隔离饲养等综合技术,其核心是设计合理的放牧管理措施,减少草场放牧压力,使动物尽可能地少接触疯草来预防中毒发生,效果较为理想。
7 展望
天然草地动物疯草中毒问题是一个世界性问题,长期以来一直困扰着世界草地畜牧业的健康可持续发展,特别是对美国、加拿大、澳大利亚、墨西哥和中国等草地资源大国的草地畜牧业造成严重损失,引起各国草地管理部门的重视,相继开展了疯草生物学、生态学、毒物学、毒理学以及预防与防控技术研究,在疯草致病机理和防控技术方面取得重要进展[100]。美国是世界上开展疯草研究最早的国家,从19世纪末就开始疯草种类分布调查、灾害状况评估、中毒病致病机理和防控技术研究,在应对疯草灾害问题上具有丰富的经验,尤其是在疯草预防控制技术方面,摆脱了传统的防除策略,提出了以生态治理为核心的疯草灾害综合防控技术体系,对有效控制疯草蔓延及其灾害的发生发挥了积极作用。中国是疯草灾害大国,有疯草类毒草47种,面积超过1100万hm2,约占全国草地总面积的2.80%,年直接经济损失超过几十亿元[101]。然而,中国对疯草研究起步较晚,目前主要采取物理和化学防控技术控制疯草的蔓延和扩散,虽然在一定程度上解决了疯草中毒问题,但如何从根本上解决疯草成灾及其毒害还没有很好的措施,尤其是在物种竞争、生物控制、控制放牧期、牧场科学管理等方面技术缺乏[102]。尽管中美两国国情不同,但在纬度、温度、地势、海拔、地貌、气候环境等地理环境上中国与美国具有相似性。因此,美国在疯草控制方面的成功经验,对中国疯草的科学防控具有重要参考价值。
