蒲公英内生真菌分离纯化及其形态学鉴定
2019-07-25丁海娥党苗苗张道顺从炳超
赵 秋,丁海娥,党苗苗,陈 思,张道顺,从炳超
(西北民族大学生命科学与工程学院,甘肃兰州 730124)
0 引言
近年来,已经成为生物制药有效途径之一的是将生物活性成分从天然产物中提取出来[1-2]。挑选天然药物最主要的原料一直以植物为主,但用于药用的植物中活性物质在其组织中含量一般很低,如果为了自身利益,人们一直过度使用野生药用植物资源,该物种就会濒危直至灭绝,这样就会使环境遭到破坏,还会破坏生物多样性。为了解决环境资源问题,近年来,研究了野生药用植物的热点,重点是药用植物的内生真菌。其内生真菌的研究始于19世纪后期,国内对内生真菌的研究才刚刚开始[3-4]。到20世纪90年代中期,研究内容仅限于对植物中某些内生真菌的研究[5]。利用内生真菌生产药理成分可以为寻找天然药物资源和保护植物资源提供新途径[6-7]。
蒲公英(Taraxacum mongolicum Hand-Mazz),是多年生草本植物。根部呈圆锥形,表面呈棕色,萎缩,叶片边缘有时呈波浪状或羽状,基部逐渐变窄为叶柄,叶柄和主脉通常呈红紫色,花萼上部为紫红色,密布在蜘蛛丝上。白色具长柔毛;花头呈钟形,瘦果深褐色,长冠毛白色,开花期4月至翌年10月。蒲公英主要含有的化学成分包括黄酮类、三萜类化合物、倍半萜烯内酯类、色素类、挥发油类和植物甾醇类,具有清热解毒、利尿通淋、消肿散等多种功能[8]。
内生真菌,在学术界没有一个准确的定义。内生菌的最早概念是指通过区分生活在植物表面的一些附生植物来生活在植物中的微生物。内生真菌是指宿主植物在某一阶段或生命的所有阶段都不会表现出外部疾病症状并生活在健康植物组织或器官中的微生物。研究表明,内生真菌的祖先可能是植物病原体,长期存在于植物组织中,与寄主植物“共同进化”,因此在此过程中,形成的代谢物可能与宿主植物相同或相似。许多物质都有多种活性。内生真菌,从不同植物中分离纯化出来,其种类数目不同,少的有几种到十几种,多的有几百种。通过对蒲公英内生真菌的培养、纯化和鉴定,为将药用微生物资源更好地开发奠定坚实基础。
1 试验材料
1.1 试验所用植物的材料来源
蒲公英取自西北民族大学格物1号楼正前方玫瑰园内,由试验指导教师郭俊珍鉴定。
1.2 仪器
ISO 9001型电子分析天平,北京赛多利斯仪器公司产品;VS-1300-U型超净工作台,苏州止痉净化设备有限公司产品;SPX-100B-Z型生化恒温培养箱、MLS-3750型高压蒸汽灭菌锅,上海博讯实业有限公司产品;FT-101A型电热鼓风干燥箱,北京科威永兴仪器有限公司产品。
1.3 玻璃仪器
量筒、玻璃棒、烧杯、培养皿、锥形瓶等。
1.4 药品与试剂
75%酒精,山东利尔康消毒科技有限公司提供;升汞0.1%(分析纯),北京化工厂提供;葡萄糖(分析纯),上海化学试剂厂提供;琼脂粉,上海山浦化工集团提供;注射用青霉素钠(80万U)、注射用硫酸链霉素(100万U),华北制药集团提供。
1.5 培养基
马铃薯葡萄糖琼脂(PDA)培养基。
2 试验方法
2.1 制作培养基
称取土豆200 g,经清洁、去皮后切成块,用蒸馏水煮沸,纱布折叠成8层,然后过滤,加入20 g葡萄糖,并加入20 g琼脂。化妆用1 L量筒至1 000 mL和分配到3个锥形瓶中,然后用高压蒸汽锅灭菌。除菌后,将介质的温度降低至约55℃,并加入青霉素钠的80×104U和100×104U硫酸链霉素去除内生细菌。倒30个平板,放置于超净台内,等待接种。
2.2 内生真菌的培养
选择没有害虫和伤口的新鲜蒲公英并用无菌水冲洗。在超洁净平台上,采用组织切割法采集植物的茎、叶和根,用手术刀将蒲公英的茎和根切成0.5 cm×0.5 cm×0.5 cm,0.5 cm×0.5 cm的小块。将切割的材料置于乙醇中2,4 min,并比较消毒时间。将混合物用蒸馏水洗涤3次,然后将该材料置于浸有汞的溶液中浸泡2 min,用蒸馏水冲洗3次,并置于无菌滤纸上。吸去水后,将其分别置于含有硫酸链霉素的培养基上,在各板上放置4片,密封膜,在30℃的培养箱中培养3~7 d。
另在一个平板内倒入无菌水,与上述平板一起放入培养箱中,观察是否有细菌长出,作为无菌参照。
2.3 分离与纯化
菌落出现在切口。根据菌落形态、色差和生长时间,挑取每个菌落的边缘菌丝并转移到分离培养基平板进行再培养。培养数天后,观察并记录菌落的形态。
在最后一次冲洗后,取少量表面消毒的无菌水,将其涂于含有硫酸链霉素(100 U/mL) 和青霉素钠(80 U/mL)的分离介质上,并在30℃下孵育。观察是否有任何真菌长出作为无菌处理的参考。
将获得的菌株反复纯化并培养。菌株编号后,将其转移到PDA倾斜培养基中,置于28℃培养箱中培养5~7 d,并贮存在4℃冰箱中。
3 结果与分析
3.1 蒲公英内生真菌的分离结果
从新鲜蒲公英根部、茎部、叶部分离获得14株内生真菌,分别编号PY-1~PY-14。
纯化菌落PY-1见图1,纯化菌落PY-2见图2,纯化菌落PY-3见图3,纯化菌落PY-4见图4,纯化菌落PY-5见图5,纯化菌落PY-6见图6,纯化菌落PY-7见图7,纯化菌落PY-8见图8,纯化菌落PY-9见图9,纯化菌落PY-10见图10,纯化菌落PY-11见图11,纯化菌落PY-12见图12,纯化菌落PY-13见图13,纯化菌落PY-14见图14。
3.2 蒲公英内生真菌的形态学观察及初步鉴定
从蒲公英内分离得到的内生真菌,菌落形式丰富多样,菌丝形态也不同,有绒、粉、絮状、颗粒等。每个菌落的颜色和色素沉着也有各自的特点。没有产生色素的细菌和产生色素的细菌;有常见的菌落颜色,如白色和黑色,以及深绿色、亮黄色、灰绿色、粉红色等;边缘整齐和爬壁菌丝,进一步表明内生真菌物种的多样性。
所分离内生真菌菌株编号及初步形态学观察见表1。
4 结论
作为微生物资源的植物内生微生物,较普遍地存在于植物中。与通常的微生物相比,植物内生微生物对植物表现出一定的亲和力。植物又是内生微生物赖以生存的物质基础,植物生产极大地关系到社会的繁荣和发展。因此,植物内生微生物研究、资源的积累及其操作技术和利用技术的研究有着重要意义[9]。
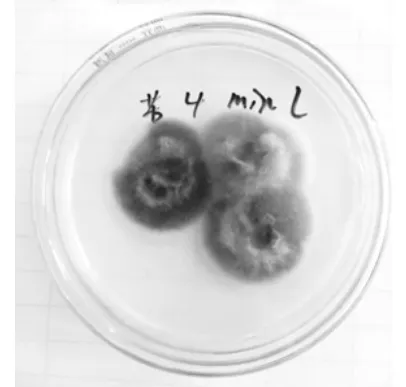
图1 纯化菌落PY-1

图2 纯化菌落PY-2
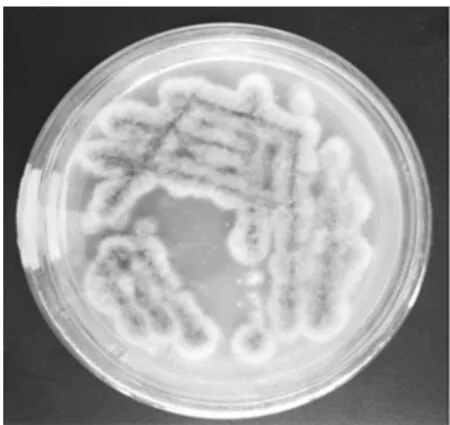
图3 纯化菌落PY-3
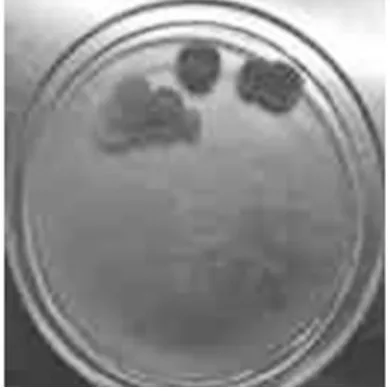
图4 纯化菌落PY-4
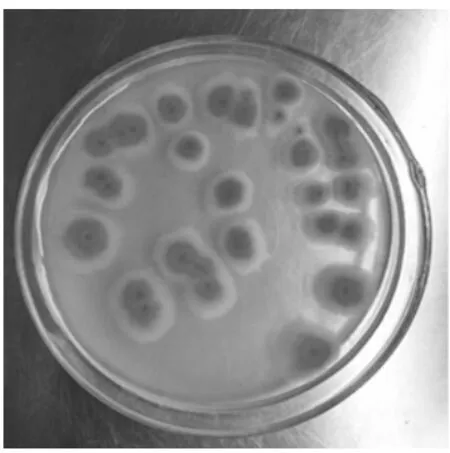
图5 纯化菌落PY-5
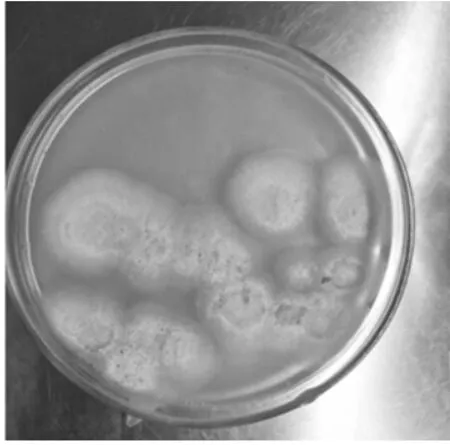
图6 纯化菌落PY-6
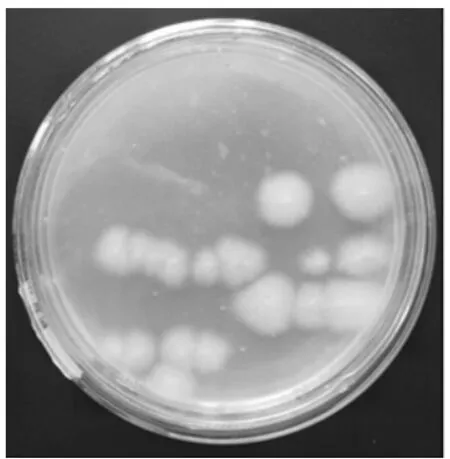
图9 纯化菌落PY-9
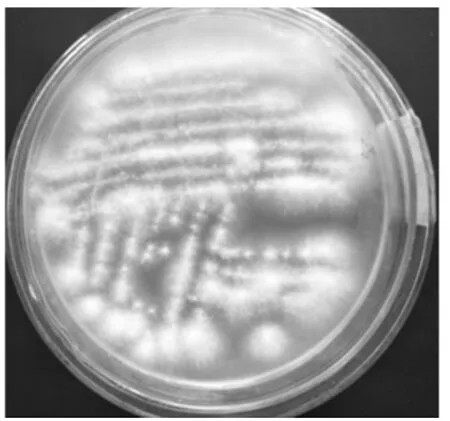
图10 纯化菌落PY-10
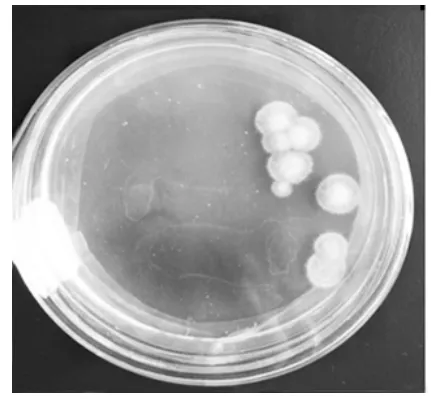
图11 纯化菌落PY-11
图12 纯化菌落PY-12
图13 纯化菌落PY-13
图14 纯化菌落PY-14
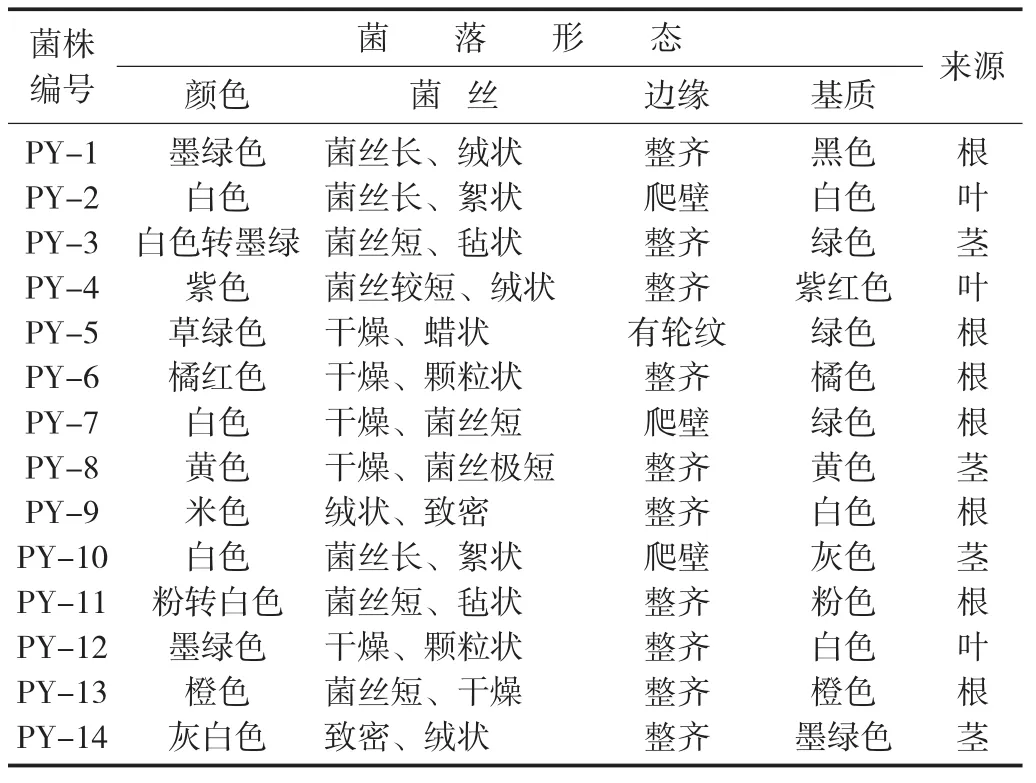
表1 所分离内生真菌菌株编号及初步形态学观察
马铃薯葡萄糖琼脂培养基(PDA)用作试验的培养基。使用组织切割方法,组织块消毒时间的平行试验在试验期间进行,用酒精消毒的时间为1,2,3,4 min。结果表明,酒精最适消毒时间为2 min,接种消毒1 min组织的培养基上长有杂菌,接种消毒3 min组织的培养基内生真菌基本不生长,接种消毒4 min组织的培养基不生长内生真菌;用于消毒和冲洗材料的无菌水被电镀和培养;如果板上没有长细菌,则表面消毒相对彻底;有14株内生真菌从蒲公英中分离纯化出来。
据观察,大多数组织块在3 d在组织切割切口处生长了菌丝体,并且应该是组织中的主要菌株;有些菌株直到6 d才出现甚至更长时间。这些菌株的生长速度也相对较慢。而且,根据观察发现不同植物组织中内生真菌的种类不同,生长速度都不尽相同。
此研究与其他类似研究相比,在蒲公英根系和茎内分离出菌种数量较多,形态各异,菌种多样性和特殊性大于其他类似研究的成果。药用植物组织中存在着多样的菌落特征和丰富的色泽,不同植物组织内的真菌的种类和数量不同,药用植物蒲公英组织的内生真菌也不同。多种次级代谢产物由内生真菌产生,这些次级代谢产物能够用于很多新药的研发,对下一步的菌种形态学和生理生化功能鉴定等试验提供了基础。
