不同施氮水平下菠萝蜜幼苗根系生长及氮素吸收特征
2019-07-23白亭玉苏兰茜鱼欢吴刚谭乐和
白亭玉 苏兰茜 鱼欢 吴刚 谭乐和

摘 要 为探究酰胺态氮肥在菠萝蜜苗期的最佳施用量,本试验以马来西亚1号嫁接苗为试验材料,比较不同施氮量对菠萝蜜幼苗根系生长及氮素吸收积累的影响。结果表明:随着施氮量增加,菠萝蜜幼苗叶片、茎秆、地上部和整株生物量,叶片氮素累积量、茎秆氮素累积量和总氮素累积量均呈先升高后降低的趋势,且均在施氮量为N1(5 g/株)时达最大值;根系生物量和根冠比在N1时达最小值。根系氮素累积量随着施氮量增加呈增长趋势。总根长、根系总表面积及根系体积随着施氮量增加呈降低趋势,其中N1水平与N0(0 g/株)无显著性差异。总根长、根系总表面积、根系体积与地上部干重呈显著正相关关系。施肥、地上部氮素累积量和总根长单个因子以及三者共同解释菠萝蜜苗生物量变化的比例为90.1%。综上,在本试验条件下,菠萝蜜幼苗适宜的施氮量为5 g/株,可作为菠萝蜜苗期施肥的参考值。
关键词 菠萝蜜;施氮量;根系形态;氮素积累
中图分类号 S147.5 文献标识码 A
Abstract In order to explore a suitable application of amino nitrogen on jackfruit seedlings, this experiment used Malaysian No.1 grafted seedlings as the test materials to compare the effects of different nitrogen application on the root morphology and nitrogen accumulation of jackfruit seedlings. The results showed that with the increase of nitrogen level, the biomass of leaves, stems, shoots, total plant, and nitrogen accumulation of leaves, stems, total plant increased at first but decreased after the peak at N1 (5 g/plant), while the biomass of roots and ratio of roots and shoots reached a minimum at N1. The nitrogen accumulation in roots increased with the increase of nitrogen application. The total root length, total root surface area and total root volume decreased with the increase of nitrogen application, while there was no significant difference between N1 and N0 (0 g/plant). The total root length, total root surface area, total root volume were significantly positively correlated with dry weight of shoot. Fertilization, nitrogen accumulation of shoots and total root length and both of them accounted for 90.1% of the change in the biomass of jackfruit seedlings. In summary, the proper nitrogen nutrition was 5 g/plant in this experiment which could be used as a reference for jackfruit fertilization.
Keywords jackfruit; nitrogen nutrition; root morphology; nitrogen accumulation
DOI 10.3969/j.issn.1000-2561.2019.06.007
菠蘿蜜(Artocarpus heterophyllus Lam.)又称木菠萝、树菠萝,为桑科(Moraceae)木菠萝属(Artocarpus)典型的热带特色果树。近10余年来,菠萝蜜生产发展迅速,是我国热带及亚热带地区广泛种植的木本粮果树,种植面积以每年近15%的速度增长,并在一些优势产区出现了规模化商业种植,据不完全统计,至2015年底我国菠萝蜜种植面积有1.33多万公顷,年产值约20亿元[1],具有广阔的市场前景。
目前,国内外学者针对菠萝蜜的良种选育、果肉加工贮藏等方面开展了大量研究,但对菠萝蜜营养施肥等方面的研究较少[2],如谭乐和等[3]认为,一年生菠萝蜜幼树应采用“一梢一肥”,每次施用尿素50~70 g。Crane等[4]对美国佛罗里达州菠萝蜜的综述中简要介绍了参考施肥量,通常一年生幼树可每2个月施复合肥(6-6-6)110~220 g/次。这些数据大多是经验施肥,缺乏行之有效的氮素管理方法,且菠萝蜜生物量大,果实产量高,对氮肥需求量高,田间极易表现缺氮症状。氮素是影响菠萝蜜产量和品质的重要矿质元素,对根系生长、形态以及根系在介质中的分布有明显的调控效应[5],因此研究菠萝蜜苗期的适宜施氮量对提高养分的利用率具有重要意义。根系是作物吸收水分和养分的重要器官,是土壤中养分的利用者和产量的贡献者,其生长状况与地上部的生长发育、产量的形成具有密切联系[6]。因此研究根系生长指标,如总根长、总根表面积及根系体积等有重要意义。目前,关于氮肥对菠萝蜜幼苗根系生长及氮素吸收积累的影响尚未见报道。因此,本研究以马来西亚1号菠萝蜜嫁接苗为材料,研究施氮水平对菠萝蜜幼苗根系生长及氮素吸收积累的影响,以期为菠萝蜜生产上合理施用氮肥、提高肥料利用率提供科学依据。
1 材料与方法
1.1 材料
1.1.1 供试土壤 供试土壤采自中国热带农业科学院香料饮料研究所(18°15N;110°13E)幼龄菠萝蜜种植基地边界,土壤类型为由砖红壤发育形成的沙壤土,pH 5.84,土壤速效磷32.17 mg/kg,速效钾68.67 mg/kg,碱解氮28.72 mg/kg,有机质1.8 g/kg。
1.1.2 供试材料 供试菠萝蜜苗为马来西亚1号嫁接苗,由中国热带农业科学院香料饮料研究所提供。供试氮肥为尿素(N含量46%),磷肥为过磷酸钙(P2O5含量为12%),钾肥为硫酸钾(K2O含量为45%)。
1.2 方法
1.2.1 试验设计 盆栽试验于2018年3月—2018年6月在中国热带农业科学院香料饮料研究所温室进行。施肥量参考Crane等[4]提出的幼龄树施肥量为基准并上下浮动2个浓度,氮肥施用量共设5个水平:N0(0 g/株)、N1(5 g/株)、N2(10 g/株)、N3(15 g/株),N4(20 g/株),所施的氮肥量为尿素的纯氮含量(因N4处理的氮肥用量过高,移栽1个月出现严重烧苗现象,故本试验结果未统计该处理的数据)。每个水平设置3个重复,每重复8株,总计96株。试验用土经过筛(2 mm)后装入塑料盆(直径18 cm,高30 cm)中,每盆装土6 kg,移栽一株三叶一心的供试菠萝蜜苗,常规管理,各处理磷、钾肥用量相同,其中磷肥作基肥,移栽苗時一次性施入,用量为P2O5 5 g/盆;钾肥(K2O,10 g/盆)和氮肥分4次等量作追肥施用,溶解于水后浇入土壤。
1.2.2 项目测定与方法 (1)干物质及氮素含量测定:种植4个月后开始测定各个项目,每个处理随机选取长势一致的5株菠萝蜜苗,分为根、茎、叶三部分,用去离子水清洗干净后置于烘箱中,在105 ℃下杀青30 min,然后在75 ℃下烘干至恒重并称取其干质量。后将各部分样品粉碎并过0.2 mm孔径筛,通过凯氏定氮消化,NaOH蒸馏,H2SO4滴定来测定其氮素含量。整株氮素累积量为各器官生物量与氮素含量乘积之和。
(2)根系生长指标测定:将清洗干净的根系平铺在根系专用放置盘中,加水并使水层保持在4~5 mm,用牙签将根系分开,用EPSON PERFEC TION V700(Japan)扫描仪扫描成像后,通过WinRHizo根系分析软件统计分析得到总根长、总表面积与根系体积各项特征参数,每个处理3个重复。
(3)土壤理化性质测定:土壤样品参照《土壤农化分析》[7]进行理化性质测定。
1.3 数据分析
在SPSS19.0软件中,使用Kolmogorov- Smirnov检验和Levene's检验对所有数据进行正态分析和方差齐性检验。采用单因素方法分析(ANOVA)进行数据比较,利用Duncan新复极差法检验处理间差异的显著性水平(P<0.05)。使用R软件(3.3.2)里的corrplot程序包进行相关性分析,BioEnv程序挑选对菠萝蜜生物量变化具有显著影响的根系生长指标和氮素累积量,再通过Vegan程序包进行方差分解分析(variance partitioning analysis,VPA)来研究根系生长指标、氮素累积量和施氮水平以及他们之间共同作用对菠萝蜜生物量变化的贡献率。
2 结果与分析
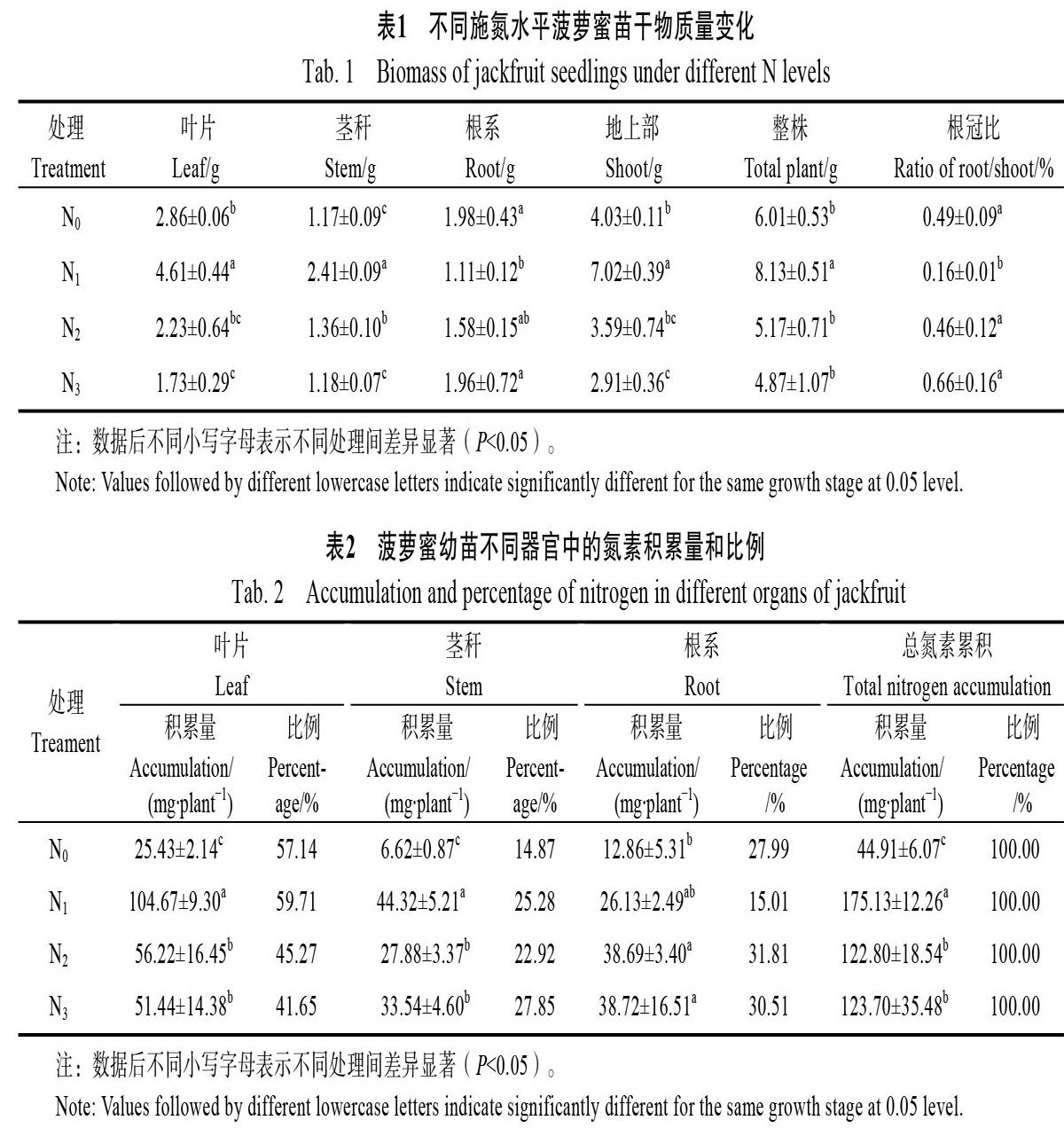
2.1 不同施氮量对菠萝蜜苗干物质量的影响
施用适量氮肥可以显著促进菠萝蜜幼苗地上部生物量的积累(如表1所示)。随着施氮量的增加,菠萝蜜幼苗叶片、茎秆和整株生物量均呈先升高后降低的趋势。其中N1水平的叶片、茎秆、地上部和整株生物量分别比不施氮N0增加61.19%、105.98%、74.19%和35.41%,根系生物量和根冠比较N0减少43.94%和67.74%(P<0.05)。N2水平的茎秆生物量较N0增加16.24%(P<0.05),其他指标与N0无显著性差异。N3水平较N0显著减少叶片和地上部生物量,减少比例分别为39.51%和27.79%。
2.2 不同施氮量对菠萝蜜幼苗不同器官氮素养分积累的影响
由表2可以看出,N1处理中氮素在菠萝蜜各器官中的积累量和比例均表现为叶片>茎秆>根系,其他处理表现为叶片>根系>茎秆。随施氮量的增加,氮素在叶片和茎秆中的积累量和比例均呈先增加后降低趋势,N1水平最高,氮素的积累量分别是N0水平的4.12和5.69倍。氮素在根系的积累量随着施氮量的增加逐渐增加,N1、N2水平处理达到最大;而氮素比例随着氮肥水平的增加呈先降低后增加的趋势,N1水平最低。说明,N1水平时,菠萝蜜幼苗吸收的氮肥更多地在茎秆和叶片部位积累,随着施氮量增加,地上部吸收利用氮肥的能力受到一定抑制。总氮素累积量随着施氮量的增加呈先增加后降低的趋势,N1、N2、N3水平的总氮素累积量分别是N0水平的3.90、2.73和2.75倍。N0处理各器官中氮素含量显著最低,主要是移栽前幼苗本身氮素的积累和吸收土壤中少量的氮。
2.3 不同施氮量对菠萝蜜苗根系生长的影响
随着施氮量增加,每株菠萝蜜总根长、根系总表面积及根系体积均呈现降低的趋势(图1)。N1水平的总根长、根系总表面积及根系体积与N0无显著性差异。总根长、根系总表面积在不同氮素水平中均是N1>N2>N3(P<0.05)。根系体积在N2、N3水平之间无显著性差异,均显著低于N0和N1水平。N2、N3水平较N0减少总根长的比例分别为65.72%和79.10%,减少根系总表面积的比例分别为56.96%和74.08%,减少根系体积的比例分别为50.87%和69.25%。
2.4 不同施氮量下菠萝蜜幼苗营养指标与根系生长指标相关性分析
由图2可知,菠萝蜜幼苗总根长、根系总表面积、根系体积与地下部氮累积量和根冠比呈显著负相关,与地上部干重呈显著正相关;总氮累积量与地上部氮累积量呈极显著正相关;地下部干重与地上部氮累积量、总氮累积量以及地上部干重呈显著负相关;总干重与地上部干重呈极显著正相关,与地下部干重呈极显著负相关;根冠比与地上部干重、总干重呈极显著负相关,与地下部干重呈极显著负相关。
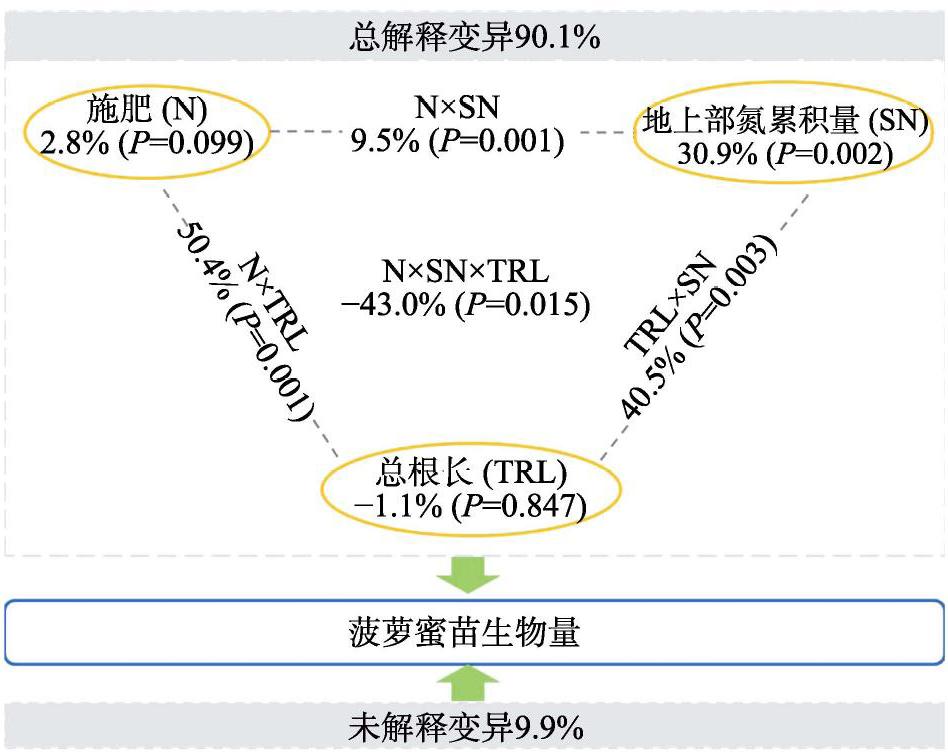
2.5 施肥、根系生长指标、氮素累积量对菠萝蜜苗生物量变化的贡献
以菠萝蜜苗生物量为基础,探究施肥、氮素累积量、根系生长指标对菠萝蜜苗生物量变化的贡献。使用Bioenv挑选出对菠萝蜜苗生物量变化起关键性作用的氮素累积量和根系生长指标为:地上部氮素累积量和总根长。变量分解分析(VPA)的结果如图3所示,施肥、地上部氮素累积量和总根长及它们共同解释菠萝蜜苗生物量变化的比例为90.1%。对于单个因子来说,施肥、地上部氮素累积量和总根长可解释菠萝蜜苗生物量变化的比例分别为2.8%(P=0.099)、30.9%(P=0.002)和?1.1%(P=0.847);施肥与地上部氮素累积量共同解释菠萝蜜苗生物量变化的比例为9.5%(P= 0.001),地上部氮素累积量和总根长共同解释菠萝蜜苗生物量变化的比例为40.5%(P=0.003),施肥同总根长共同解释菠萝蜜苗生物量变化的比例为50.4%(P=0.001),3个因子共同解释菠萝蜜苗生物量变化的比例为?43.0%(P=0.015)。
TRL:总根长;TRSA:根系总表面积;TRV:根系总体积;SN:地上部氮累积量;RN:地下部氮累积量;TN:总氮素累积量;DWS:地上部干重;DWR:地下部干重;TDW:总干重;RRS:根冠比。*表示不同处理间差异显著(P<0.05);**表示不同处理间差异极显著(P<0.01)。蓝色表示正相关,红色表示负相关,圆形的大小也说明了相关性的大小。
TRL: total root length; TRSA: total root surface area; TRV: total root volume; SN: shoot nitrogen; RN: root nitrogen; TN: total nitrogen; DWS: dry weight of shoot; DWR: dry weight of root; TDW: total dry weight; RRS: ratio of root/shoot. *indicates significant difference at 0.05 level; **indicates extremely significant difference at 0.01 level. Blue indicates a positive correlation, red indicates a negative correlation. The size of the circle indicates the magnitude of the correlation.
3 讨论
氮素水平直接影响作物干物质积累与分配,干物质积累量在一定范围内随施氮量的增加而增加[8-9]。本研究结果表明随着氮肥施用量的增加,菠萝蜜幼苗叶片、茎秆、地上部和整株生物量呈现先上升后下降的趋势,均在氮肥用量为5 g/株(N1)时达到最大值,当氮肥施用量超过10 g/株(N2)时,菠萝蜜苗叶片、根系、地上部和整株生物量与不施氮肥处理(N0)的值相当或更低,可能因施肥量过高,导致養分吸收受限。且本试验中未统计数据的N4处理,也因肥料浓度过高导致烧苗。地下部干重和根冠比均呈先下降后上升的趋势,在氮肥用量为N1时达到最小值。说明适量氮肥能有效促进菠萝蜜幼苗地上部分的生长,但施用量超过一定程度时,其对幼苗地上部生长的促进作用有所减弱。这与前人的研究结果相似,氮肥施用过多,地上部生长受限,向根茎分配的干物质减少,经济系数下降[10-12]。植物地上部及根系的相对生长速率受植物体内氮素营养状况有关信号的调节,在一定范围内,增加氮素供应可以促进地上部和根系的生长,但往往对地上部生长的促进作用大于根系[13]。合理施用氮肥可显著改善叶片的光合性能和植株的营养状况,从而促进了养分的同化、运输与合理分配[10]。本研究中氮素在各器官的分配量和分配比例随着施氮量的增加大致表现为:叶、茎先增加后降低的趋势;根先降低后增加的趋势;总氮素累积量呈先增加后降低的趋势。说明养分优先供应顺序为叶、茎>根。
有研究表明,根系参数变化对扩散抵达根表的养分有效性具有决定性作用,根的生长状况直接影响地上部的生长和营养状况及产量水平[14-15]。适量的氮肥能促进根系生长,增加根系与土壤的接触面积,进而促进对水分、养分的吸收[16-17]。本试验结果表明,氮肥用量为N1时,菠萝蜜幼苗总根长、根系总表面积和根系体积与不施氮肥无显著性差异,但随着施氮量的增加,菠萝蜜幼苗根系的生长明显受抑制。说明氮肥对根系的促生长作用是有一定范围的,在无氮情况下,根系为了吸收生长所需的氮素,反而促进了根系的生长[18-20],过高的氮反而对根系生长产生抑制作用[21-25]。另外,N2、N3水平下的总根长、根系总表面积及根系体积均低于N0和N1水平,而其根干重却高于N0和N1水平,这可能与较高氮浓度能够提高根系对氮的吸收量和积累量有关[26]。
不少研究发现,根系形态与地上部生长、养分吸收及产量形成存在显著的正相关关系[27-28]。本试验结果显示,菠萝蜜幼苗总根长、根系总表面积、根系体积与地上部干重呈显著正相关关系,这与孙浩燕等[29]在水稻苗期的研究结果一致。表明较大的总根长、根系总表面积、根系体积更能促进氮素运往地上部,对地上部和总干物质的积累具有重要作用。
施用氮肥对菠萝蜜幼苗氮素累积量、根系生长和生物量有显著影响。VPA分析表明影响菠萝蜜生物量变化的关键指标为地上部氮素累积量和总根长。其中地上部氮素累积量以及因子每2个间共同对菠萝蜜生物量变化的解释量均有显著性,其中施肥和总根长共同作用的解释量最大。不能被解释的部分可能是由于土壤理化因素、环境等其他自然因素。这也证明了前人的研究结果,施用氮肥通过影响总根长和地上部氮素累积量最终影响菠萝蜜幼苗生物量[30-31]。
综上所述,适量施用氮肥可以增加菠萝蜜幼
苗各器官氮素累积量和根系生长,最终增加菠萝蜜生物量。过量施用氮肥对植株生长产生一定程度的抑制。施肥、地上部氮素累积量和总根长对菠萝蜜苗生物量变化的贡献率达90.1%。本试验条件下,菠萝蜜幼苗适宜的施氮量为5 g/株(4个月),可作为菠萝蜜苗期施肥的参考值。
参考文献
[1]吴 刚, 陈海平, 桑利伟, 等. 中国菠萝蜜产业发展现状及对策[J]. 热带农业科学, 2013, 33(2): 91-97.
[2]白亭玉, 吴 刚, 郝朝运, 等. 海南菠萝蜜种植园土壤与叶片微量元素含量分析研究[J]. 热带农业科学, 2017, 37(7): 1-5.
[3]谭乐和, 吴 刚, 刘爱勤. 菠萝蜜高效生产技术[M]. 北京: 中国农业出版社, 2012.
[4]Crane J H, Balerdi C, Maguire I. Jackfruit growing in the Florida home landscape[J]. Fact Sheet HS-882, 2005: 1-10.
[5]Marschner H, Kirkby E, Cakmak I. Effect of mineral nutritional status on shoot~root partitioning of photoassimilates and cycling of mineral nutrients[J]. Journal of Experimental Botany, 1996, 47(Special): 1255-1263.
[6]杨建昌. 水稻根系形态生理与产量、品质形成及养分吸收利用的关系[J]. 中国农业科学, 2011, 44(1): 36-46.
[7]鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2000.
[8]Marcelis L F M. A simulation model for dry matter partitioning in cucumber[J]. Annals of Botany, 1994, 74(1): 43-52.
[9]Génard M, Lescourret F, Mimoun M B, et al. A simulation model of growth at the shoot-bearing fruit level. II. Test and effect of source and sink factors in the case of peach[J]. European Journal of Agronomy, 1998, 9(2-3): 189-202.
[10]徐 坤, 徐 峰. 氮肥对生姜生长及产量的影响[J]. 中国蔬菜, 1999(6): 12-14.
[11]Persson H, Ahlstr?m K, Clemensson-Lindell A. Nitrogen addition and removal at G?rdsj?n-effects on fine-root growth and fine-root chemistry[J]. Forest Ecology and Management, 1998, 101(1-3): 199-205.
[12]李德軍, 莫江明, 方运霆, 等. 模拟氮沉降对南亚热带两种乔木幼苗生物量及其分配的影响[J]. 植物生态学报, 2005(4): 543-549.
[13]史正军, 樊小林. 作物对氮素养分高效吸收的根系形态学研究进展[J]. 广西农业生物科学, 2003, 22(3): 225-229.
[14]门中华, 李生秀. 硝态氮浓度对冬小麦幼苗根系活力及根际pH值的影响[J]. 安徽农业科学, 2009, 37(1): 92-93.
[15]张福锁. 土壤与植物营养研究新动态(第1卷)[M]. 北京: 北京农业大学出版社, 1992: 73-82.
[16]李生秀, 李世清. 施用氮肥对提高旱地作物利用土壤水分
的作用机理和效果[J]. 干旱地区农业研究, 1994, 12(1): 38-46.
[17]王 艳, 米国华, 陈范骏, 等. 玉米氮素吸收的基因型差异及其与根系形态的相关性[J]. 生态学报, 2003, 23(2): 297-302.
[18]Seregin I V, Ivanov V B. Physiological aspects of cadmium and lead toxic effects on higher plants[J]. Russian journal of plant physiology, 2001, 48(4): 523-544.
[19]汪晓丽, 陶玥玥, 盛海君, 等. 硝态氮供应对小麦根系形态发育和氮吸收动力学的影响[J]. 麦类作物学报, 2010, 30(1): 129-134.
[20]Lawlor D W. Carbon and nitrogen assimilation in relation to yield: mechanisms are the key to understanding production systems[J]. Journal of Experimental Botany, 2002, 53(370): 773-787.
[21]刘世全, 曹红霞, 张建青, 等. 不同水氮供应对小南瓜根系生长, 产量和水氮利用效率的影响[J]. 中国农业科学, 2014, 47(7): 1362-1371.
[22]钟银宽, 茶正早, 罗 微. 土壤母质与氮素对橡胶苗根系生长影响研究[J]. 热带农业科学, 2009, 29(7): 1-4.
[23]主春福, 彭福田, 彭 静, 等. 不同施氮处理对平邑甜茶根系构型的影响[J]. 山东农业科学, 2008(4): 57-61.
[24]王树起, 韩晓增, 乔云发, 等. 施氮对大豆根系形态和氮素吸收积累的影响[J]. 中国生态农业学报, 2009, 17(6): 1069-1073.
[25]Forde B, Lorenzo H. The nutritional control of root development[J]. Plant and Soil, 2001, 232(1-2): 51-68.
[26]姜琳琳, 韓立思, 韩晓日, 等. 氮素对玉米幼苗生长, 根系形态及氮素吸收利用效率的影响[J]. 植物营养与肥料学报, 2011, 17(1): 247-253.
[27]樊剑波. 不同氮效率基因型水稻氮素吸收和根系特征研究[D]. 南京: 南京农业大学, 2008.
[28]蔡昆争, 骆世明, 段舜山. 水稻根系的空间分布及其与产量的关系[J]. 华南农业大学学报(自然科学版), 2003, 24(3): 1-4.
[29]孙浩燕, 王 森, 任 涛, 等. 不同施肥方式下氮肥用量对直播稻根系形态及氮素吸收的影响[J]. 中国土壤与肥料, 2017(6): 88-92.
[30]郑圣先, 聂 军, 戴平安, 等. 控释氮肥对杂交水稻生育后期根系形态生理特征和衰老的影响[J]. 植物营养与肥料学报, 2016, 12(2): 188-194.
[31]于晓芳, 高聚林, 叶 君, 等. 深松及氮肥深施对超高产春玉米根系生长、产量及氮肥利用率的影响[J]. 玉米科学, 2013, 21(1): 114-119.
