小麦麦麸多糖提取工艺及抗氧化活性研究
2019-07-22张倩
张倩

摘要:以小麦麦麸为原料,采用单因素和响应面试验确定麦麸多糖的最佳提取工艺,并对其抗氧化活性进行初步研究。结果表明,提取小麦麦麸的最佳工艺条件为提取时间45 min、提取温度95 ℃、料液比1 g ∶ 45 mL,此时麦麸多糖提取率为8.21%;小麦麦麸多糖清除DPPH·、·OH、O-2 · 等自由基的半抑制浓度(half maximal inhibitory concentration,IC50)分别为0.85、1.49、96.19 mg/mL,表明麦麸多糖具有一定的抗氧化能力。
关键词:小麦麦麸;响应面法;提取工艺;抗氧化活性;麦麸多糖;自由基
中图分类号: TQ914.1 文献标志码: A 文章编号:1002-1302(2019)11-0242-04
小麦是我国国民日常生活的主要粮食之一,小麦加工的主要副产物是麦麸,即在制粉过程中提取小麦粉和胚芽后的残留部分,以皮层为主,混入少量的胚芽和未剥刮干净的胚乳[1],约占小麦产量的20%[2-3]。小麦麦麸具有高营养价值,其中含有蛋白质、碳水化合物、矿物质和维生素等。研究表明,麦麸中含有大量多糖,其中戊聚糖占20%以上[4]。多糖是一类重要的生物活性物质,具有抗病毒、降血脂、抗辐射等功效作用[5-7]。此外,孙苏军等的研究发现,1 000 mg/kg 坦洋工夫红茶多糖可显著抑制荷瘤小鼠体内实体肿瘤的生长,抑瘤率可达66.30%,同时还能有效保护小鼠脾脏和胸腺[8];张贤益等的研究表明,白扁豆多糖可通过PI3K-Akt信号转导通路抑制神经细胞的缺氧性凋亡[9];萬慧洁等的研究表明,200 μg/mL红曲粗多糖能保护牛血清白蛋白(BSA)免受偶氮二异丁脒盐酸盐(AAPH)的氧化损伤[10];硫酸化迷果芹多糖能够有效清除各种自由基,提高其抗氧化活性[11];硒化的百合多糖能显著促进淋巴细胞的增殖,提高鸡外周血淋巴细胞白细胞介素(interleukin,IL)-2、IL-6和干扰素(interferon,IFN)-γ mRNA的表达,从而提高其免疫活性[12];近年来研究还发现,铁皮石斛多糖对机体的肠道免疫和结肠的健康也具有一定的促进作用[13-14]。
随着人们生活水平以及健康意识的不断提高,麦麸中的多糖活性作用已逐渐成为人们所关注的重点,我国小麦种植广泛,小麦麦麸来源充足且价格低廉,不仅能应用于饲料领域,更应在发酵以及功能食品领域深度开发以提高其经济价值。本试验采用水提法制备麦麸粗多糖,并考察其体外抗氧化活性,旨在为麦麸及其多糖的开发利用提供理论参考依据。
1 材料与方法
1.1 材料和试剂
试验材料为小麦麦麸,市售。1,1-二苯基-2-三硝基苯肼(DPPH),购于Sigma公司;无水葡萄糖、苯酚、无水乙醇等,均为分析纯。
1.2 主要仪器
DK-S22恒温水浴锅,购自上海精宏实验设备有限公司;UV1000紫外可见分光光度计,购自北京瑞利分析仪器有限公司。
1.3 试验方法
1.3.1 麦麸原料预处理 麦麸放置于烘箱中干燥24 h,随后将麦麸经粉碎机粉碎成粗颗粒状置于干燥器中备用。
1.3.2 麦麸多糖提取工艺 麦麸粉碎→加水浸提2次→多层纱布过滤→合并滤液→滤液经旋转蒸发浓缩→75%乙醇沉淀→4 ℃静置过夜→离心→多糖沉淀复溶→再次乙醇沉淀→离心→冷冻干燥→麦麸粗多糖。
1.3.3 麦麸多糖含量测定 采用苯酚-硫酸法[15]测定多糖含量,再进一步计算出麦麸多糖提取率,计算公式如下:多糖提取率=粗多糖质量/原料质量×100%。
1.3.4 单因素对麦麸多糖提取率的影响 准确称取1.0 g麦麸,分别设定料液比为1 g ∶ 10 mL、1 g ∶ 20 mL、1 g ∶ 30 mL、1 g ∶ 40 mL、1 g ∶ 50 mL,提取温度为60、70、80、90、100 ℃,提取时间为10、20、30、40、50 min;在单因素试验的基础上,进行响应面试验设计,确定热水浸提麦麸多糖的最佳提取工艺参数。
1.3.5 响应面法优化提取工艺 采用Box-Behnken响应面法对麸皮多糖的提取工艺条件进行优化。在单因素试验基础上,以多糖提取率为指标,以多糖提取的液料比、提取温度、提取时间为影响因素,设计3因素3水平试验,以确定麸皮多糖的最佳提取工艺条件。试验因素和水平设计见表1。
1.3.6 麦麸多糖抗氧化活性研究
1.3.6.1 DPPH·清除能力测定 配制浓度为 0.2 mmol/L DPPH-乙醇溶液。取不同浓度(0.1、0.2、0.4、0.6、0.8、1.0、1.2、1.4 mg/mL)麦麸多糖溶液于DPPH-乙醇溶液中,室温下静置30 min后于517 nm处测定吸光度[16]。清除率=[1-(D2-D1)/D0]×100%。式中:D2为多糖样液的吸光度;D1为无水乙醇代替DPPH测得的吸光度;D0为无水乙醇代替多糖溶液测得的吸光度。采用同样方法测定维生素C清除DPPH·的能力。
1.3.6.2 羟自由基清除能力测定 采用Fenton反应体系法[17]测定羟基自由基(·OH)的清除率。分别在试管中加入9 mmol/L FeSO4溶液、9 mmol/L水杨酸-乙醇溶液以及不同浓度(0.1、0.2、0.4、0.6、0.8、1.0、1.2、1.4 mg/mL)麦麸多糖的样品溶液,最后加入8.8 mmol/L H2O2,充分反应,在 510 nm 处测定吸光度。清除率=(D0-Dx)/D0×100%。式中:D0为空白对照的吸光度;Dx为多糖样液的吸光度。采用同样方法测定维生素C清除·OH的能力。
1.3.6.3 超氧阴离子清除能力测定 采用邻苯三酚自氧化法[18]测定超氧阴离子自由基( O-2 · )的清除率,有所改动。取 0.05 mmol/L pH值为8.2的Tris-HCl缓冲液于25 mL具塞比色管中,分别加入不同浓度(10、20、40、60、80、100、120、140 mg/mL)的麦麸多糖样液,放入25 ℃水浴中预热20 min,加3 mmol/L邻苯三酚0.4 mL,混合均匀后反应5min,加入2滴8 mol/L HCl溶液终止反应,在325 nm波长处测定吸光度。清除率=(D0-Di)/D0×100%。式中:D0为空白对照的吸光度;Di为多糖样液的吸光度。采用同样的方法测定维生素C清除 O-2 · 的能力。
2 结果与分析
2.1 麦麸中的多糖含量
以葡萄糖为标准,用苯酚-硫酸法测定麦麸多糖含量的线性回归方程,即y=14.839x+0.094 3,r2=0.995 1。
2.2 单因素试验结果
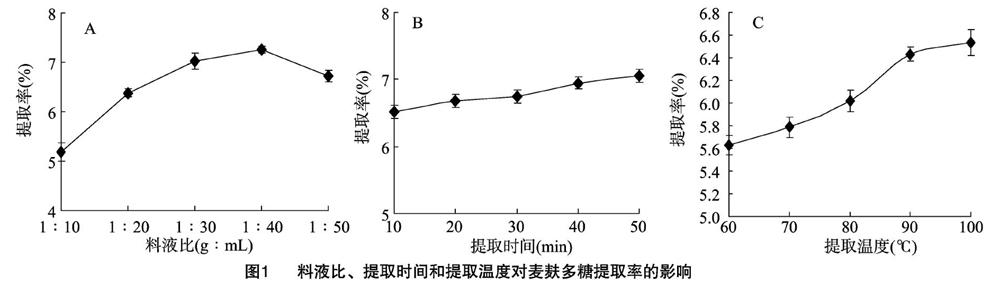
2.2.1 料液比对麦麸多糖提取率的影响 由图1-A可知,麦麸多糖的提取率随料液比的增加而增加,当料液比达到 1 g ∶ 40 mL 时,麦麸多糖的提取率达到最大值;当料液比继续增大,提取率逐渐下降。这可能由于溶剂用量影响多糖浸出溶液的浓度差,從而改变原料内部与外部之间多糖的传质过程[19]。因此选择适宜的料液比为1 g ∶ 30 mL、1 g ∶ 40 mL、1 g ∶ 50 mL作后续响应面试验。
2.2.2 提取时间对麦麸多糖提取率的影响 由图1-B可知,麦麸多糖提取率随提取时间的增加而缓慢增大,提取 50 min 时,提取率达到最大,为7.05%。因此选择提取时间30、40、50 min作后续响应面试验。
2.2.3 提取温度对麦麸多糖提取率的影响 由图1-C可知,随着提取温度的升高,麦麸多糖提取率逐步增加,在60~90 ℃ 之间,提取率增加较明显,在90~100 ℃之间上升较缓慢,并趋于稳定达到最大值,这表明提取温度较高时较利于多糖的溶出,这是由植物多糖的性质决定的,大多数植物多糖易溶于热水而难溶于冷水[20]。因此提取温度选择80、90、100 ℃ 作后续响应面试验。
2.3 麦麸多糖提取的响应面结果分析
2.3.1 响应面试验设计及结果 采用Design Expert 8.0.6b统计分析软件进行试验设计,中心组合设计共17组试验,其中5组为中心点试验,用来评估整体优化试验中出现的误差,其余12组是析因试验。以A提取时间(min)、B料液比(g ∶ mL)、C提取温度(℃)为自变量,以多糖提取率(Y)为响应值,试验结果如表2所示。用Design Expert 8.0.6软件对优化试验得到的结果进行分析,按各因素对试验结果的影响进行拟合得到二次方程式:Y=-43.344 25-0.609 85A+0.535 53B+1.135 27C+1.375 00×10-3AB+4.275 00×10-3AC+2.150 00×10-3BA+2.220 00×10-3A2-9.255 00×10-3B2-7.655 00×10-3C2。
对该模型的方差及显著性进行分析,结果见表3,整体模型的F值是19.06,并且多元二次响应面回归模型的P值为0.000 4,拟合效果极显著(P<0.01),失拟项P值为 0.191 7,拟合效果不显著(P>0.05),说明响应面法拟合得到的试验模型显著性高;R2=0.910 4,表明预测值与真实值有较高的相关性,试验可操作性较好。各单因素中料液比对麦麸多糖提取率有极显著影响,其影响表现为料液比>提取温度>提取时间。
2.3.2 响应面分析 响应曲面图可以表示试验因素的每个水平之间与响应值的函数关系,同时可直观地获取试验设计中的最优工艺参数。由图2可以看出,料液比与提取时间、提取温度与提取时间、提取温度与料液比对麸皮多糖提取率的影响表现为明显的二次抛物线,呈交互作用。从响应面的最高点和等值线可以看出,选择范围内的极值,即是响应面的最高点,也是等值线最小椭圆的中心点。通过对响应面图的陡峭程度分析可知,料液比对麦麸多糖提取率的影响最大,其次为提取温度,提取时间对麦麸多糖提取率的影响最小,这与上述方差分析的结果一致。
2.3.3 最佳提取工艺条件的预测与验证 通过软件分析,预测的热水浸提法提取麸皮多糖的最佳工艺条件:提取温度为94.44 ℃, 提取时间为45.16 min,料液比为 1 g ∶ 43.65 mL;在此条件下麦麸多糖提取率为8.13 %。因实际操作需要,调整为提取温度95 ℃,提取时间45 min,料液比1 g ∶ 45 mL,为检验模型是否可靠,对上述修改后的提取条件作3次重复验证试验,测得麦麸多糖提取率为8.21%,相对误差为0.98%,结果表明,响应面优化得到的提取工艺条件可信。
2.4 麦麸多糖的抗氧化活性
2.4.1 麦麸多糖对DPPH·的清除能力 活性成分对 DPPH·清除率越大,表明该物质抗氧化效果越佳。由图3-a可知,维生素C对DPPH·具有很好的清除能力,而与维生素C相比,麦麸多糖对DPPH·的清除能力较弱,但也表现出一定的清除效果;在0.1~1.2 mg/mL的浓度范围内,麦麸多糖对DPPH·的清除能力随浓度的增加而逐渐增强,当浓度达到1.2 mg/mL后,其自由基清除能力逐渐趋于平稳,这主要是因为溶液浓度达到一定时,对自由基的清除能力达到饱和。当麦麸多糖浓度增加至 1.4 mg/mL 时,其清除率达到最大值,为61.63 %,半抑制浓度(IC50)为0.85 mg/mL;说明麦麸多糖有一定清除DPPH·的能力,但弱于维生素C。
2.4.2 麦麸多糖对·OH的清除能力 由图3-b可知,随着麦麸多糖浓度增加,其对·OH的清除能力增强;当麦麸多糖浓度为1.40 mg/mL时,清除率达到最大值,为 51.44%,其IC50为1.49 mg/mL,但弱于同浓度下维生素C的清除能力。
2.4.3 麦麸多糖对 O-2 · 的清除能力 由图3-c可知, 麦麸多糖对 O-2 · 有一定的清除能力, 随着麦麸多糖浓度的增加,对 O-2 · 的清除作用增强,当麦麸多糖浓度为140 mg/mL时,其清除率为61.88%,弱于同浓度下维生素C的清除能力,其IC50为96.19 mg/mL。
3 结论
采用单因素试验与响应面试验相结合的方法,对小麦麦麸多糖的提取工艺条件进行了优化,并对其抗氧化能力进行初步评价。采用Design Expert 8.0.6软件对试验结果进行多元回归分析,获得的小麦麦麸多糖二次多项回归方程为Y=-43.344 25-0.609 85A+0.535 53B+1.135 27C+1.375 00×10-3AB+4.275 00×10-3AC+2.150 00×10-3BA+2.220 00×10-3A2-9.255 00×10-3B2 -7.655 00×10-3C2;得到小麦麦麸多糖提取最佳工艺条件为提取时间45 min、提取温度95 ℃、料液比1 g ∶ 45 mL,此时麦麸多糖提取率为8.21%。抗氧化活性测定结果表明,小麦麦麸多糖具有较好的抗氧化活性,其对DPPH·、·OH和 O-2 · 的IC50分别为0.85、1.49、96.19 mg/mL,这与王忠合等的研究结果[21-22]相一致,表明小麦麦麸多糖具有较强的抗氧化能力,可作为一种具有开发潜力的天然抗氧化剂新资源,应用于食品和医药行业中。
参考文献:
[1]李全宏,陶国琴,付才力,等. 麦麸中生理活性物质研究与应用进展[J]. 食品科学,2004,25(8):196-200.
[2]郭祯祥,李利民,温纪平. 小麦麸皮的开发与利用[J]. 粮食与饲料工业,2003(6):43-45.
[3]王旭峰,何计国,陶纯洁,等. 小麦麸皮的功能成分及加工利用现状[J]. 粮食与食品工业,2006,13(1):19-22.
[4]朱翠玲,顾正中,沈 婷,等. 响应面分析优化小麦麸皮多糖的提取工艺[J]. 江苏农业科学,2017,45(13):169-172.
[5]Matsumura Y,Egami M,Satake C,et al. Inhibitory effects of peptide-bound polysaccharides on lipid oxidation in emulsions[J]. Food Chemistry,2003,83(1):107-119.
[6]孙元琳,陕 方,刘惠芳,等. 黑小麦麦麸多糖的制备与分析[J]. 中国粮油学报,2010,25(6):94-97.
[7]王应想. 甘薯藤活性多糖的分离、纯化及功能研究[D]. 南昌:南昌大学,2005.
[8]孙苏军,纪海玉,白 云,等. 坦洋工夫红茶多糖提取工艺优化及其抑制肿瘤活性分析[J]. 食品科学,2018,39(4):254-260.
[9]张贤益,李文娟,钟 亮,等. 白扁豆多糖对神经细胞缺氧性凋亡的保护机制研究[J]. 食品科学,2018,39(3):222-228.
[10]万慧洁,任 虹,黄霈轩,等. 红曲多糖的提取工艺优化及其对蛋白氧化损伤的保护作用[J]. 食品科学,2018,43(1):198-202.
[11]Xu Y F,Song S,Wei Y X,et al. Sulfated modification of the polysaccharide from Sphallerocarpus gracilis and its antioxidant activities[J]. International Journal of Biological Macromolecules,2016,87:180-190.
[12]Hou R R,Chen J,Yue C J,et al. Modification of lily polysaccharide by selenylation and the immune-enhancing activity[J]. Carbohydrate Polymers,2016,142:73-81.
[13]Xie S Z,Liu B,Zhang D D,et al. Intestinal immunomodulating activity and structural characterization of a new polysaccharide from stems of Dendrobium offcinale[J]. Food & Function,2016,7(6):2789-2799.
[14]Zhang G Y,Nie S P,Huang X J,et al. Study on Dendrobium offcinale O-acetyl-glucomannan(Dendronan):part Ⅶ.Improving effects on colonic health of mice[J]. Journal of Agricultural and Food Chemistry,2015,64(12):2485-2491.
[15]梁 琰,趙志国,张敏敏,等. 超声辅助提取苯酚-硫酸法测定野生平盖灵芝多糖含量[J]. 食品研究与开发,2018,39(16):125-129.
[16]张惟杰. 糖复合物生化研究技术[M]. 杭州:浙江大学出版社,1999.
[17]申翔宇,徐 玲,黄雅婷,等. 响应面法优化绿萝花多糖提取及抗氧化活性[J]. 食品科技,2018,43(1):203-209.
[18]汤慧民,李茂兴. 微波辅助提取核桃壳多糖及其抗氧化活性研究[J]. 中国油脂,2018,43(5):123-126.
[19]杨申明,王振吉,陈 文,等. 藤三七多糖超声波辅助提取工艺及抗氧化性研究[J]. 食品研究与开发,2017,38(11):32-38.
[20]夏 宇. 生姜皮多糖的分离纯化、结构分析及其抗氧化活性研究[D]. 南京:南京农业大学,2016.
[21]王忠合,钟丽娴. 麦麸活性多糖的提取、组成及其抗氧化性研究[J]. 食品工业科技,2009,30(7):115-119.
[22]王 军,王忠合,章 斌,等. 麦麸多糖理化特性与抗氧化性分析[J]. 食品研究与开发,2015,36(7):18-22.
