PTD-FNK蛋白对猪精子的冷冻保护作用及其机制
2019-07-22李丹丹刘蛟王英群
李丹丹 刘蛟 王英群
摘要:为评估PTD-FNK蛋白对猪精子冻后质量的影响,以探讨其可能的作用机制。在猪精液冷冻稀释液中添加不同浓度(0、0.1、1、10、100 nmol/L)的PTD-FNK蛋白,采用精子图像分析仪分析冻后猪精子的质量,使用流式细胞仪检测冻后精子Annexin V-FITC/PI染色后的凋亡情况,利用相对荧光定量PCR和多功能酶标仪检测不同凋亡途径中精子相关基因的表达量变化或含半胱氨酸的天冬氨酸蛋白水解酶(caspase)的活性和染色后线粒体mPTP开放性。结果表明,与对照组相比,10 nmol/L PTD-FNK蛋白试验组猪精子冻后活性、活率和顶体完整率均显著升高(P<0.05,P<0.01),凋亡率和Bax、caspase-3、caspase-9基因表达量、caspase-9蛋白酶活性、mPTP开放性均显著降低(P<0.05)。说明PTD-FNK可能通过线粒体内源性凋亡途径抑制冻融猪精子的凋亡。
关键词:PTD-FNK;猪;精子;凋亡;冷冻保护
中图分类号: S828.3+4 文献标志码: A 文章编号:1002-1302(2019)11-0217-05
隨着人工授精技术成为现代常见的辅助生殖技术,冷冻精液技术得到广泛应用,提高冷冻精液质量也就成为当今研究热点。自1975年起,猪精子冷冻方面的研究开始出现,近几年猪精液冷冻快速发展,技术不断提高,但在公猪育种的商业化进程中未取得相应的进展[1],且猪冷冻精液的人工授精使用率仅约1%。精子在液氮保存下,代谢水平低,其活力几乎处于停滞水平,解冻后能使其恢复活力而又不失去在母畜体内的受精能力。但低温冷冻对精子的损伤较大,导致精子活力降低,仅有50%的精子存活,而存活的精子活力不能达到人工授精标准[2]。猪精液对环境变化非常敏感[3],技术仍有许多急需攻克的难关,与实际生产应用仍有一定差距,所以关于改进猪精子低温保存条件,发现冷冻保存破坏精子细胞功能的机制就成为现今需要解决的问题。在人工受精的应用上,冷冻精液与新鲜精液相比,受胎率和窝产仔数都出现下降现象。因此,为提高冻后精子质量,应寻求一种更为有效的稀释液。
PTD-FNK蛋白是人工构建的抗凋亡蛋白[4],其对不同类型细胞(神经元、软骨细胞、肝细胞、骨髓单核细胞等)受到的多种损伤刺激都有较好的防御作用,包括保护冷冻、解冻对细胞的损伤[5]。添加300 nmol/L PTD-FNK蛋白是有效提高猪精子抗冻能力的方法[6],但其蛋白产量小且用量多。故本实验室经过多重努力,成功构建并可溶性表达PTD-FNK蛋白,得到有生物活性的PTD-FNK蛋白[7]。
根据含半胱氨酸的天冬氨酸蛋白水解酶(caspase)不同激活途径,将凋亡激活途径分为3种,死亡受体途径(caspase-8)、线粒体途径(caspase-9)以内质网途径(caspase-12)[8]。内源性线粒体途径主要通过活化caspase-9,进一步激活caspase-3而产生caspase的一系列级联效应;外源性死亡受体途径,影响因子主要包括Fas和TNF等,产生有活性的caspase-8激活下游caspase级联效应;与线粒体途径同属于内源性细胞凋亡途径的内质网途径,通过内质网的应激反应已经对钙离子的调控参与细胞凋亡活动[9]。3个途径共同参与凋亡信号的传导,引起细胞严重凋亡。本研究通过Annexin V-FITC/PI染色法检测细胞凋亡,相对荧光定量PCR技术检测不同凋亡途径中相关凋亡基因的表达量,借助caspase的活性初步判断PTD-FNK保护冻融精子的路径,并进一步检测该路径膜孔道的变化,进而分析确定PTD-FNK保护冻融猪精子的主要途径,初步探索PTD-FNK蛋白对冻融精子的保护机制。
1 材料与方法
1.1 主要试剂与仪器
PTD-FNK蛋白,由广西大学动物科学技术学院解剖实验室保存提供。caspase-8、caspase-9荧光检测试剂盒,购自江苏凯基生物技术股份有限公司;caspase-12 Fluorometric Assay Kit,购自BioVision公司;BCA蛋白浓度测定试剂盒和细胞线粒体分离试剂盒,均购自碧云天生物技术研究所;纯化线粒体膜通道孔(mPTP)荧光检测试剂盒,均购自美国Genmed公司;FITC Apoptosis Detection KitⅠ,购自美国BD公司;HiScript Ⅱ Q RT SuperMix for qPCR,购自南京诺唯赞生物科技有限公司;SYBR Premix DimerEraserTM(Perfect Real Time),购自TaKaRa公司。
Digitcool程序化自动冷冻仪及SCA自动精液分析仪,购自法国卡苏公司;SD-2数码液晶显微镜,购自深圳泰宇星光电仪器有限公司;Tecan Infinite 200 Pro多功能酶标仪,购自瑞士Tecan公司;BD AccuriTM C6流式细胞仪,购自美国BD公司;CFX96 TouchTM荧光定量PCR检测系统,购自BIO-RAD公司。
1.2 精液采集
精液采自广西科达畜禽改良有限责任公司的健康、正常采精的长白(Landrace)种公猪。经常温稀释液1 ∶ 1等温稀释后,0.5 h内运至广西畜禽品种改良站实验室进行后续试验。选取镜检活力>0.8的精液,冷冻保存。
1.3 冷冻稀释液配制
冷冻基础液(TCG):葡萄糖60 nmol/L,柠檬酸 75 nmol/L,Tris 200 nmol/L,1%青链霉素,调节pH值至6.8,0.22 μm滤器过滤后置于4 ℃保存。冷冻Ⅰ液:将80%TCG液和20%卵黄液(新鲜卵黄10 000 r/min离心15 min后取上清液待用)充分混合搅拌均匀;取冷冻Ⅰ液,分别加入PTD-FNK蛋白,使得PTD-FNK蛋白终浓度为0.1、1、10、100 nmol/L。冷冻Ⅱ液:91%TCG液与9%甘油上下颠倒充分混合。
1.4 精液的冷冻与解冻
将精液1 200 r/min离心6 min,去上清,取精液与冷冻Ⅰ液等体积混匀,置于常温下孵育30 min,加入同等体积的冷冻Ⅱ液,使精液、冷冻Ⅰ液和冷冻Ⅱ液的比例为1 ∶ 1 ∶ 1,分装于0.25 mL塑料细管封口,2 h内按预设温度梯度降温至 5 ℃,置5 ℃平衡2 h。将细管取出,检查平衡后活力合格,放入程序降温仪内,程序运行结束后,马上将细管投入液氮保存。解冻时,将细管投入62 ℃水中5 s,轻轻晃动。擦除表面水珠,并剪开两端。
1.5 精子质量检测
1.5.1 精子活力、活率 各取10 μL冻融精液于37 ℃预热的载玻片上,使用精子图像分析仪进行分析。
1.5.2 顶体完整性 取冻后精子于3.7%多聚甲醛中固定,考马斯亮蓝染色后,取20 μL精子悬液置于血球计数板上,随机选取400×普通光学显微镜5个视野进行观察,计算200个以上精子的顶体完整率。
1.5.3 质膜完整性 取果糖-柠檬酸钠低渗溶液稀释将解冻后的精子稀释,并将精子密度调整为1×106个/mL,37 ℃下孵育30 min后,取20 μL精子悬液置于血球计数板上,随机选取400×普通光學显微镜5个视野进行观察,计数200个以上精子的质膜完整性。
1.6 FITC Annexin V/PI双标记检测精子凋亡
根据FITC Annexin V/PI双标记试剂盒说明,预冷PBS洗涤精子2次后,以1×的结合缓冲液重悬精子,并调整细胞浓度为1×106个/mL。取100 μL精子悬液,分别加入5 μL FITC Annexin V和5 μL PI混匀,避光室温孵育15 min,再加入400 μL 1×结合缓冲液,利用流式细胞仪检测每个精子的前向角散光(ESC)和侧向角散光(SSA)。用波长为520 nm通带滤器检测FITC荧光(FL1),波长>610 nm滤器检测PI(FL3),每样本收集20 000个精子荧光信号。采用BD AccuriTM C6自带软件初步分析,Flow-jo软件分析流式结果并作图。
1.7 总RNA提取和反转录
取冻融后的精子,用Trizol法提取RNA,RNase free ddH2O溶解,测D260 nm值为1.8~2.0可用。用HiScript Ⅱ Q RT SuperMix for qPCR[+gDNA wiper(基因组消除酶)]进行反转录,样品于 -80 ℃ 保存待用。
1.8 qRT-PCR
选取NCBI上猪精子凋亡部分基因的cDNA序列设计引物,以β-actin为基因。相关引物信息见表1。用SYBR Premix DimerEraserTM进行Real Time PCR。反应体系:SYBR Premix DimerEraser(2×)12.50 μL,上、下游引物各0.75 μL,cDNA模板2.00 μL,加ddH2O至25.00 μL体系。反应条件:95 ℃预变性30 s;95 ℃变性5 s,退火30 s(Tm均为60 ℃),72 ℃ 延伸30 s,45个循环,退火并收集荧光,每个样品重复3次。
1.9 冻融精子Caspase蛋白酶活性检测
取冻融后的精子,PBS洗涤2次,调整细胞数为5×106个,加入200 μL预冷的裂解液,充分裂解离心后使用BCA法测定蛋白浓度。吸取30 μL含100 μg蛋白的裂解液上清,参照caspase荧光检测试剂盒加入反应液,37 ℃下孵育1.5 h,使用多功能酶标仪测定3条通路关键caspase(caspase-8、caspase-9、caspase-12)的荧光强度(激发 λ=485 nm,发射λ=535 nm)。
1.10 冻融精子线粒体膜通道孔开放性检测
取冻融后的精子,预冷PBS洗涤后,参照线粒体分离试剂盒说明进行精子线粒体的提取,取100 μL线粒体样本(总含量0.2 mg),按照纯化线粒体膜通道孔荧光检测试剂盒说明加入反应液染色,移取100 μL悬液到黑色96孔板,置于多功能酶标仪中检测RFU的变化(激发λ=488 nm,发射λ=525 nm)。
1.11 数据处理
数据采用SPSS 22.0进行多重分析,试验结果以“x±s”表示,P<0.05为差异显著,P<0.01为差异极显著。采用Excel软件和Flow jo软件分析结果并作图。qRT-PCR以 β-actin 作为内参基因,试验组各基因的相对表达量采用2-ΔΔCT法计算。
2 结果与分析
2.1 PTD-FNK蛋白对猪精子冻后质量的影响
由表2可知,与对照组精子活力相比,0.1 nmol/L组无显著差异(P>0.05),1、10、100 nmol/L组显著升高(P<0.05)。与对照组活率相比,0.1 nmol/L组无显著差异(P>0.05),1、100 nmol/L组显著升高(P<0.05),10 nmol/L组有极显著升高(P<0.01)。与对照组相比, 0.1、 1、100 nmol/L组的顶体完整率无显著差异(P>0.05),10 nmol/L组显著升高(P<0.05)。与对照组精子质膜完整性相比,各试验组均无显著差异(P>0.05)。
2.2 PTD-FNK蛋白对冻后精子凋亡的影响
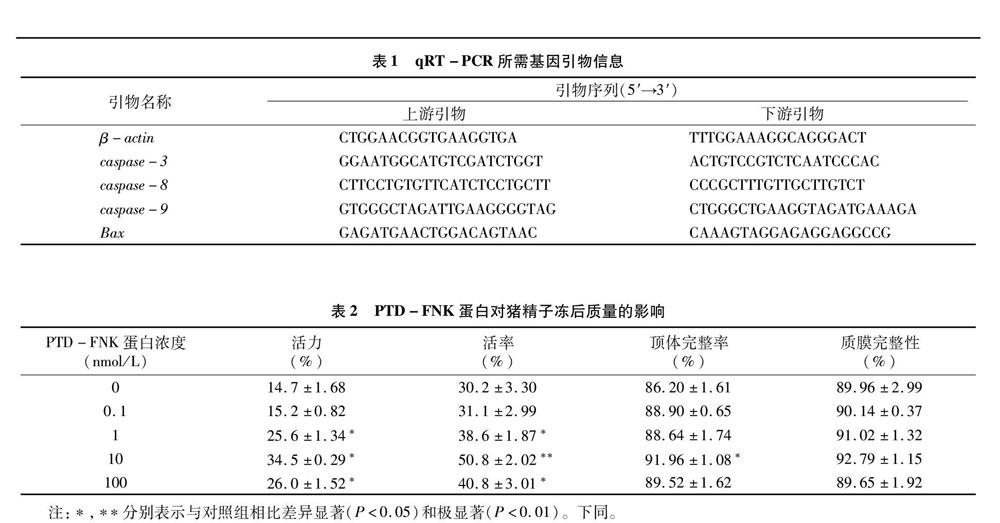
由图1可知,其中Q1:AV+-PI+内为已经坏死的精子,Annexin V和PI均为阳性,该象限内精子质膜的完整性还是在一定程度上得到维持但质膜渗透性受到损伤;Q2:AV--PI+为凋亡晚期精子,该象限内精子质膜结构可能已被打破或丢失,质膜结构已不完整,导致Annexin V反应呈现阴性;Q3:AV+-PI-为凋亡早期精子,有活性的精子,Annexin V为阳性而PI为阴性,该象限内的精子仍处于完整的质膜结构状态,但是质膜内侧的磷脂酰丝氨酸(PS)部分已经开始转移到细胞膜的外侧,呈现出早期凋亡状态;Q4:AV--PI-为凋亡早期精子,Annexin V和PI均为阴性,该象限内质膜的结构和功能都保持完好。可见,添加PTD-FNK蛋白10 nmol/L试验组的凋亡率(Q2+Q3)显著低于对照组(P<0.05)。
2.3 PTD-FNK蛋白对冻后精子凋亡相关基因mRNA表达的影响
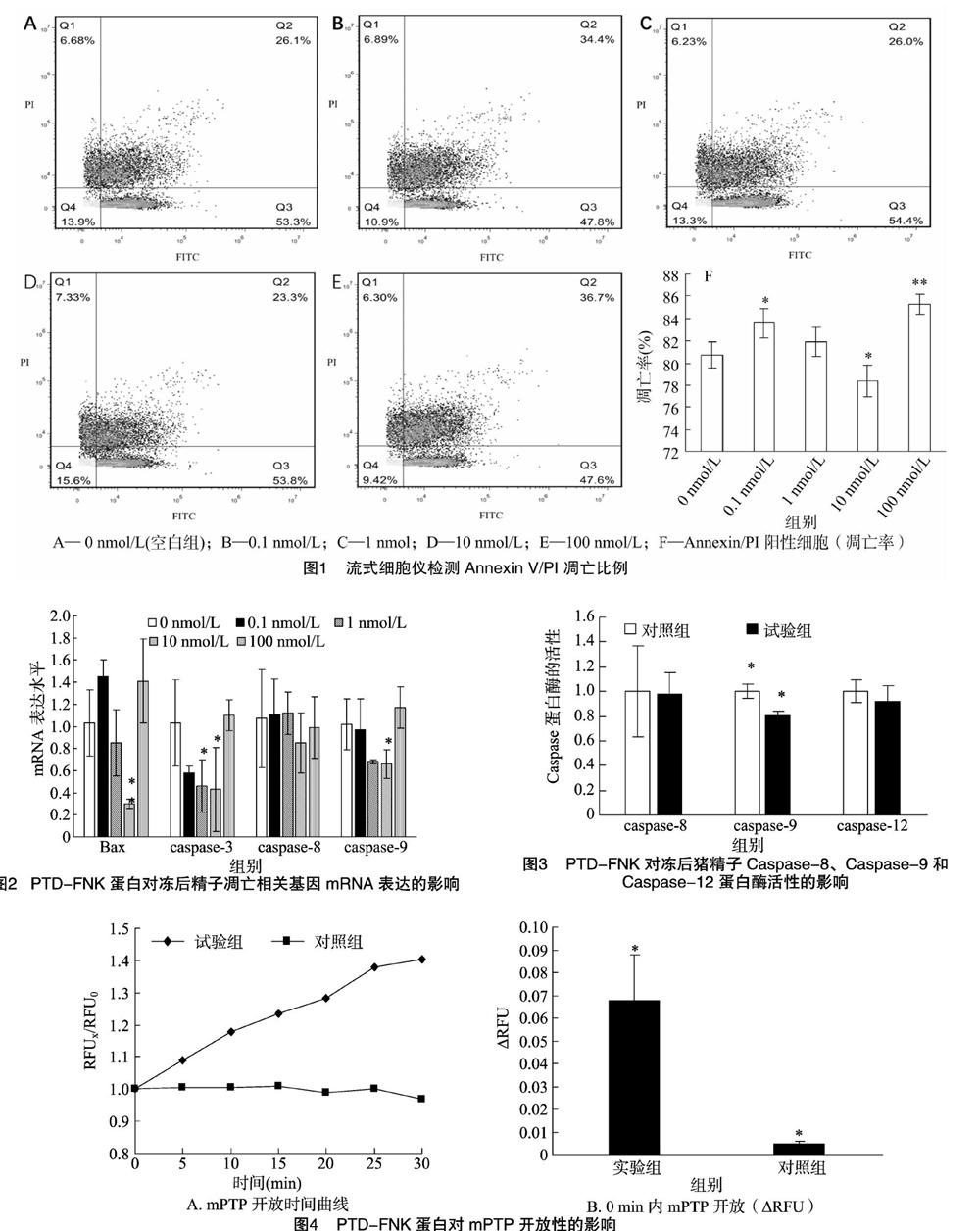
采用β-actin基因作为管家基因,对照组各基因mRNA的相对表达量均以1表示,比較各试验组与对照组凋亡相关基因mRNA表达的差异。由图2可知,10 nmol/L试验组caspase-3及caspase-9表达量显著下降(P<0.05),Bax表达量极显著下降(P<0.01),死亡受体通路关键基因 csapase-8表达量与对照组相比无显著差异(P>0.05)。
2.4 PTD-FNK蛋白对冻后精子caspase活性的影响
由图3可知,与对照组相比,10 nmol/L试验组冻后精子线粒体通路关键蛋白酶caspase-9活性显著下降(P<0.05),而死亡受体通路关键蛋白酶caspase-8及内质网通路关键蛋白酶caspase-12活性无显著差异(P>0.05)。
2.5 PTD-FNK蛋白对冻后精子mPTP通道开放性的影响
由线粒体膜内外成分构成的线粒体膜通道(mitochondrial permeability transition pore,mPTP)是非特异性钙离子依赖性通道。在凋亡细胞,线粒体内容物可通过mPTP释放到胞浆中。线粒体膜通道的持续开放可导致细胞色素C释放至细胞浆中,并造成细胞线粒体跨膜电位的降低。钙黄绿素-AM是一种荧光探针,当探针进入线粒体后会被内酯酶切离而被线粒体俘获,从而产生荧光较强的钙黄绿素。存在于线粒体外的钙黄绿素可以利用离心或者钴离子淬灭,检测线粒体内钙黄绿素荧光强度变化可以间接表明mPTP开放程度。由图4可知,与对照组相比,10 nmol/L PTD-FNK蛋白组冻后精子线粒体膜通道孔开放性检测结果RFU值显著升高(P<0.05)。
3 讨论
本试验从冻融精子的表观质量出发,以Annexin V/PI染色及mRNA表达量为基础,筛选PTD-FNK蛋白对冷冻子保护的最优浓度,通过caspase的活性初步筛选PTD-FNK保护冻融精子的路径,并进一步检测该路径膜通道的变化,初步探索PTD-FNK蛋白对冻融精子的保护机制。有研究表明,冻融猪精子质膜、顶体和线粒体等结构发生变化,精子结构的完整性遭到一定程度破坏,影响到了精子的正常代谢及正常生理功能的发挥,进而影响到受精能力[10]。由表2可知,与对
照组相比,PTD-FNK蛋白的冻融猪精子的活力、活率、顶体完整率均显著升高,说明10 nmol/L PTD-FNK蛋白就能够有效保护冻融猪精子。而当其浓度升高至 100 nmol/L 时,与对照组并无显著性差异。这与Shimokawa等研究的 300 nmol/L 的最优浓度[6]相比,PTD-FNK蛋白的使用量明显减少。
细胞凋亡是一个复杂的过程,包括诱导、执行及降解3个主要步骤,质膜磷脂酰丝氨酸(PS)位置的外移[11]是细胞凋亡过程中的特征性现象[12]。由图1可知,通过流式细胞仪检测PS与Annexin-V的结合以及PI检测,添加10 nmol/L PTD-FNK蛋白使猪冻融精子的凋亡比率显著降低,说明其在该浓度下可抑制冻融猪精子的凋亡,该结果与表观质量结果相吻合。研究表明,由线粒体介导的内源性凋亡途径中[13],Bax可以促进mPTP的开放而促进凋亡[14]。由图2中的mRNA表达量可知,添加10 nmol/L PTD-FNK蛋白对线粒体通路相关基因Bax和caspase-9有明显的下调作用。下游基因凋亡执行者caspase-3是细胞凋亡的关键之一,它的激活标志着细胞凋亡进入不可逆的进程[15]。
由上述几个结果推测,10 nmol/L是PTD-FNK的最优浓度,能够有效地抑制冻融猪精子凋亡,同时提示其保护作用可能与线粒体内源性途径有关。细胞凋亡是影响冻后精子质量的主要因素,它显著影响冻后精子的活力,caspase高活性表达的精子预示其对抗低温环境的能力也较弱[16],结合前面的研究,选取最优浓度10 nmol/L为研究浓度,以及caspase系列3个通路代表检测其蛋白酶活性。同时,有研究表明冷冻损伤造成的凋亡不涉及非caspase蛋白酶为依赖途径,而是由线粒体途径介导[17]。由图3可知,线粒体的代表蛋白酶caspase-9也发生明显下调。值得注意的是,caspase-8不管在蛋白酶活性或者基因表达量上均与对照组无显著性差异,这与Shimokawa等的研究[6]是一致的。在内质网凋亡途径中caspase-12起着至关重要的作用[14,18],本研究对内质网途径相关蛋白酶caspase-12活性的检测,与对照组无显著差异,结合mRNA表达结果可推测PTD-FNK对冻融精子的抗凋亡作用有可能是通过阻碍线粒体凋亡途径,而不通过死亡受体途径以及内质网途径。在诱导凋亡过程发生后,随着线粒体孔道的开放,线粒体膜电位发生下降及细胞色素C释放至胞浆,细胞色素在细胞凋亡执行过程中位于枢纽作用[19],于是试验又进一步验证了线粒体膜孔道的开放性,结果显示,试验组与对照组相比,mPTP的开放程度显著性降低,进一步推测PTD-FNK有可能是通过阻碍线粒体膜孔道的开放,进而抑制线粒体途径诱导凋亡,起到保护冻融精子的作用。
综上所述,PTD-FNK蛋白对冻融猪精子具有保护作用,且10 nmol/L时的保护效果最佳,而其作用机制有可能是通过抑制线粒体与mPTP相关BH3-only中Bax的表达进而抑制mPTP的开放,进一步抑制相关caspase的活性,阻碍了线粒体内源性途径的凋亡,从而起到保护冻融精子的作用。其中,具体的通路交联方式需要更深一步的研究来说明。本试验为深入研究PTD-FNK蛋白抑制冻融精子凋亡的机制并促进其实际应用奠定了基础。
4 结论
研究结果表明,PTD-FNK蛋白可能是通过抑制内源性线粒体途径介导的凋亡发挥对精子冷冻解冻的保护作用。
参考文献:
[1]Grossfeld R,Sieg B,Struckmann C,et al. New aspects of boar semen freezing strategies[J]. Theriogenology,2008,70(8):1225-1233.
[2]朱鹏立,尚秀玲,蒋 娜,等. 白藜芦醇对动脉粥样硬化兔Fas/FasL凋亡途径的影响[J]. 临床心血管病杂志,2009,25(12):945-948.
[3]Leeuw F D,Colenbrander B,Verkleij A J. The role membrane damage plays in cold shock and freezing injury[J]. Reproduction in Domestic Animals,1991,27:95-104.
[4]Asoh S,Ohsawa I,Mori T,et al. Protection against ischemic brain injury by protein therapeutics[J]. Proceedings of the National Academy of Sciences of the United States of America,2002,99(26):17107-17112.
[5]Sudo K,Asoh S,Ohsawa I,et al. The anti-cell death FNK protein protects cells from death induced by freezing and thawing[J]. Biochemical and Biophysical Research Communications,2005,330(3):850-856.
[6]Shimokawa K,Oshiro R,Yamanaka K,et al. Improvement of the post-thaw qualities of Okinawan native Agu pig sperm frozen in an extender supplemented with antiapoptotic PTD-FNK protein[J]. Theriogenology,2012,78(7):1446-1455.
[7]王晓晔,石博妹,王英群,等. PTD-FNK蛋白的原核表达及纯化鉴定[J]. 南方农业学报,2016,47(6):1019-1024.
[8]Wang Z B,Liu Y Q,Cui Y F. Pathways to caspase activation[J]. Cell Biology International,2005,29(7):489-496.
[9]Rao R V,Ellerby H M,Bredesen D E. Coupling endoplasmic reticulum stress to the cell death program[J]. Cell Death and Differentiation,2004,11(4):372-380.
[10]趙祥杰,李玉田,孙 爽,等. 猪精液颗粒冷冻技术的研究[J]. 东北农业大学学报,2008,39(3):70-75.
[11]Said T M,Agarwal A,Zborowski M,et al. Utility of magnetic cell separation as a molecular sperm preparation technique[J]. Journal of Andrology,2008,29(2):134-142.
[12]Bratton D L,Fadok V A,Richter D A,et al. Appearance of phosphatidylserine on apoptotic cells requires calcium-mediated nonspecific flip-flop and is enhanced by loss of the aminophospholipid translocase[J]. Journal of Biological Chemistry,1997,272(42):26159-26165.
[13]Li H,Zhu H,Xu C J,et al. Cleavage of BID by caspase 8 mediates the mitochondrial damage in the Fas pathway of apoptosis[J]. Cell,1998,94(4):491-501.
[14]Soriano M E,Scorrano L. Traveling bax and forth from mitochondria to control apoptosis[J]. Cell,2011,145(1):15.
[15]Cryns V,Yuan J. Proteases to die for[J]. Genes & Development,1998,12(11):1551.
[16]Grunewald S,Paasch U,Wuendrich K,et al. Sperm caspases become more activated in infertility patients than in healthy donors during cryopreservation[J]. Archives of Andrology,2005,51(6):449-460.
[17]Stroh C,Cassens U,Samraj A,et al. The role of caspases in cryoinjury:caspase inhibition strongly improves the recovery of cryopreserved hematopoietic and other cells[J]. FASEB Journal,2002,16(12):1651.
[18]Di Sano F,Ferraro E,Tufi R,et al. Endoplasmic reticulum stress induces apoptosis by an apoptosome-dependent but caspase 12-independent mechanism[J]. Journal of Biological Chemistry,2006,281(5):2693-2700.
[19]Gottlieb R A. Mitochondria and apoptosis[J]. Science,2001,10(3/4):147-161.
