猪肺炎支原体纤毛黏附因子P97和F7-CTB对O型口蹄疫灭活疫苗的免疫增强作用
2019-07-22郭芸芸张雪寒刘茂军
郭芸芸 张雪寒 刘茂军

摘要:旨在研究猪肺炎支原体(Mycoplasma hyopneumoniae,简称Mhp)纤毛黏附因子P97以及F7鞭毛蛋白(flagellin,简称F)-霍乱毒素B亚基(cholera toxin B subunit,简称CTB)2种重组蛋白对口蹄疫(foot-and-mouth disease,简称FMD)灭活疫苗的免疫增强作用。通过体外表达获得pCold-F7-CTB、pET32a-P97-R1 2种重组蛋白,用间接酶联免疫吸附试验(enzyme-linked immunosorbent assay,简称ELISA)方法检测pCold-F7-CTB蛋白的生物學活性,将重组蛋白分别与口蹄疫病毒(foot-and-mouth disease virus,简称FMDV)灭活抗原、口蹄疫灭活疫苗混合制备,皮下或腹腔接种Balb/c小鼠,共免疫2次,间隔3周。分别于免疫前、免疫后21、35、49 d采血,49 d后无菌摘取脾脏。采用阻断ELISA的方法检测小鼠血清口蹄疫O型病毒免疫球蛋白(IgG)抗体滴度,用流式细胞术检测脾淋巴细胞亚型比例,以评估免疫效力。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,简称SDS-PAGE)和蛋白质印迹法(Western Blot)分析结果表明,2种重组蛋白成功表达。用GMl(神经节苷脂)-ELISA方法验证pCold-F7-CTB的生物学活性,发现融合蛋白F7-CTB保留了与GMl的结合能力。小鼠免疫试验结果表明,经皮下注射接种后,单独口蹄疫病毒灭活抗原组没有产生明显的抗体水平,而F7-CTB免疫增强剂组比单独口蹄疫病毒灭活抗原组的IgG滴度更高。在试验中发现,当重组蛋白与口蹄疫灭活疫苗联合使用时,血清中的IgG滴度明显增高,CD3+CD8+T淋巴细胞比值上升;P97和F7-CTB混合使用对口蹄疫灭活疫苗的免疫增强效果最佳。可以初步得出,免疫增强剂P97和F7-CTB具有协同作用,皮下注射可显著提高FMD的特异性IgG水平,CD3+CD8+T淋巴细胞比值升高,显示其具有良好的应用前景。
关键词:口蹄疫;P97;F7-CTB;免疫增强剂
中图分类号: S855.3 文献标志码: A 文章编号:1002-1302(2019)11-0204-06
口蹄疫(foot and mouth disease,简称FMD)是由口蹄疫病毒(foot and mouth disease virus,简称FMDV)引起的偶蹄动物的一种急性、热性、高度接触性传染病,被世界动物卫生组织(OIE)列为必须报告的传染病之一[1]。疫苗接种是预防和控制口蹄疫最可靠和有效的手段[2]。目前灭活口蹄疫疫苗的使用仍最为广泛[3-4]。现有的口蹄疫疫苗存在免疫后抗体产生慢、抗体水平低和持续期短的缺点[5],因此,本研究以增强免疫效力为目的,尝试研制一种新型免疫增强剂。
结合猪肺炎支原体(Mycoplasma hyopneumoniae,简称Mhp)的免疫学特点,R1区作为Mhp纤毛黏附因子p97黏附纤毛的主要决定区,主要引起黏膜免疫和细胞免疫[6]。同时也是少数被证明具备免疫保护能力的抗原之一[7-8]。鞭毛蛋白作为 TLR-5受体激动剂,能诱导强烈、广泛的免疫反应[9]。
鞭毛蛋白(flagellin,简称F)佐剂的效果在流感病毒[10-11]、结核分枝杆菌[12]和鼠疫菌[13]的研究中已经被多次确认,鞭毛蛋白是较好的载体及佐剂。Albert等在研制亚单位疫苗时,将结肠弯曲菌的鞭毛蛋白的FlaA片段与麦芽糖结合蛋白(maltose-binding protein,简称MBP)进行融合表达,得到了MBP-F1aA重组蛋白,通过口服途径免疫,结果显示,对照组小鼠肠道的细菌完全定植,MBP-F1aA免疫组有71.4%的小鼠有细菌定植,显示该重组蛋白在一定程度上抵御了结肠弯曲菌的感染[14]。Delaney等用flagellin-L1R(FR)重组蛋白(将牛痘病毒L1R抗原序列连到细菌鞭毛蛋白N端)免疫小鼠,结果能产生与天然L1R相互作用的抗体,FR重组蛋白更能促进抗原特异免疫球蛋白(IgG)的产生,加强免疫后可产生有效的保护性免疫应答,对小鼠能提供100%的保护[15]。大肠杆菌霍乱毒素(CT)具有黏膜免疫佐剂活性,是细菌类毒素,研究发现,CT的B亚单位单独作用,表现为无毒性,但仍可保持较强的佐剂活性,能刺激机体产生强烈的黏膜系统免疫应答,调节Th1、Th2型细胞反应的细胞因子的表达[16]。Hou等将霍乱毒素B亚基(cholera toxin B subunit,简称CTB)作为黏膜佐剂,与HIV-1DNA(人免疫缺陷病毒-1的DNA)疫苗联合后免疫小鼠,可诱导其产生高水平的Thl和Th2型细胞因子、炎症细胞因子和趋化因子,同时提高血清中Env蛋白的IgG抗体水平[17]。Miyata等将CTB与蛋白MSP1-19耦合,可以提高血清和支气管肺泡灌洗液中的IgG抗体水平[18]。由以上结果可以看出,CTB无论是作为黏膜免疫佐剂还是抗原递送载体,都有良好的免疫增强作用。本研究将F7和CTB基因进行连接后重组表达,并与P97重组蛋白联合或分别单独作用,从体液免疫及细胞免疫角度来评估其免疫应答,以期改善传统疫苗的缺点。
1 材料与方法
1.1 菌株和质粒
PCold Ⅰ-F7、pUC57-CTB质粒均由由农业部兽用生物制品工程技术重点实验室保存;pET32a-P97-R1由江苏省农业科学院兽医研究所猪病研究室惠赠;大肠杆菌感受态细胞Trans5α和BL21(DE3),购自TransGen公司。
1.2 主要试剂
限制性核酸内切酶EcoR Ⅰ、Hind Ⅲ、Sal Ⅰ、Xba Ⅰ和T4 DNA连接酶,购自TaKaRa公司;蛋白纯化试剂盒,购自GE公司;辣根过氧化物酶(HRP)-小鼠抗组氨酸(histidine,简称His)标签、HRP-羊抗鼠-IgG和HRP-羊抗兔-IgG,购自博士德生物工程有限公司;CTB蛋白、兔源抗大肠杆菌不耐热性肠毒素(Heat-labile enterotoxin B subunit,简称LTB)抗体、神经节苷脂1(Ganglioside,简称GM1)和胎牛血清,购自Sigma公司;PE-CyTM7 Hamster Anti-Mouse CD3e、PE Rat Anti -Mouse CD4和FITC Rat Anti-Mouse CD8a,购自美国BD公司;单组分3,3′,5,5′-四甲基联苯胺(3,3′,5,5′-Tetra-methylbenzidine,简称TMB)显色液Ⅰ、无血清培养基RPM 1640、Triton x-114,购自南京助研生物技术有限公司;MONTANIDE ISA 206 VG,购自赛彼科(上海)特殊化学品有限公司;内毒素检测试剂盒,购自Thermo公司;口蹄疫O型液相阻断酶联免疫吸附试验(enzyme-linked immunosorbent assay,简称ELISA)抗体检测试剂盒,购自中国农业科学院兰州兽医研究所。
1.3 试验动物
6周龄Balb/c小鼠,购于扬州大学医学院。
1.4 pCold I-F7-CTB重组质粒的构建
将笔者所在实验室保存的克隆质粒pUC57-CTB用限制性内切酶Sal Ⅰ、Xba Ⅰ酶切,获得目的基因CTB,将其插入到表达载体pCold I-F7相应的酶切位点中,构建重组质粒pCold I-F7-CTB。
1.5 重组菌的构建
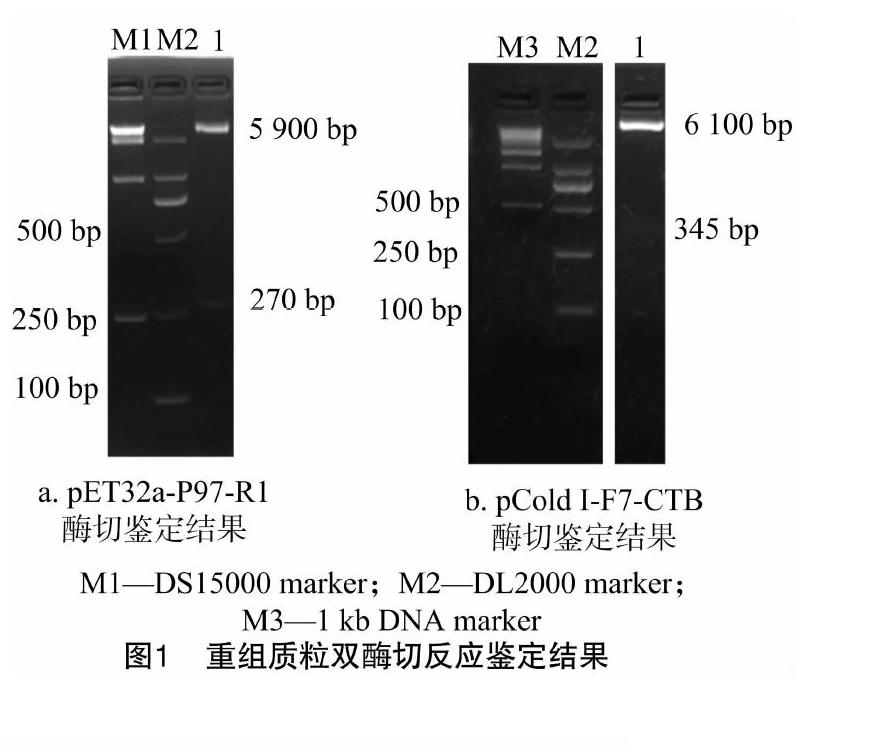
将重组质粒pCold-F7-CTB、pET32a-P97-R1转化大肠杆菌BL21(DE3),涂布于LB平板(含100 μg/mL氨苄青霉素)上。过夜培养,挑取单菌落,酶切鉴定,获得重组菌株pCold I-F7-CTB/BL21(DE3)和pET32a-P97-R1/BL21(DE3)。
1.6 重组蛋白的表达
1.6.1 重组菌的诱导表达 将上述重组菌于37 ℃继续快速培养至D600 nm=0.4~0.6,加异丙基硫代半乳糖苷(isopropyl β-D-thiogalactoside,简称IPTG)至终浓度为1 mmol/L(同时设空载体对照组);将pCold I-F7-CTB/BL21菌株于 16 ℃、18~24 h诱导表达,并将pET32a-P97-R1/BL21菌株于37 ℃、5 h诱导表达,收集细菌。
1.6.2 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,简称SDS-PAGE)鉴定重组蛋白质的表达 各取3 mL上述诱导培养物,于12 000 r/min离心1 min,收集菌体,用1/10体积的 0.01 mol/L 磷酸缓冲盐溶液(简称PBS,pH值为7.4)重悬菌体,在冰水浴中超声裂解至菌体全部破碎,取部分超声裂解菌体作为全菌蛋白质,将剩余部分离心分离菌体上清液和沉淀。通过SDS-PAGE分别检测全菌、上清液和沉淀,分析重组蛋白的表达形式。
1.7 重组蛋白的纯化和蛋白质印迹法(Western Blot)分析
对于2种诱导重组菌pCold I-F7-CTB/BL21(DE3)和pET32a-P97-R1/BL21(DE3),参照GE公司的His TrapTM HP说明书,对上清液进行纯化。用SDS-PAGE分析纯化效果,同时用纯化后的蛋白进行Western Blot分析,通过RC DC Protein Assay检测纯化蛋白的浓度,并用Triton X-114法去内毒素,用显色法检测内毒素含量,具体操作参照使用说明书。
1.8 GM1-酶联免疫吸附
用100 μL pH值为9.6的0.05 mol/L碳酸盐缓冲液(含2 μg神经节苷脂GM1)包被96孔酶联板,于4 ℃过夜;用 200 μL/孔 的2%牛血清白蛋白(BSA)于37 ℃封闭2 h;每孔加入12.5 ng pCold-F7-CTB蛋白,同时设阴、阳性对照,于37 ℃孵育2 h;加入以1 ∶ 1 000体积比稀释的兔源抗LTB,于37 ℃孵育2 h;加入以1 ∶ 1 000体积比稀释的HRP-羊抗 兔-IgG,于37 ℃孵育1 h;用3,3′,5,5′-四甲基联苯胺(TMB)显色;加入终止液,测定D450 nm。
1.9 小鼠免疫接种
1.9.1 免疫试验1 将6周龄的Balb/c小鼠随机分成4组,5只/组,皮下注射配制的液体试剂,每只注射0.1 mL。配制方法:按照5 μg/只的蛋白量与口蹄疫病毒(foot-and-mouth disease virus,简称FMDV)灭活抗原混合制备,具体分组和免疫剂量见表1。共免疫2次,间隔3周。分别于免疫前与免疫后21、35、49 d在小鼠眼眶静脉丛采血,测定抗体水平。
1.9.2 免疫试验2 将6周龄的Balb/c小鼠随机分成8组,5只/组,按照5 μg/只的蛋白量与FMDV灭活抗原混合后,再按1 ∶ 1的比例添加MONTANIDE ISA 206 VG制备口蹄疫灭活疫苗。比较P97、F7-CTB 2种重组蛋白单独添加以及混合添加对口蹄疫灭活疫苗的免疫增强作用,同时比较皮下、腹腔2种免疫途径的差异。具体分组和免疫剂量见表2。共免疫2次,间隔3周。分别于免疫前、免疫后21、35、49 d在小鼠眼眶静脉丛采血,测定抗体水平。
1.10 血清中口蹄疫O型病毒抗体IgG的检测
用口蹄疫O型液相阻断ELISA抗体检测试剂盒进行检测,分别于免疫前与免疫后21、35、49 d采集血液,分离血清,检测方法参照具体说明书。
1.11 流式细胞术检测脾淋巴细胞CD3+、CD4+和CD8+亚型比例于首免 49 d 时,取 1×106/mL 小鼠脾脏淋巴细胞加入1.5 mL 无菌离心管中,用1 mL 0.01 mol/L PBS,于1 500 r/min离心5 min,弃去上清,用溶有PE-CyTM7 Hamster Anti-Mouse CD3e、PE Rat Anti-Mouse CD4和FITC Rat Anti-Mouse CD8a荧光抗体的300 μL荧光洗液[100 mL,0.01 mol/L PBS,pH值为7.4,用2% N-溴代琥珀酰亚胺(NBS)]重悬细胞,充分混匀后于4 ℃避光孵育30 min,用 0.01 mol/L PBS洗滌2次,每次1 mL,于1 500 r/min离心 5 min,弃上清,将管底细胞用500 μL荧光保存液(100 mL,0.01 mol/L PBS,pH值为7.4,2%葡萄糖,0.1% NaN3)重悬,利用流式细胞仪(BD AccuriTM C6 Plus)检测10 000个细胞中CD3+、CD4+和CD8+阳性细胞数。
