藏药波棱瓜属药用植物DNA条形码鉴定
2019-07-22黄思远孙宁阳石晏丞
黄思远 孙宁阳 石晏丞

摘要:为评价DNA条形码候选序列对藏药波棱瓜属植物的鉴定作用,探讨波棱瓜属植物鉴定新方法,本研究采用不同产地、不同海拔波棱瓜植物的ITS2、PsbA-trnH、rbcL、matK通用引物对110份样品进行DNA提取、PCR 扩增和测序,比较4条DNA序列扩增效率和测序成功率;分析种内和种间变异;通过Barcoding gap 分析,构建NJ系统进化树,评价各序列对西藏自治区、云南省、四川省不同海拔波棱瓜药材的辨别能力。研究结果表明,ITS2序列在所研究的波棱瓜属药用植物中的扩增效率和测序成功率均为100%,其种内种间变异、Barcoding gap与其他DNA条形码候选序列相比具有明显的优势,以ITS2序列作为DNA条形码,可对波棱瓜进行准确、快速识别和鉴定,准确地弄清楚不同地区不同海拔所生长的波棱瓜之间的进化关系,为该药用植物的质量控制、安全用药及资源合理开发利用提供理论依据。
关键词:波棱瓜属;DNA条形码;ITS2;matK;rbcL;PsbA-trnH
中图分类号:S567.21+9.01 文献标志码: A 文章编号:1002-1302(2019)11-0066-05
波棱瓜作为传统的藏药材,其用药部位为其干燥种子。它的药理作用在藏药学著作《月王药诊》中被著述,波棱瓜子味苦、性寒,可和纤毛婆婆纳、藏茵陈、止泻木按一定剂量进行配伍煎汤,藏医主要用其治疗赤巴炎症;此外波棱瓜子与玉石等配伍主要治疗各种肝病[1]。波棱瓜子木脂素部位及其单体常用于治疗黄疸、肝炎、消化不良及肝胆疾病。相关文献报道,波棱瓜子的药理作用主要有抗肝损伤[2]、抗肝炎[3]等。
DNA条形码技术通过测定植物DNA序列进行比较来反映其遗传差异,通过建立生物DNA 条形码系统能够实现快速、准确、自动化的物种鉴定[4-5]。目前,研究者们已经测定了10 多条植物候选DNA条形码序列[6],并在不同的类群中对各条形码的鉴定能力进行了考察。ITS2序列中含有丰富的变异位点和信息位点,并且该序列在植物中广泛存在,因此可以应用于物种的鉴定,对植物有较高的鉴别能力[7-8]。可以通过ITS2序列来区分波棱瓜植物的产地,进行快速准确识别和鉴定,对研究波棱瓜的分布有指导作用,对其遗传育种研究、种质资源的生乳研究以及资源保护和全利用都具有重要的理论和实践价值。
本研究应用近年来提出的植物DNA 条形码候选序列ITS2、 PsbA-trnH、rbcL、matK对波棱瓜属植物进行研究,考察不同DNA 条形码候选序列在波棱瓜属药用植物鉴定中的能力,以期建立波棱瓜属药用植物数字鉴定方法。
1 材料与方法
1.1 材料
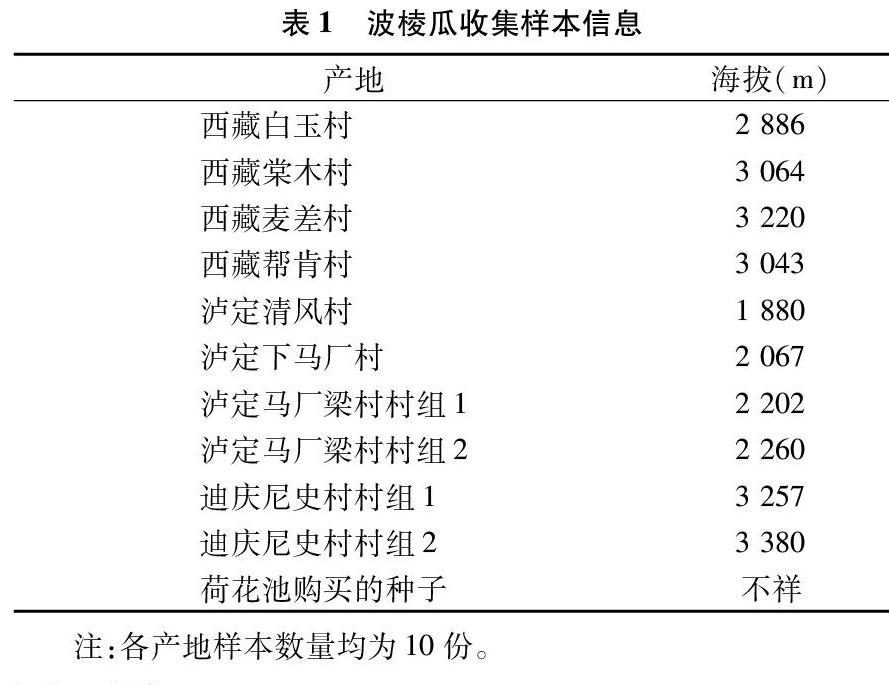
笔者所在课题组共收集110份波棱瓜属样本,具体样本见表1。试验样本经西南民族大学药学院顾健教授鉴定为波棱瓜属[Herpetospermum pedunculosum (Ser.) C. B. Clarke]叶片和种子。其中叶片样本100份,都为硅胶干燥的叶片,10份为成熟种子,采样时间为2016年9月。测序公司为生工生物工程(上海)股份有限公司。
1.2 方法
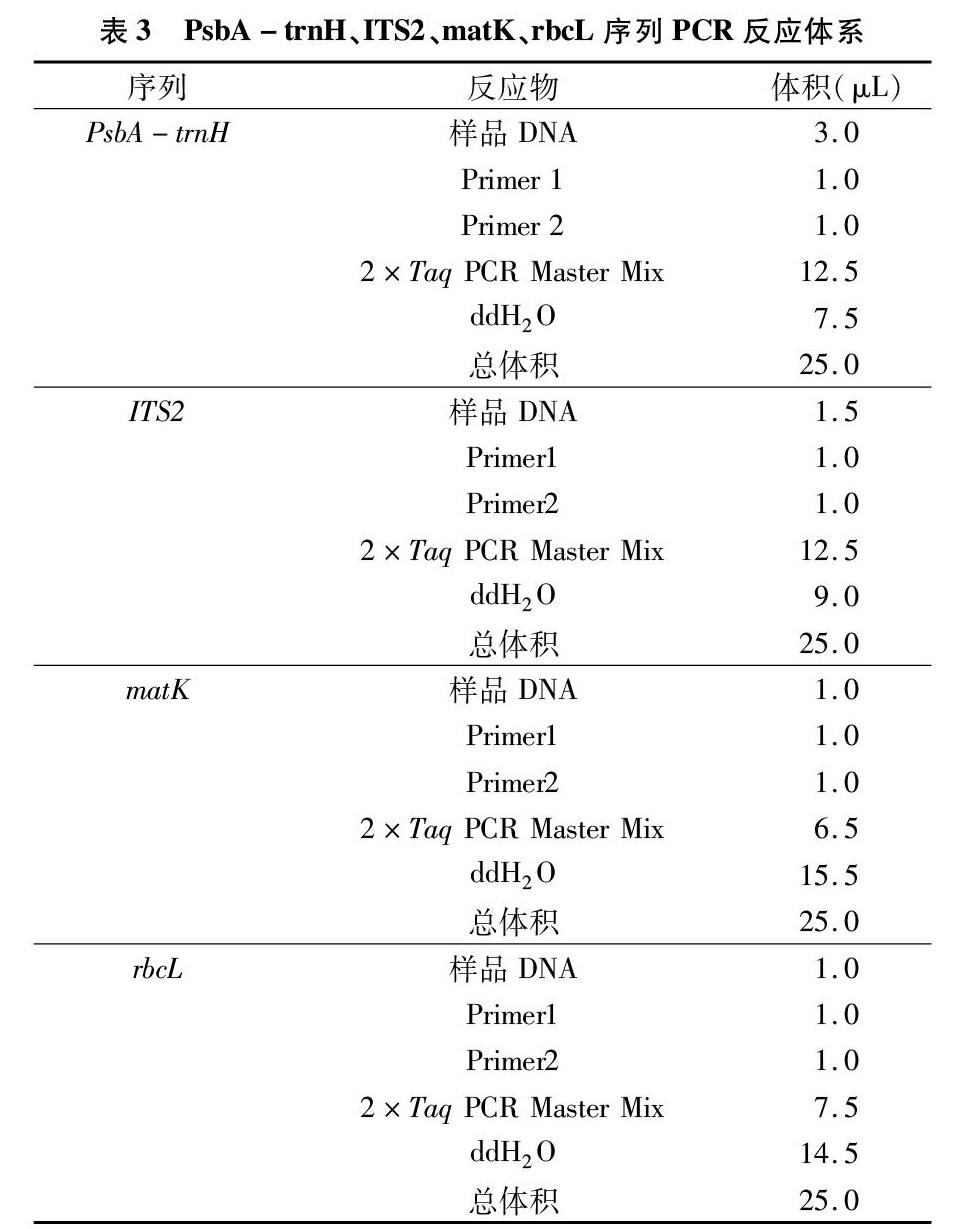
1.2.1 样品DNA提取、PCR扩增及测序 取干燥药材 30 mg,加入液氮充分碾磨,使用植物DNA提取试剂盒(Tiangen Biotech Co.,China)提取总DNA。matK、rbcL、PsbA-trnH、ITS2的扩增引物见表2;候选DNA条形码序列的PCR扩增体系见表3。
1.2.2 数据处理 试验主要应用的软件有DANMAN、MEGA version 5.1和SPSS 16.0。运用DANMAN软件查看测序成功的序列,并将序列录入到MEGA version 5.1软件中,进行序列之间遗传距离的分析进而构建系统进化树,分析保存序列的变异位点、序列的遗传距离;运用SPSS 16.0进行Wilcoxon秩和检验分析,比较各个序列的变异程度;通过Barcoding gap,查看序列的种内、种间差异情况,观察是否出现显著gap,进一步挑选合适的DNA条形码片段;运用MEGA version 5.1软件中的邻接法(NJ),分析不同序列物种识别和鉴定能力。根据系统进化树计算K2P距离,设100次重复检验。
2 结果与分析
2.1 PCR扩增结果
阴性对照(CK)采用加入和模板等量ddH2O后扩增的PCR产物,从图1可以看出,CK组无条带,说明样品PCR扩增成功,不存在真菌污染,4条序列样本电泳条带均明亮,满足试验要求。
2.2 PCR扩增率和测序成功率
对样本的ITS2、matK、PsbA-trnH、rbcL等4条候选序列进行PCR扩增效率(出现明显条带)和测序成功率(测序获
得高质量序列)统计,结果(图2)显示,ITS2、matK序列为100.0%,PsbA-trnH序列扩增效率为91.0%,rbcL序列扩增效率为85.0%;ITS2测序成功率为100.0%,matK測序成功率为88.9%,PsbA-trnH、rbcL测序成功率都为97.8%。
2.3 候选DNA条形码序列特征
本研究对不同产地不同海拔波棱瓜样品的4个DNA片段ITS2、matK、PsbA-trnH、rbcL进行测序。测序所得的序列用DANMAN软件进行排列剪切,然后用MEGA 5.1软件统计序列的变异位点、保守位点、序列长度、GC含量等基本信息。从表4可以看出,在4个基因片段中,ITS2有54个变异位点,并且变异程度最高,为22.7%;rbcL变异程度最小,为0.4%;变异程度表现为ITS2>PsbA-trnH>matK>rbcL。因此选择基于ITS2基因对波棱瓜不同产地及海拔样品进行比对。序列matK的扩增片段最长,而ITS2最短。
2.4 种内种间的变异分析
从表5可以看出,4种序列种间变异平均值由大到小的顺序为ITS2>PsbA-trnH>rbcL>matK;种间最小变异的顺序为ITS2>PsbA-trnH>matK>rbcL;种内变异平均值顺序为ITS2>PsbA-trnH>rbcL>matK。通过对波棱瓜属各条形码候选序列的种间变异、种内变异、种间最小变异分析发现,ITS2序列满足种间变异应当大于种内变异,并且种间最小变异应当小于种内变异这一条件。
2.5 候选DNA条形码Wilcoxon秩和检验
候选DNA条形码两两序列相关程度,一般通过Wilcoxon秩和来检验。此方法可以更加准确地反映出两两序列样本的差异程度。从表6可以看出,ITS2序列与其他3条序列具有显著差异。通过检验发现,ITS2序列种间的变异情况较其他序列快。
2.6 DNA条形码Barcoding gap检验
理想的条形码种间遗传变异应明显大于种内遗传变异,并在二者之间存在显著差异,形成一个明显的间隔区,即Barcoding gap。从图3可以看出,rbcL序列的种内遗传变异值和种间遗传变异值主要集中在0~0.001区域,matK序列的种内遗传变异值和种间遗传变异值集中在0.002~0.003区域,重叠部分多,无明显gap;PsbA-trnH的种内遗传变异值小,均集中在0~0.001区域,种间遗传变异值在0~0.001、0.002~0.003区域均有分布,种内种间遗传变异重叠部分少,gap不明显。ITS2种内遗传变异值在0~0.004区域均有分布,种间遗传变异值分布范围广。ITS2的种内种间遗传变异所行成的bar coding gap明显,但重区域较小,有利于区分物种。
2.7 ITS2、PsbA-trnH、rbcL、matK序列NJ系统进化树鉴定结果
根据各序列对所有样本构建NJ系统进行树(图4、图5、图6、图7)。从NJ进化树可以看出,PsbA-trnH序列构建的系统进化树中的样本有明显的种内差异,没有明显的种间变异,不能鉴别出不同海拔样品。matK序列和rbcL序列构建的进化树可将不同产地不同海拔的样本聚类成一大类,种间距离很小,无法区分,鉴别效果不理想。ITS2序列构建的进化树可以很好地区别出云南波棱瓜,同时四川省和西藏自治区样品聚类为一类,与参照序列聚类距离远,有明显的种间距离。
3 讨论
波棱瓜为来源于葫芦科波棱瓜属的植物,以种子入药,是临床常用藏药。波棱瓜属植物主要分布于青藏高原地区,在我国主要分布在西藏自治区、四川省、云南省,在国外印度、尼泊尔也有分布。波棱瓜普遍生长在路边、林缘及山坡低矮灌木丛中,海拔为 2 300~3 500 m[9-10]。波棱瓜药用历史悠久,但存在称谓混乱导致用药混乱的现象,因此对波棱瓜属植物进行准确识别和鉴定,对该药材的安全使用和波棱瓜资源的合理开发及保护都十分重要。
本研究通过对不同产地不同海拔采集的波棱瓜植物样本进行PCR扩增、测序可知,ITS2序列长度约为238 bp,扩增成功率和测序成功率都为100%,有54个变异位点,变异率为22.7%,DNA条形码变异率较高,种间种内差异明显,种间最小变异小于平均溯祖度。Wilcoxon秩和检验的结果是ITS2变异检验值大于其他3个序列。从Barcoding gap图中能够看出,ITS2种间遗传变异分布范围广,与种内遗传变异值的重叠区域较小,有利于区分物种。
PsbA-trnH间隔区在被子植物中具有高度变异性,其两端具有75 bp的保守区序列,便于设计通用引物[6,11],在波棱瓜属中的扩增效率为91%,从Barcoding gap图中可以看出,PsbA-trnH序列的种内和种间遗传变异值的集中区域虽然没有重叠,但gap不明显,所以PsbA-trnH序列不适合单独作为波棱瓜属植物的DNA条形码。matK序列是植物叶绿体DNA 中进化较快的一条编码区序列,也是多位研究者推荐的条形码序列之一[6,12-15]。本试验中,matK序列在波棱瓜属植物中扩增效率虽然高,但是测序成功率仅为88.9%,低于其他3條序列,且种内种间重叠部分多,无明显gap,因此matK不适合作为条形码对波棱瓜属植物进行鉴定。rbcL序列的种间和种内遗传变异值分布区域接近且无明显gap,因而判定rbcL也不适合作为波棱瓜属植物的DNA条形码序列。从NJ系统进化树图中能够看出,除ITS2序列构建的系统进化树以外,其他3条均不适合独自作为波棱瓜属的条形码来区分不同产地的波棱瓜。
参考文献:
[1]马哈也那,马世林,王振华,等. 月王药诊[M]. 兰州:甘肃民族出版社,1993.
[2]顾 健,李佳川,樊利娜.藏药波棱瓜子总木脂素对刀豆球蛋白(ConA)致免疫性肝损伤小鼠保护作用及其机制探讨[J]. 西南民族大学学报(自然科学版),2014,40(3):375-387,481.
[3]丛龙波,王 琪,李仙义,等. 藏药波棱瓜子抗肝炎药效物质基础研究[J]. 医学研究杂志,2007,3(8):75-76.
[4]Bhargava M,Sharma A. DNA barcoding in plants:evolution and applications of in silico approaches and resources[J]. Molecular Phylogenetics and Evolution,2013,67(3):631-641.
[5]任瑶瑶,江南屏,刘睿颖,等. 应用ITS2序列鉴定四川车前、平车前、大车前[J]. 江苏中医药,2017,49(5):57-60.
[6]朱英杰,陈士林,姚 辉,等. 重楼属药用植物DNA条形码鉴定研究[J]. 药学学报,2010,45(3):376-382.
[7]Yao H,Song J,Liu C,et al. Use of ITS2 region as the universal DNA barcode for plants and animals[J]. PLoS One,2010,5(10):e13102.
[8]豆榮昆,毕振飞,白瑞雪,等. 黄花紫堇、多刺绿绒蒿及其同属近缘物种的ITS2条形码鉴定与分析[J]. 中国中药杂志,2015,40(8):1453-1458.
[9]卢 杰,兰小中,罗 建.林芝地区珍稀濒危藏药植物资源调查与评价[J]. 资源科学,2011,33(12):2362-2369.
[10]关法春,王 超,权 红,等. 西藏野生波棱瓜资源的调查和分类[J]. 西南农业学报,2011,24(2):832-834.
[11]Kress W J,Wurdack K J,Zimmer E A,et al. Use of DNA barcodes to identify flowering plants[J]. Proceedings of the National Academy of Sciences of the United States of America,2005,102(23):8369-8374.
[12]魏星任,叶清莲,马新业,等. 凉粉草DNA条形码通用序列的筛选及其混伪品分子鉴定[J]. 江苏农业科学,2017,45(13):32-35.
[13]刘政泽,刘 博. 基于ITS+matK序列探讨部分藤黄属植物的种间亲缘关系[J]. 江苏农业科学,2017,45(13):39-42.
[14]Chase M W,Cowan R S,Hollingsworth P M,et al. A proposal for a standardised protocol to barcode all land plants[J]. Taxon,2007,56(2):295-299.
[15]Lahaye R,Van Der Bank M,Bogarin D,et al. DNA barcoding the floras of biodiversity hotspots[J]. Proceedings of the National Academy of Sciences of the United States of America,2008,105(8):2923-2928.
