棘胸蛙抗菌肽Spinosan-D的原核表达及活性检测
2019-07-22程福珍洪燕郑荣泉梅祎芸王志刚张丹丹李贤露
程福珍,洪燕,郑荣泉,2*,梅祎芸,王志刚,张丹丹,李贤露
(1.浙江师范大学野生动物保护与利用技术中心 野生动物生物技术与保护利用浙江省重点实验室,浙江 金华 321004;2.浙江师范大学 行知学院,浙江 金华 321004)
抗菌肽(antimicrobial peptides,AMPs)是机体在受到病原体感染时产生的一类小分子多肽[1-2],具有抗菌、抗病毒等生物活性,因其不易产生菌株耐药性,成为各行业“新宠”[3]。棘胸蛙(Quasipaaspinosa)是我国特有的两栖动物,俗称石鸡、石蛙、棘蛙,属于两栖纲、无尾目、蛙科、棘蛙属,主要分布于我国长江以南地区的山涧溪流中。棘胸蛙体型硕大,肉质细嫩,味道鲜美,具有清凉滋补、健肝胃、防癌抗癌等多种功效,兼具美食和药用价值,素有“百蛙之王”的美名[3]。目前对棘胸蛙的研究主要集中在养殖和生物学特征等方面[4],如人工养殖[5-6]、个体发育[7-8]、食性[9-10]、形态特征[11-12]、疾病防治[13-14]、染色体组型[15]等,而在生物活性肽领域的研究较少。已有研究表明,在棘胸蛙抗菌肽Spinosan-A、Spinosan-B、Spinosan-C、Spinosan-D中,Spinosan-D对革兰氏阴、阳性菌的抗菌效果最佳[16]。
本研究对棘胸蛙抗菌肽Spinosan-D的原核表达进行研究,以期为其进一步开发利用提供理论和技术支持。
1 材料与方法
1.1 材料
1.1.1 质粒与菌株
质粒pET-32a(+),北京Solarbio科技有限公司;E.ColiDH5α,日本TaKaRa公司;基因工程菌EColiBL21(DE3)pLysS,北京全式金生物有限公司。
氨苄霉素(母液浓度100 mg·mL-1,使用时每100 mL培养基添加50 μL氨苄霉素)、异丙基-β-D-硫代吡喃半半乳糖苷(IPTG)、LB培养基粉、甲酸、QuickCutHindⅢ限制性内切酶、QuickCutEcoR I限制性内切酶和DNA凝胶回收试剂盒,购于日本TaKaRa公司;Taq PCR Mastermix,购于康为世纪生物公司;Ni-NTA亲和层析凝胶树脂试剂盒、In-Fusion克隆试剂盒,购于美国Clontech公司;DNA Marker、11~245 ku蛋白质Marker和质粒抽提试剂盒,购于天根生化科技(北京)有限公司;LB培养基、SDS-PAGE凝胶配制试剂盒、蛋白质染色液和蛋白质脱色液,购于上海碧云天生物技术有限公司。
1.2 方法
1.2.1 目的基因合成
参考文献[4],设计含有EcoR I和Hind Ⅲ酶切位点、甲酸切割位点和蛋白质终止密码子的编码Spinosan-D成熟肽的核酸序列(5′-GAATTCGATCCGATGGAGGAGCTCTACAAAGAAATCGACGA TTGTGTGAATTATGGCAATTGTAAAACCTTGAAACT CATGTAAAAGCTT-3′)。其中,GAATTC为EcoR Ⅰ酶切位点,AAGCTT为Hind Ⅲ酶切位点,GATCCG为甲酸切割位点。利用TaKaRa Clotech在线生成基因序列软件设计特异性引物F(5′-ATCGGATCCGAATTCGATCCGATGGAGGAGCTCTA CAAA-3′)和R(5′-TGCGGCCGCAAGCTTTTACAT GAGTTTCAAGGTTTTACAATTGCCATA-3′),全基因合成于T-Vector pMD19普通载体上。PCR反应体系为:DNA模板1 μL,上、下游引物各1 μL,反应混合液12.5 μL,加ddH2O至25 μL。PCR反应程序为:94 ℃ 5 min;94 ℃ 30 s,65 ℃ 30 s,72 ℃ 30 s,共29个循环;72 ℃ 10 min;4 ℃保存。反应结束后以1%琼脂糖凝胶电泳分析是否获得所需基因片段。
1.2.2 重组表达质粒的构建及鉴定
用限制性内切酶EcoR I和Hind Ⅲ双酶切质粒pET-32a(+),回收线性化载体片段,取目的基因片段,用In-Fusion连接酶连接,构建pET-32a(+)重组表达载体pET-32a(+)-Spinosan-D,并转化至E.ColiDH5α感受态细胞,挑取阳性单克隆进行菌落PCR鉴定。PCR反应体系为:菌液1 μL,pET-32a(+)通用引物S.TAG、T7 TER各1 μL,反应混合液12.5 μL,加ddH2O至25 μL。PCR反应程序为:94 ℃ 5 min;94 ℃ 30 s,65 ℃ 30 s,72 ℃ 30 s,共29个循环;72 ℃ 10 min;4 ℃保存。PCR产物送至上海生工生化公司测序,运用Seqman和MEGA序列分析软件分析测序结果。
1.2.3 重组质粒的诱导表达
转化重组质粒至E.ColiBL21(DE3)pLysS感受态细胞中,再转入另一培养基,37 ℃、200 r·min-1摇床培养至菌液的D600值为0.7。取1 mL菌液作为诱导前样品,1 mL菌液中加入终浓度为1 mmol·L-1IPTG进行诱导表达(37 ℃、160 r·min-1条件下振摇4 h),取1 mL菌液作为诱导后样品。取诱导前、后样品,12 000 r·min-1离心2 min,各加入40 μL PBS溶液悬浮菌体沉淀,加入10 μL的5×蛋白上样缓冲液,以100 ℃煮沸10 min,取上清,分别取处理过的样品各20 μL,进行12% SDS-PAGE电泳检测。
Whether in cooling or in energy generation mode, the efficiency of a thermoelectric device increases with the increasing of the figure-of-merit of the used thermoelectric semiconductors. The latter is written as[1]:
1.2.4 诱导条件优化
不同诱导表达条件下,蛋白的表达量不同。为使蛋白得到高效表达,进行诱导温度(16 ℃、28 ℃、37 ℃)、诱导时间(4、8、12 h)及IPTG终浓度(0.1、0.5、1.0 mmol·L-1)3因素3水平正交试验,探索最佳诱导表达条件,12% SDS-PAGE电泳检测表达结果。
1.2.5 重组蛋白的纯化
以最佳诱导条件对重组菌进行大量诱导表达,离心收集菌体,冰上超声裂解,离心,收集上清并过滤,对重组蛋白进行纯化,收集蛋白洗脱液,12% SDS-PAGE电泳分析目的蛋白。洗脱的目的蛋白加入终浓度为40%的甲酸,37 ℃培养36 h,37 ℃氮吹出去甲酸,加入1×PBS溶液清洗3次,最后用1×PBS溶液溶解。
1.2.6 重组蛋白生物活性检测
将一定浓度的E.ColiDH5α菌液均匀涂布于固体培养基表面,将灭菌滤纸片按合适间距置于培养基表面,分别加入10 μL 1×PBS溶液、抗菌肽、1 mg·mL-1氨苄霉素,封口膜密封培养皿,水平倒置,置于37 ℃恒温培养箱中过夜培养,观察抑菌圈是否形成及其大小。其中,氨苄霉素处理作为阳性对照,1×PBS溶液处理作为阴性对照。
2 结果与分析
2.1 Spinosan-D基因扩增及重组表达载体构建及鉴定
Spinosan-D基因PCR产物经1%琼脂糖凝胶电泳分析大小为108 bp(图1),目的基因片段扩增成功。
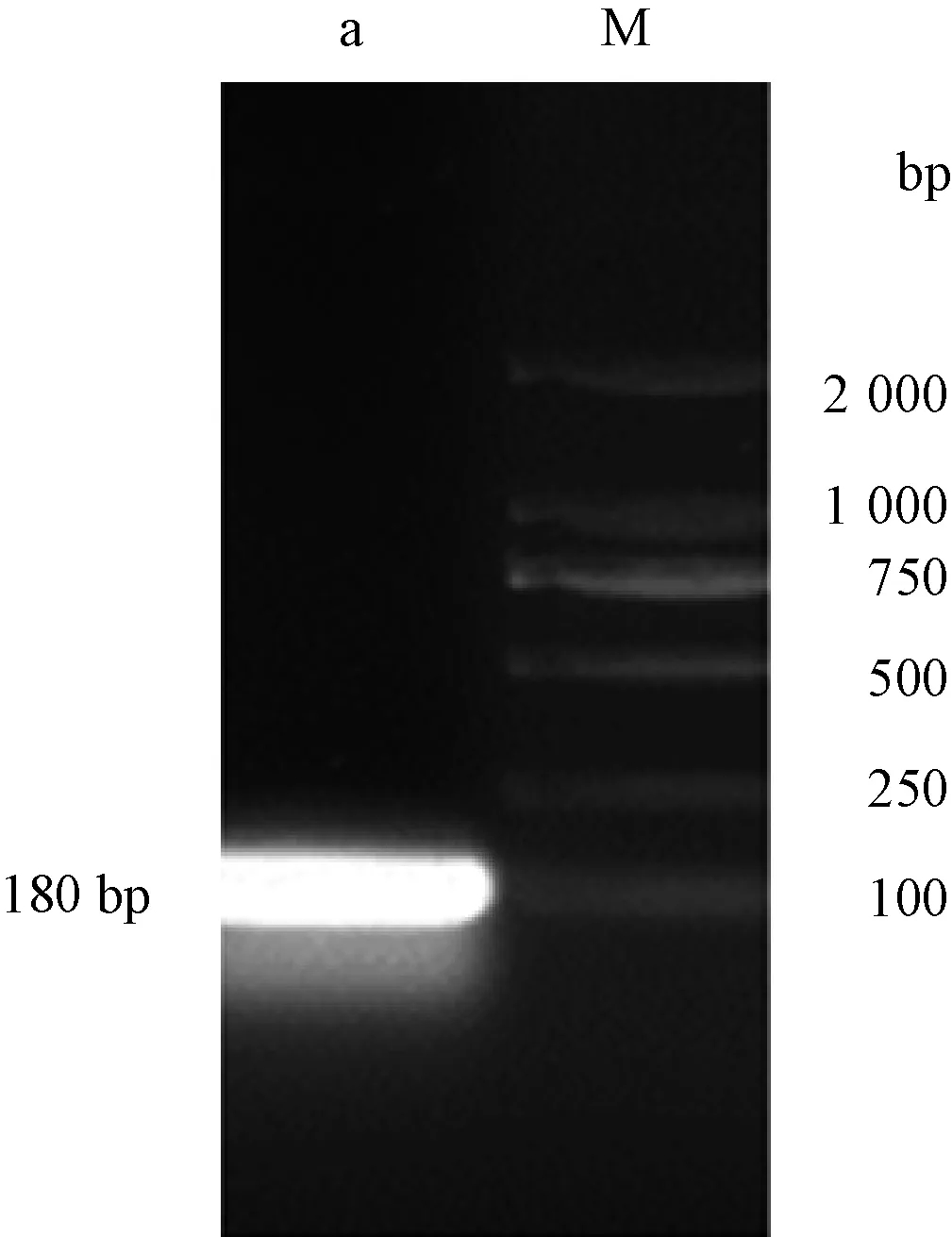
M,DNA分子质量标准;a,Spinosan-D基因扩增产物
使用限制性内切酶EcoRⅠ和Hind Ⅲ对质粒pET-32a(+)进行双酶切,1%琼脂糖凝胶电泳对双酶切后的线性化载体进行分析(图2),条带符合预期结果,成功获得线性化载体。纯化回收的线性化载体,经酶标仪测量,浓度为14.5 ng·μL-1,目的基因片段浓度为62.5 ng·μL-1。
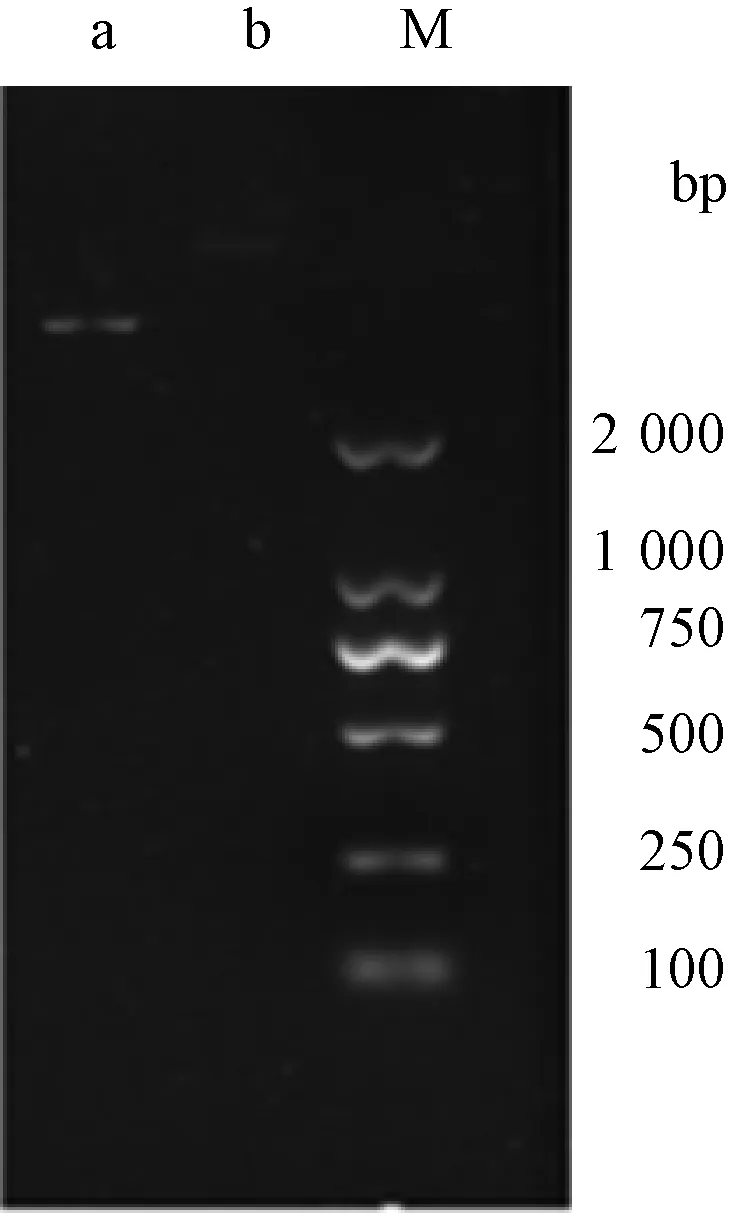
M,DNA分子质量标准;a,经双酶切的线性化pET-32a(+)载体;b,未经双酶切的环状pET-32a(+)载体
菌液PCR后经1%琼脂糖凝胶电泳检测条带大小为267 bp(图3),符合预期结果,初步鉴定重组质粒构建成功。基因测序结果表明,已成功构建重组质粒。
2.2 重组质粒的诱导表达
对含重组质粒的E.ColiBL21(DE3)pLysS大肠杆菌诱导表达后,结果表明,含IPTG诱导剂的目的条带大小处有蛋白表达,而无IPTG诱导剂的在目的条带大小处无蛋白表达(图4),表明融合蛋白在诱导剂IPTG作用下已经成功表达。
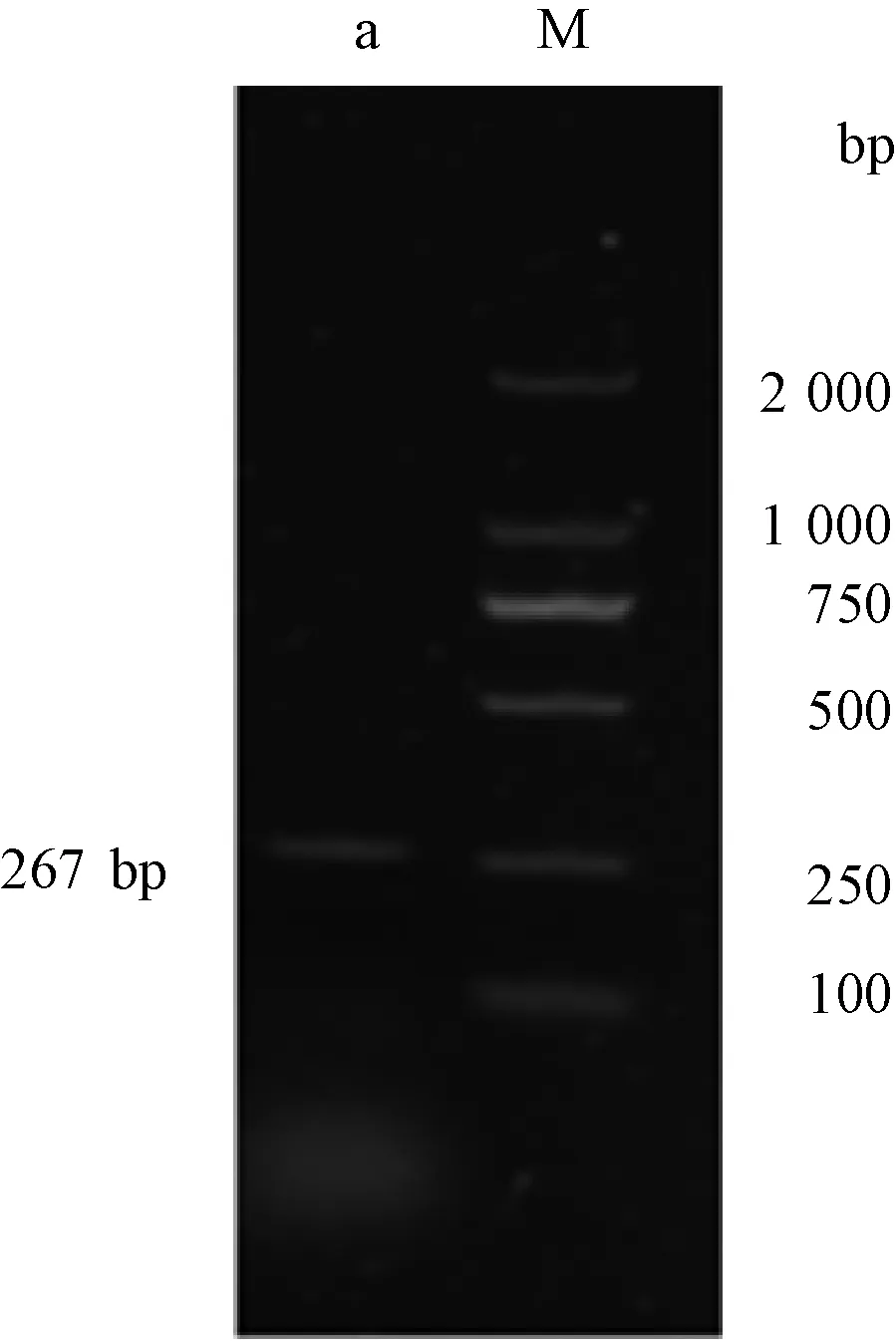
M,DNA分子质量标准;a,菌液PCR扩增产物
M,蛋白质分子质量标准;a,诱导前;b,诱导后
2.3 诱导条件优化
研究发现,37 ℃条件下,融合蛋白的表达量更多(图5),故将最佳诱导温度定为37 ℃。37 ℃条件下,不同诱导时间表达的融合蛋白量差异不明显,选择最短处理时间4 h为诱导时间。在37 ℃、诱导4 h时,1.0 mmol·L-1IPTG诱导表达的融合蛋白最多,故最佳诱导条件为:37 ℃,1.0 mmol·L-1IPTG处理4 h。

A、B、C分别为16 ℃、28 ℃、37 ℃时不同IPTG终浓度及诱导时间下重组质粒的诱导表达。M,蛋白质分子质量标准;a1、a2、a3、b1、b2、b3、c1、c2、c3分别表示诱导时间和IPTG终浓度为4 h、0.1 mmol·L-1,4 h、0.5 mmol·L-1,4 h、1.0 mmol·L-1,8 h、0.1 mmol·L-1,8 h、0.5 mmol·L-1,8 h、1.0 mmol·L-1,12 h、0.1 mmol·L-1,12 h、0.5 mmol·L-1,12 h、1.0 mmol·L-1诱导条件下的重组质粒诱导表达
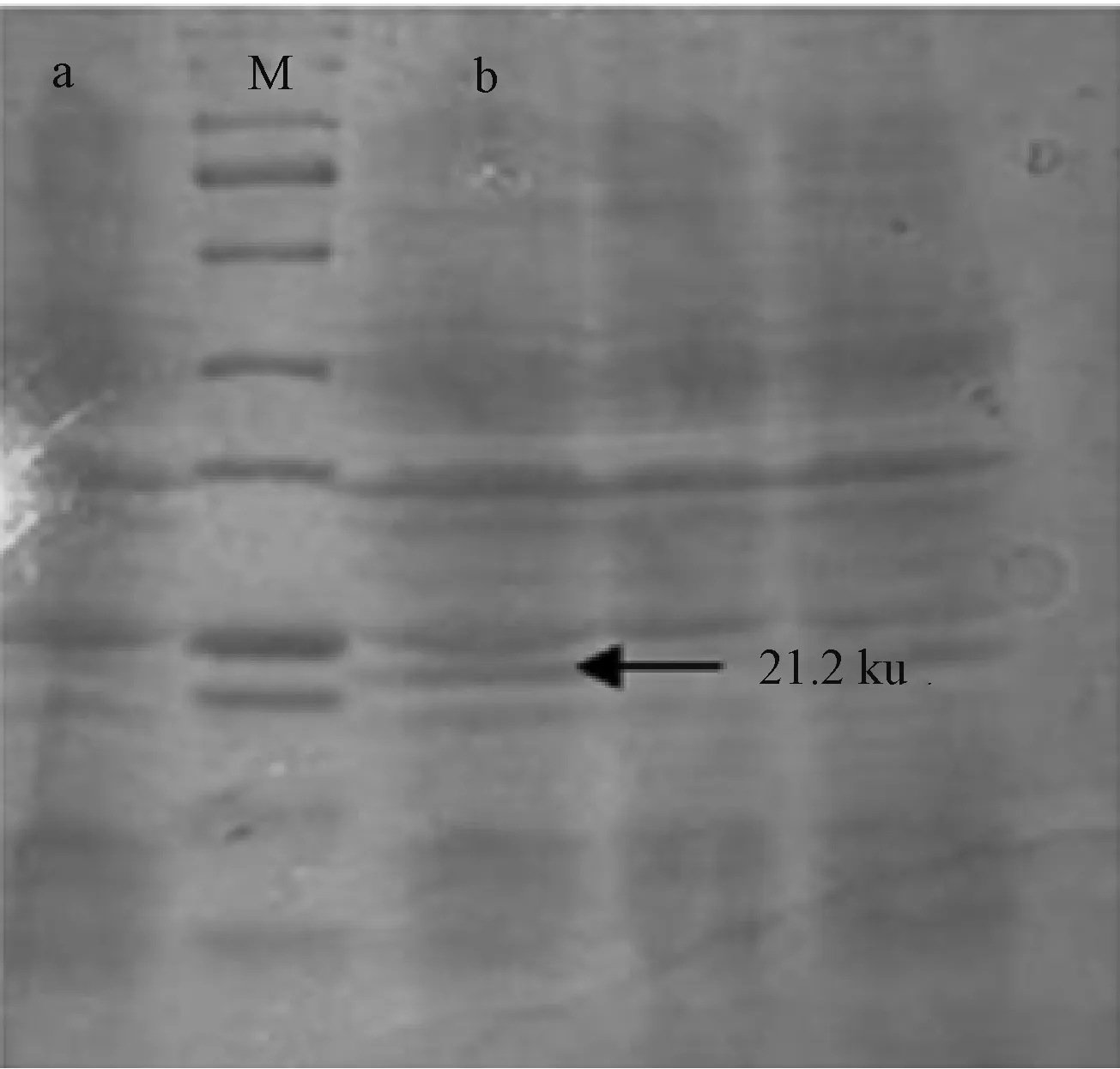
2.4 重组蛋白的纯化
纯化蛋白样和未纯化蛋白样在20~25 ku有一条明显条带,约为21.2 ku(图6),符合预期结果,因此纯化蛋白样成功。
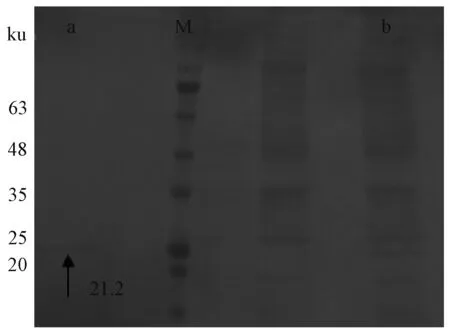
M,蛋白质分子质量标准;a,纯化后;b,纯化前
2.5 重组蛋白生物活性鉴定
在E.ColiDH5α菌株生长的平板上,阴性对照的PBS溶液周围菌株生长正常;阳性对照的氨苄霉素周围有抑菌圈;重组蛋白Spinosan-D周围也存在抑菌圈(图7),表明抗菌肽Spinosan-D具有一定的抗菌活性。
3 讨论
Dong等[16]从棘胸蛙皮肤中克隆出4条cDNA序列,并进行了人工合成,根据抗菌肽的氨基酸组成特点以及二级结构特点,将其命名为Spinosan-A、Spinosan-B、Spinosan-C、Spinosan-D。ProtParam分析表明,4种棘胸蛙抗菌肽的分子量在1 284~2 753,理论等电点在3.92~8.06,除Spinosan-C是阳离子多肽,其余的都是阴离子多肽。HNN在线二级结构预测软件分析表明,Spinosan-A、Spinosan-B以及Spinosan-C均没有α-螺旋,具有较多的β-折叠和无规则卷曲,Spinosan-D具有明显的两亲性且有43.48%的α-螺旋趋势,而抗菌肽中的α-螺旋结构能够使微生物的细胞膜表面出现小孔,在不损伤正常细胞的前提下对细菌、真菌、病毒和癌细胞等有杀伤作用[17-18],对抗菌肽的抗菌活性具有重要的作用。抗菌肽的溶血活性试验显示,80 μg·mL-1的高浓度棘胸蛙抗菌肽样品对家兔红细胞具有极微弱的溶血活性[19]。因此,对比4种棘胸蛙皮肤抗菌肽,Spinosan-D的各种活性效果更佳且稳定。本研究对棘胸蛙抗菌肽Spinosan-D成熟肽进行原核表达,为大量制备和利用这一具有重要应用前景的活性肽提供基础。
自抗菌肽首次被发现,人们已从细菌、真菌、两栖类、高等动植物乃至人类中发现并分离获得抗菌肽。抗菌肽具有分子量小、良好的热稳定性和水溶性、广谱抗菌活性及作用细菌后不易产生耐药性、对病毒和癌细胞具有杀伤作用等特点受到关注,被广泛应用于医药、食品、化妆品及转基因动植物农业等领域,显示出巨大的应用前景。由于天然抗菌肽在两栖类动物机体中含量低且直接提取步骤复杂,化学合成20个以上的氨基酸成本高、难度较大且具有一定的污染性,因此,基因工程表达法是抗菌肽大规模生产的最佳途径。利用基因工程方法表达蛋白质已在酵母、昆虫、大肠杆菌等多种异源宿主中获得成功[20]。巴斯德毕赤酵母表达系统和大肠埃希菌表达系统是表达蛋白质的常用系统。巴斯德毕赤酵母表达系统生产的菌株稳定,可以处理含二硫键的表达蛋白并能对表达后的蛋白进行修饰,使得结构复杂的蛋白表达后仍能保持其生物活性[21-22]。现已报道的有14%的抗菌肽运用了巴斯德毕赤酵母表达系统表达成功[23],如Enterocin P[24]和ABP-CM4[25]等。然而,巴斯德毕赤酵母表达系统同时也有不足之处,例如蛋白质表达后难以纯化,相对比大肠埃希菌原核表达系统成本高,周期也相对较长等。大肠埃希菌表达系统是目前应用最多、最完善、研究最为成熟的表达系统,该表达系统具有生产工艺简单、周期短、能够低成本进行大规模发酵等特性,适合结构简单蛋白质的表达。抗菌肽结构简单,不同于结构复杂的蛋白质需要经过翻译后的修饰加工过程才能转化成活性形式,故本研究选用大肠杆菌原核表达系统进行表达[26]。因抗菌肽分子量小,难以折叠正确和稳定表达,易被宿主细胞中的酶水解,并且自身的抗菌作用会对宿主细胞产生毒性,目前对抗菌肽的原核表达几乎都采用融合表达[27-28],该表达方式便于纯化,提高融合蛋白的可溶性表达,可避免蛋白酶作用以提高蛋白稳定性[29],又可使宿主细胞免于表达蛋白的毒性,目前通过融合表达的方法已成功获得多种抗菌肽。
In-Fusion HD是一种相比于传统克隆技术更加简便、快速、高效的克隆技术,反应时间仅需15 min,同时具备不受限制性内切酶酶切位点限制的特点,克服了传统克隆技术连接效率低、耗时长且需要特定限制性酶切位点的缺陷。Novagen的pET系统因基因被克隆到不被大肠埃希菌RNA聚合酶识别的T7启动子之下而成为在大肠埃希菌中蛋白表达的首选,所以只有加入T7RNA聚合酶后,才会有表达。克隆到pET载体的基因是被关闭的,不会因为产生的蛋白对细胞有毒性而引起质粒不稳定。重组质粒转移到染色体上,含有一拷贝由lacUV5控制的T7RNA聚合酶基因的表达宿主中,并通过加入IPTG诱导表达;也可通过ICE6感染原始克隆宿主菌来提供T7RNA聚合酶。对于使用大肠埃希菌启动子系统有困难的部分基因已在pET系统中实现稳定克隆和表达。T7RNA聚合酶的选择性和活性使得几乎所有细胞资源都用于目标基因表达,诱导后几小时目标产物就可超过细胞总蛋白的50%。pET-32a(+)中带有硫氧还蛋白标签,使可溶性融合蛋白得到更大量的表达[30],并能促进蛋白质的正确折叠[31-32]。本研究选用了pET系统中的pET-32a(+)作为构建重组质粒的载体,PCR得到目的基因,运用克隆高效、简便、快速的In-Fusion HD技术成功获得了重组质粒Spinosan-D-pET-32a(+)。
规模化制备技术的研究,是开发和利用抗菌肽的基础和保障。本研究利用原核表达技术成功获得具有抗菌活性的抗菌肽Spinosan-D,是对规模化制备技术的有益探索。在今后的工作中,尚有以下几方面值得进一步深入研究:一是优化含Spinosan-D-pET-32a(+)的E.ColiBL21(DE3)pLysS大肠埃希菌重组菌株的诱导表达条件或优化Spinosan-D成熟肽基因;二是在本研究基础上,开展棘胸蛙抗菌肽Spinosan-D原核表达的优化试验,以进一步提高抗菌肽Spinosan-D的表达量;三是可开展抗菌肽Spinosan-D在真核生物表达系统中的分泌表达研究,比较不同表达系统的表达量,生物活性及试验成本等。
