蓝莓花色苷提取物对人脂肪干细胞增殖、分化和脂质积累的影响
2019-07-20陈晓彤马思思郑婷婷李亚丽邓远乐阴文娅
陈晓彤,马思思,郑婷婷,陈 洁,李亚丽,邓远乐,何 方,阴文娅,*
(1.四川大学华西公共卫生学院,四川 成都 610041 ;2.德阳市人民医院,四川 德阳 618000 ;3.四川大学华西医院甲状腺乳腺外科,四川 成都 610041 )
在过去的几十年里,世界各国居民体力活动明显减少,饮食中脂肪和精制糖大幅增加,导致肥胖人数急剧增多[1]。由此诱发的肿瘤、心血管疾病、代谢综合征、2型糖尿病等一系列慢性疾病严重影响着人们的生活质量[2-5]。2015年全球疾病负担调查显示肥胖在全世界范围内影响了6亿370万成人和1亿770万儿童,包括中国在内的70 个国家中,肥胖患病率较1980年翻了一倍,高身体质量指数人群死亡人数达400万[6]。肥胖已成为全球非常严重的公共卫生问题。
脂肪组织的扩张有两个途径:增生和肥大[7-8]。研究表明前体脂肪细胞的增殖分化会影响脂肪细胞的数量和体积变化[9],脂肪细胞不仅是储存过剩能量的场所,还会通过分泌如过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ)、脂联素、瘦素等脂肪细胞因子调节体内的葡萄糖平衡、胰岛素敏感性和胰岛素抵抗等[10-12],其可以直接参与肥胖相关的致病过程。因此,通过抑制脂肪细胞增生和肥大来控制脂肪组织的过度生长可能是治疗肥胖的一个可行策略。脂肪间充质干细胞(adiposed-derived stem cells,ADSCs)是一种来源于脂肪组织、具有自我更新能力、通常处于静止状态且未分化的干细胞,在离体条件下,能被外界诱导分化成为特定的脂肪细胞并形成脂肪组织[13]。以人ADSCs(human ADSCs,hADSCs)建立体外分化模型,其生物外推性比多数研究采用的鼠源3T3-L1前脂肪细胞更强,更能反映机体内部真实生理环境及人体生理特点,这种模型可以更加清晰地反映脂肪组织生成过程中发生的一系列动态改变。
蓝莓含有丰富的生物活性化合物,花色苷是其主要功效物质,具有抗氧化[14]、抗肿瘤[15]、抗炎[16]、预防心血管疾病[17]等健康益处。近年来发现花色苷具有抗肥胖作用[18],其作用于鼠源3T3-L1前脂肪细胞,可以减少细胞数量,抑制其分化为成熟的脂肪细胞[19-21]。也有少数研究使用成熟的人脂肪细胞,发现花色苷可以激活PPARγ,诱导脂联素的表达[22]。有关花色苷对于不同分化周期人脂肪细胞的作用及机制尚缺乏系统研究。本研究采用蓝莓花色苷提取物干预hADSCs,观察其对不同分化时期脂肪细胞增殖、分化和脂质积累的影响,为其是否在hADSCs中具有潜在的抗脂肪形成能力提供参考依据。
1 材料与方法
1.1 材料与试剂
蓝莓花色苷提取物(按参考文献[23]方法提取,矢车菊素3-O-葡萄糖苷质量分数10.75%、芍药色素3-O-葡萄糖苷质量分数0.80%)由军事科学院军事医学研究院环境医学与作业医学研究所提供。
磷酸盐缓冲液(phosphate buffered saline,PBS)、高糖DMEM培养基、DMEM/F12(1∶1)培养基、抗生素(青霉素及链霉素混合)和胰蛋白酶 美国Hyclone公司;胎牛血清 美国Gibco公司;人胰岛素 丹麦诺和诺德公司;医用地塞米松注射液 天津药业焦作有限公司;I型胶原酶、油红O染色剂、3-异丁基-1-甲基黄嘌呤(3-isobutyl-1-methylxanthine,IBMX)、吲哚美辛、噻唑蓝(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide) 美国Sigma公司;AdipoRedTM检测试剂 美国Lonza公司;乳酸脱氢酶测定试剂盒、葡萄糖测定试剂盒 南京建成生物工程研究所有限公司;TRIzol试剂 美国Invitrogen公司;第一链cDNA合成试剂盒 瑞士Roche公司;SsoFast®Eva Green超混合液美国Bio-Rad公司。所有的寡核苷酸引物均由北京擎科新业生物技术有限公司合成;其他试剂均为进口分析纯,实验用水均为超纯水。
1.2 仪器与设备
SANYAOM10-11AL CO2型恒温细胞培养箱 日本ANTYO公司;BX50倒置显微镜 日本Olympus公司;酶标仪、CFX96 Touch实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qPCR)仪美国Bio-Rad公司;高压灭菌锅 美国Zealway公司;超低温冰箱、恒温气浴摇床 美国热电公司;KQ-500DV型数控超声波清洗器 昆山舒美公司;Bcm-1000型无菌超净工作台 苏州苏净集团苏州安泰空气技术有限公司;BP301S电子分析天平 德国Sartorius公司;EnVision多标记微孔检测仪 美国PerkinElmer公司。
1.3 方法
1.3.1 hADSCs的制备和成脂分化的准备
本实验脂肪组织取自四川大学华西医院乳腺外科手术中预防性切除的健康脂肪组织,该研究协议书经四川大学伦理委员会批准,并按照《赫尔辛基宣言》的指导原则进行。所有受试者都知情同意。hADSCs及其分化后脂肪细胞的分离依照Zuk等[24]的实验方案并略作修改。具体如下:将组织切碎后,用质量分数0.1%的I型胶原酶消化,于37 ℃、120 r/min恒温摇床消化45 min,之后加入含体积分数10%胎牛血清的DMEM/F12培养基,在200 r/min离心10 min获得高密度的基质血管组分颗粒(stromal vascular fraction,SVF)。SVF悬浮在完全培养基(含10%胎牛血清的DMEM/F12培养基、100 U/mL青霉素和100 μg/mL链霉素),过200 nm的不锈钢细胞筛。过滤后的SVF悬浮培养在培养瓶中,在37 ℃、5%的CO2以及潮湿的环境中孵育48 h后,培养瓶用无菌PBS冲洗,去除残余非黏附红细胞。细胞在P3~P7代用于实验。每一组由3 个或4 个不同个体的hADSCs组成。
成脂分化:细胞以1×105个/mL密度接种在24 孔板,在完全培养基中培养72 h,之后在成脂诱导培养基中进行成脂诱导14 d(培养基中添加0.5 mmol/L IBMX、0.2 mmol/L吲哚美辛、1 μmol/L医用地塞米松注射液和5 μg/mL人胰岛素)。此条件下,超过80%的细胞分化为成熟脂肪细胞。
1.3.2 乳酸脱氢酶测定及细胞活性检测
选取对数生长期的hADSCs制成细胞悬液,取96 孔培养板,每孔加入200 μL hADSCs悬液,细胞密度为5×104个/mL。于37 ℃、5% CO2培养箱中培养24 h后弃去培养液,每孔加入200 μL含75 μg/mL蓝莓花色苷提取物的完全培养基,并以不含有样品的完全培养基为空白对照,干预24、48、72 h后分别收集上清液,实验重复3 次,做3 个平行。按乳酸脱氢酶测定试剂盒的操作说明测定乳酸脱氢酶释放率。
采用Kim等[21]的MTT法并加以改进。选取对数生长期的hADSCs以每孔200 μL、5×104个/mL的细胞密度接种于96 孔板,置于37 ℃、5% CO2的条件下培养24 h,弃上清液。1)对对数生长期hADSCs的影响:每孔加入200 μL含有质量浓度分别为25、50、75、100、125、175 μg/mL的蓝莓花色苷提取物的完全培养液,干预24、48 h。2)对融合期hADSCs的影响:在相同条件下培养至细胞进入融合期,每孔加入200 μL含有与对数生长期相同质量浓度梯度的蓝莓花色苷提取物的成脂诱导培养液,干预24、48 h。3)对分化期hADSCs的影响:在相同条件下培养至细胞融合以后,每孔分别加入200 μL含8.75、17.5、25 μg/mL蓝莓花色苷提取物的成脂诱导培养液,连续诱导培养14 d至细胞完全成熟分化。4)对成熟期hADSCs的影响:将hADSCs培养完全分化后,加入200 μL含有与对数生长期相同质量浓度梯度含蓝莓花色苷提取物的完全培养液,分别干预24、48 h。以上4 组实验均以不含有样品的相同培养液为空白对照,每组设置6 个复孔,重复3 次。之后,每孔中加入MTT储存液20 μL继续无菌培养4 h,弃去上清液,每孔加入200 μL DMSO,气浴摇床中150 r/min摇晃4 min,酶标仪于490 nm波长处测定OD值。按下式计算其对各阶段脂肪干细胞增殖情况的相对抑制率。

1.3.3 油红O染色和Adipored法检测
hADSCs油红O染色:将hADSCs以1×105个/mL的细胞密度接种于24 孔板,每孔加入1 mL培养液,并置于37 ℃、5% CO2的条件下培养至细胞完全融合后,分别加入含有质量浓度梯度为8.75、17.5、25 μg/mL的蓝莓花色苷提取物成脂诱导培养液,以不含样品的成脂诱导培养液为空白对照组,每组设置3 个复孔。连续诱导分化14 d后,在倒置显微镜下观察其形态学变化,在第14天,将细胞固定在10%福尔马林(pH 7.4)溶液中用油红O染色法对细胞进行染色。
Adipored法检测:在与上述相同条件下连续诱导分化14 d后,根据AdipoRed试剂盒的说明书,用PBS(pH 7.4)清洗细胞后,每孔加入1 mL PBS及30 μL AdipoRed试剂,10 min后,将24 孔培养板放入多标记微孔板检测仪中,于激发波长485 nm、发射波长572 nm处测定荧光强度。将24 孔培养板置于倒置荧光显微镜下观察结果并拍照。
1.3.4 葡萄糖摄取实验
完全分化的脂肪细胞接种于24 孔板中,在高糖DMEM完全培养液中加入质量浓度梯度分别为8.75、17.5、25 μg/mL的蓝莓花色苷提取物,以高糖DMEM完全培养液为阴性对照组,以加入含10 μmol/L的罗格列酮(胰岛素敏感性增强剂)的高糖DMEM为阳性对照组,每组设置3 个复孔,实验重复3 次。之后分别在基础状态和1 μmol/L胰岛素存在的情况下干预72 h,收集上清液并于4 ℃保存。根据葡萄糖试剂盒(葡萄糖氧化酶-过氧化物酶法[25])说明书,检测各实验组中上清液以及原高糖DMEM培养基葡萄糖的含量,各实验组的葡萄糖消耗量为原高糖DMEM培养基葡萄糖量与相应的实验组培养基葡萄糖量之差。
1.3.5 RNA提取与qPCR分析
使用TRIzol法[26]进行总RNA的分离。使用反转录试剂盒,并采用20 μL反应体系从1 μg总RNA中得到cDNA。qPCR使用SsoFast®Eva Green超混合液,并在CFX96 Touch qPCR仪上进行检测。反应条件为:95 ℃保持2 min(预变性);98 ℃保持5 s(变性),59 ℃保持30 s(退火),98 ℃保持5 s(延伸),40 个循环。在每个样本中,基因表达水平均与内参蛋白(β-actin)的表达相一致。样本中基因的相对表达水平均由仪器软件CFX Manager 3.0使用Pfaffl方法自动计算。表1引物用于扩增人脂联素[27]、PPARγ和内参蛋白(β-actin)[28]基因。

表1 qPCR所用引物Table 1 Sequences of primers used for quantitative real-time PCR
1.4 数据统计分析
实验重复3 次,结果用 ±s表示。实验数据结果采用SPSS 17.0软件进行描述性分析,单因素方差分析比较显著性,检验水准α=0.05。
2 结果与分析
2.1 蓝莓花色苷提取物对hADSCs的细胞毒性

图1 hADSCs的乳酸脱氢酶释放率Fig. 1 Lactate dehydrogenase release rate from hADSCs
由图1可知,hADSCs经蓝莓花色苷提取物干预24、48、72 h后,分别测量3 个时间点乳酸脱氢酶释放率,其释放率分别为88.7%、82.2%和53.5%,乳酸脱氢酶释放率均低于100%,说明处理组和空白对照组相比没有更多的乳酸脱氢酶释放。且处理72 h后的乳酸脱氢酶释放率相比于24 h和48 h均显著降低(P<0.05)。
2.2 蓝莓花色苷提取物对不同时期hADSCs增殖的影响
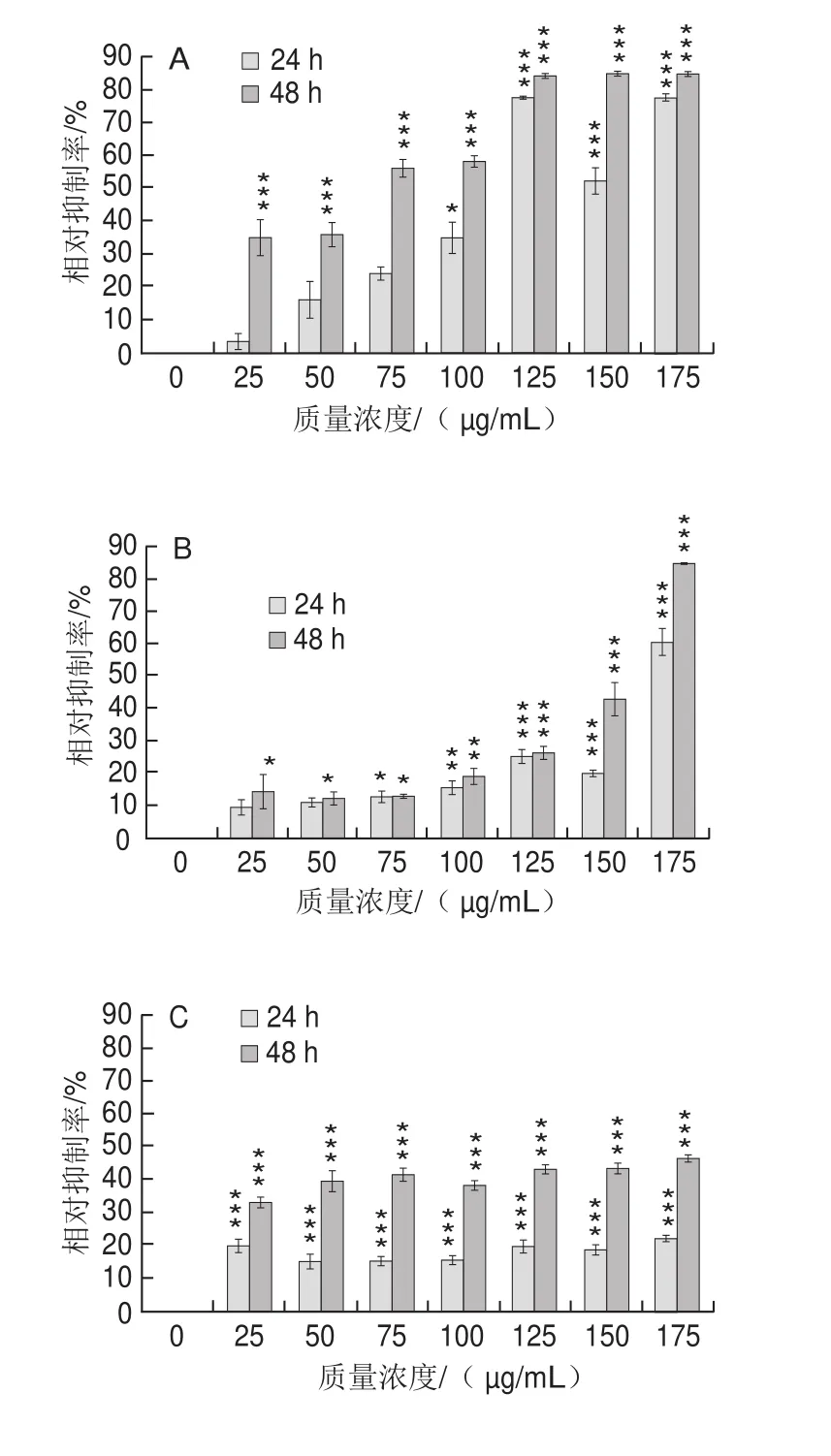
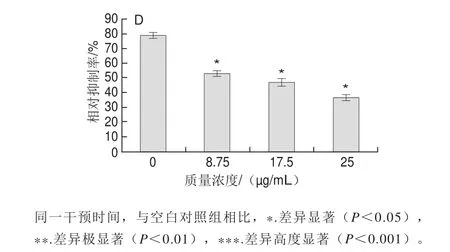
图2 蓝莓花色苷提取物对hADSCs对数生长期(A)、融合期(B)、成熟期(C)、分化期(D)的生长抑制关系Fig. 2 Inhibitory effect of blueberry anthocyanins extract on hADSCs in logarithmic (A), conf l uent growth (B), maturation (C) and differentiation (D) phases
图2 是采用MTT法测定细胞分化不同时期不同时间点的活细胞计数情况。对数生长期高质量浓度组(100~175 μg/mL)干预24 h和48 h后,与未处理的对照细胞相比(0 μg/mL)均高度显著抑制hADSCs增殖(P<0.0 0 1);而较低质量浓度组(2 5、5 0、75 μg/mL)只在处理48 h后对hADSCs出现生长抑制效果(P<0.01);融合期高质量浓度组对hADSCs的增殖抑制作用明显高于低质量浓度组;成熟期完全分化成熟的脂肪细胞不会再增殖,经蓝莓花色苷提取物干预24 h和48 h后,与空白对照相比均减少了细胞(非增殖)的数量。蓝莓花色苷提取物在hADSCs整个分化期的干预中,显著降低了最终细胞数(P<0.05),但蓝莓花色苷的3 种质量浓度(8.75、17.5、25 μg/mL)组之间无显著差异。
2.3 蓝莓花色苷提取物对分化的hADSCs脂质积累的影响

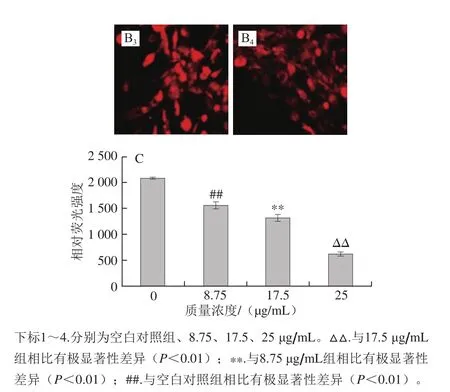
图3 油红O染色(A)(×200)和AdipoRed实验(B)(×200)观察蓝莓花色苷提取物对hADSCs 分化抑制剂量-效应关系及定量评价(C)Fig. 3 Dose-dependent inhibition and quantitative evaluation (C) of blueberry anthocyanins on intercellular lipid accumulation of hADSCs by Oil Red O staining (A) (× 200) and AdipoRed assay (B) (× 200)
由图3可知,成脂诱导14 d后,细胞已经融合且形态变细变小,镜下呈黑色斑块状,与空白对照组相比,随着蓝莓花色苷质量浓度逐渐增大被染红的脂滴逐渐减少;而在AdipoRed实验拍下的照片中将红色荧光强度与空白对照对比发现,随蓝莓花色苷质量浓度增大,红色荧光的亮度也逐渐减弱。两组实验拍下的照片均表明蓝莓花色苷能抑制分化hADSCs中的脂质积累。
图3C中AdipoRed相对荧光强度数据也显示,蓝莓花色苷提取物干预组细胞内脂肪生成量均低于空白对照组,干预组的分化均受到了抑制,其分化抑制率具有显著性差异,这与照片的结果保持一致。当蓝莓花色苷提取物质量浓度分别为8.75、17.5、25 μg/mL时相对荧光强度抑制率分别为25.3%、36.6%、70.4%(P<0.01)。
2.4 蓝莓花色苷提取物对人成熟脂肪细胞葡萄糖吸收的影响

图4 蓝莓花色苷提取物对hADSCs葡萄糖吸收的影响Fig. 4 Effects of blueberry anthocyanins on glucose uptake in hADSCs
由图4可知,阳性对照罗格列酮组高度显著增加了葡萄糖的消耗量(P<0.001);当培养液中不加入胰岛素时,在17.5、25 μg/mL蓝莓花色苷作用下,葡萄糖摄取量显著增加(P<0.05);而培养液中加入胰岛素时,蓝莓花色苷提取物质量浓度分别为8.75、17.5、25 μg/mL时,葡萄糖摄取量也显著增加(P<0.05,P<0.01,P<0.001)。因此,不论是否加入1 μmol/L胰岛素,葡萄糖摄取实验均表明蓝莓花色苷可以显著增加人成熟脂肪细胞的葡萄糖消耗。
2.5 蓝莓花色苷提取物对hADSCs分化过程中PPARγ、脂联素表达的影响
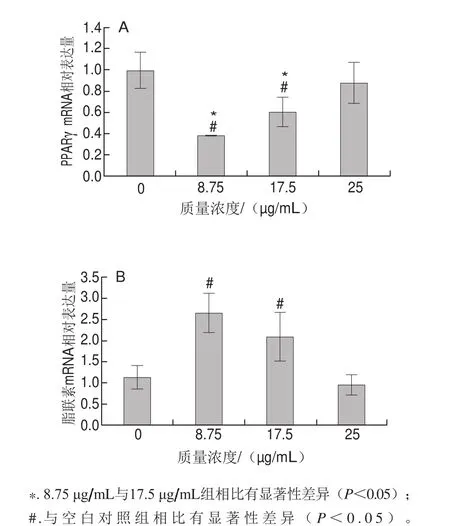
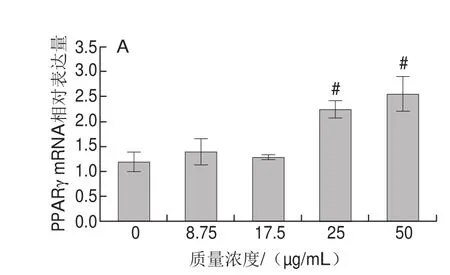
图5 分化期蓝莓花色苷提取物干预后PPARγ(A)与脂联素(B)的基因表达情况Fig. 5 Gene expression of PPARγ (A) and adiponectin (B) in differentiating adipocytes treated with bluberry anthocyanins
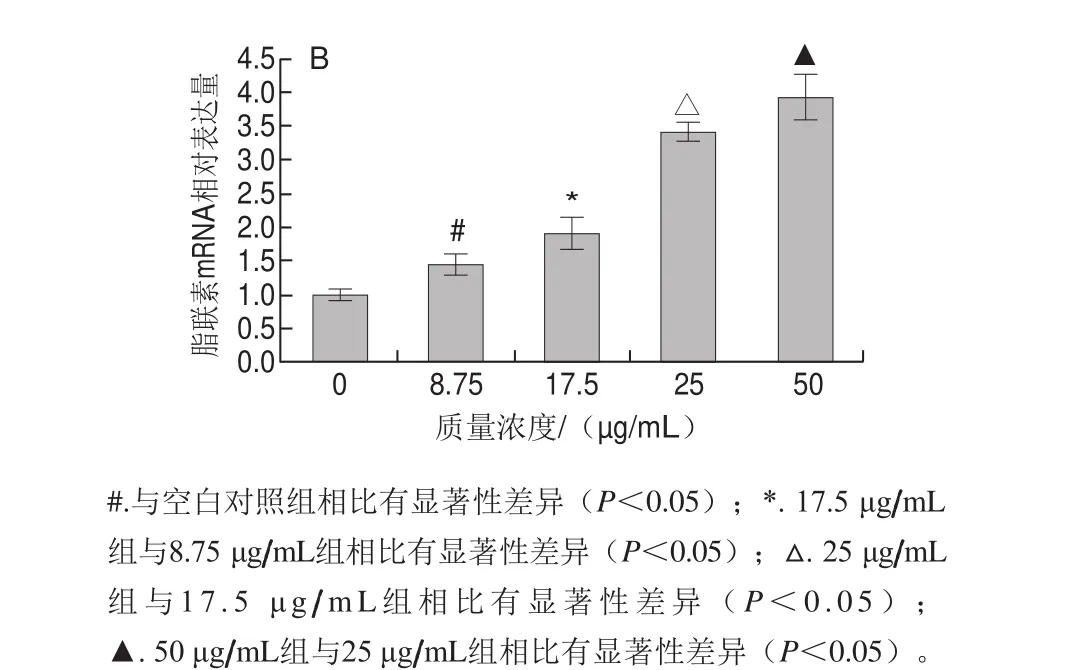
图6 成熟期蓝莓花色苷提取物干预后PPARγ(A)和脂联素(B)的基因表达情况Fig. 6 Gene expression of PPARγ (A) and adiponectin (B) in mature adipocytes treated with blueberry anthocyanins
由图6可知,干预完全分化后的hADSCs:与空白对照组相比,随蓝莓花色苷提取物质量浓度增加,脂联素基因表达显著升高(P<0.05),而PPARγ表达情况则与分化期的表达情况相反,在25、50 μg/mL提取物干预下,PPARγ的表达显著上调(P<0.05)。
3 讨 论
由图5可知,干预分化期的hADSCs:与空白对照组相比,低质量浓度的蓝莓花色苷提取物组(8.75 μg/mL和17.5 μg/mL)使PPARγ表达下调(P<0.05);脂联素基因表达上调(P<0.05)。
小鼠胚胎成纤维细胞(前脂肪细胞)3T3-L1细胞系广泛地用于研究功能性食品成分对肥胖和脂肪细胞的影响[29]。前期通过此细胞系研究紫甘薯花色苷提取物,发现其显著抑制前脂肪细胞的增殖和分化,减少脂质积累[19]。但是,3T3本身为小鼠杂交瘤细胞株,很难在研究过程中区分是抑制脂肪生成还是抗肿瘤效果。且它已经失去部分干细胞特性,不能完全代表健康正常的前脂肪细胞特性。因此开发更近似于人体的并且稳定易获取的细胞研究体系是目前研究的热点。有研究以前体hADSCs作为体外模型来评估各种植物化学物对肥胖的影响[30-31]。
本研究建立了hADSCs体外模型,并根据文献[22]选择了蓝莓花色苷提取物干预质量浓度。观察到其可以显著抑制对数生长、融合期的hADSCs增殖并在选择的剂量范围内呈剂量-效应关系,这些时期都是脂肪组织增殖的关键期。在这些时期对细胞增殖的抑制呈剂量效应关系可以减少功能成熟的脂肪细胞的产生。实验还观察到蓝莓花色苷提取物逐步促进hADSCs中乳酸脱氢酶的释放,表示其可以增加细胞膜通透性并且促进细胞坏死,这与之前的研究结果[32-33]一致。但即使提取物浓度增高,乳酸脱氢酶的释放仍低于100%。在同类研究中发现,花色苷提取物通过改变细胞周期,诱导3T3-L1前脂肪细胞sub-G1调亡[32]。因此,对于hADSCs增殖的抑制作用可能通过增加细胞膜的通透性及影响细胞周期造成。脂肪组织的扩张不仅有脂肪细胞数量的增加,还有脂质积累引起的脂肪细胞肥大。在本研究中油红O染色和AdipoRed实验结果显示,蓝莓花色苷提取物可以减少脂肪细胞分化过程中脂质的积累,随着蓝莓花色苷提取物质量浓度增加抑制效果逐渐加大,相对荧光量数据也表明同样结果。尽管蓝莓花色苷提取物在整个分化期都可以使细胞增殖明显减少,但是不同蓝莓花色苷质量浓度间的细胞增殖没有差异。因此,蓝莓花色苷提取物减少脂质积累的效果,是由细胞内脂质含量降低和细胞增殖被抑制两方面原因导致[34]。
持续的高血糖会导致组织发生胰岛素抵抗并且损伤胰岛β细胞,从而降低胰岛素的分泌和合成,进一步加剧胰岛素抵抗的影响[35]。胰岛素抵抗出现在代谢综合征的早期阶段,因此,改善胰岛素敏感性和胰岛素的维持状态可以预防或延缓2型糖尿病的发展[36]。脂肪细胞作为主要的胰岛素靶细胞,在糖尿病的发生发展中起着重要作用[37]。之前的研究显示,花色苷可在体内外干扰脂肪细胞的功能,预防代谢综合征[38-39]。因此在本研究中,使用葡萄糖氧化酶-过氧化物酶法检测[40],结果证明不论在基础状态或胰岛素刺激状态,蓝莓花色苷提取物均显著增加脂肪细胞的葡萄糖消耗。这与之前的研究具有一致性,即矢车菊素-3-O-β-葡萄糖苷及其代谢产物原儿茶酸可以增强脂肪细胞的葡萄糖摄取,促进3T3-L1细胞中的胰岛素样活性,此研究也证明多酚作用的关键机制之一可能是其提高了PPARγ的活性[22]。
脂联素在脂肪细胞中特异高表达,被认为是一种与肥胖和2型糖尿病[41]相关的最重要因子。喂食含大量花色苷的食物后,小鼠附睾的白色脂肪组织中,脂联素基因表达显著上调[42],类似的效果在花色苷作用后的人类脂肪细胞中也有发现[43]。在本研究中,蓝莓花色苷提取物可以增加成熟脂肪细胞中脂联素的表达且有剂量效应关系。在低质量浓度蓝莓花色苷提取物组,脂肪细胞分化的末期由于脂质的积累和脂肪细胞大小的显著增加,导致脂联素基因表达增加,从而改善和维持脂肪细胞的健康。配体激活转录因子PPARγ不仅是脂肪细胞分化的主调节因子,其在脂肪细胞成熟期也控制着一些特异性基因的表达[42]。在本研究中,采用蓝莓花色苷提取物进行干预,分化期与成熟期hADSCs中PPARγ的表达不相同。分化期的hADSC与空白对照组相比,显著下调PPARγ的表达,说明蓝莓花色苷能抑制脂肪细胞的分化。结果与之前的花色苷类研究一致,该研究认为花色苷可能与PPARγ的受体相互作用[44]。但也有研究表明花色苷对脂肪细胞特异基因的上调机制可能并不是通过影响PPARγ[45],而是激活了腺苷酸激活蛋白激酶通路[38,46]。与之相反,蓝莓花色苷提取物在干预完全分化的人脂肪细胞后,上调PPARγ的表达。这种现象正如之前研究提到,噻唑烷二酮类药物活化PPARγ基因可以改善胰岛素抵抗状态[47],这种对PPARγ基因的激活可能由于一部分胰岛素抵抗作用的减少所造成。但蓝莓花色苷提取物对脂肪细胞分化相关关键转录因子表达的影响分析,还需要进一步阐明其潜在机制。
综上所述,蓝莓花色苷提取物显著降低了人脂肪细胞的增殖能力,抑制了其分化,减少了成熟脂肪细胞及脂质积累。这些影响可能由于在提取物干预下hADSCs分化的早期阶段,PPARγ表达下调;分化完成后成熟的人脂肪细胞中,葡萄糖摄取、代谢以及脂联素和PPARγ表达水平增加。因此,蓝莓提取物能显著抑制人体脂肪细胞的增殖和分化过程中的脂质积累,并且增加完全分化成熟后脂肪细胞的葡萄糖摄取和脂肪细胞因子的基因表达。这些效应有助于蓝莓花色苷提取物的抗肥胖和抗糖尿病作用。
