壳寡糖对小鼠急性酒精性肝损伤的保护作用
2019-07-20丁荣荣姜启兴夏文水许艳顺
丁荣荣,姜启兴,*,王 斌,夏文水,杨 方,许艳顺
(1.江南大学食品学院,江苏 无锡 214122 ;2.江苏省食品安全与质量控制协同创新中心,江苏 无锡 214122 )
酒精性肝损伤是由于长期饮酒造成的。肝细胞脂质过氧化导致脂肪肝,接着出现炎症,最终导致肝硬化甚至肝癌[1]。根据世界卫生组织2014年关于酒精与健康的全球状况统计,全球有330万 人死于有害使用酒精,占所有死亡人数的5.9%。酒精消费会导致较低龄化死亡和残疾。该研究发现,过度饮酒是200多种疾病和伤害的诱因。人体内有3 种主要的代谢途径:肝脏、皮肤和呼吸系统;超过90%的酒精被肝脏的酶系统代谢[2],所以肝脏是酒精损害的主要器官。
壳寡糖是指通过降解壳聚糖获得的聚合度在2~20之间的寡糖。与壳聚糖相比,壳寡糖具有良好的水溶性,易于在体内被吸收、转化和利用,可以发挥更重要的生物功能[3]。目前已有研究表明壳寡糖具有很好的抗氧化活性[4]、抑菌活性[5-6]、抗炎止血活性[7]、辅助降血脂作用[8-9]、辅助治疗糖尿病的作用[10-11]。2014年,壳寡糖已被批准用于食品的新食品原料。近年来关于壳寡糖作用保护酒精性肝损伤已有部分研究,刘红云等[12]通过建立急性酒精中毒模型说明壳寡糖对于酒精性肝损伤有保护作用;刘亮亮等[3]解释了壳寡糖对长期慢性酒精性肝损伤模型的保护作用;Cho等[13]研究了壳寡糖乳酸盐对乙醛脱氢酶活性的影响,突出强调了乙醛脱氢酶的作用。本研究以壳寡糖为原料,在前人的研究基础上,参照《保健食品检验与评价技术规范》(2003版)建立急性酒精性肝损伤模型,除了从血清指标来阐明壳寡糖的保护作用外,更加强调对一些肝脏指标的影响,进一步探讨壳寡糖对肝脏的保护作用,为开发安全有效的护肝产品提供理论支持。
1 材料与方法
1.1 动物、材料与试剂
SPF级雄性昆明小鼠(6~8 周)购于北京维通利华实验动物技术有限公司,生产许可证号:SCXK(京)2016-0011,动物质量证书编号:11400700264351,动物使用许可证号:SYXK(苏)2016-0045。
壳寡糖(平均分子质量1 299 Da、脱乙酰度85%)为实验室制备。
联苯双酯滴丸(批号:170505) 北京协和药厂;乙醇(体积分数95%,药用级) 上海阿拉丁生化科技股份有限公司;谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、总胆固醇(total cholesterol,TC)、谷胱甘肽(glutathione,GSH)、超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)试剂盒 南京建成生物工程研究所。
1.2 仪器与设备
LAB DANCEP S25磁力搅拌器 德国IKA公司;DK-8AXX电热恒温水浴锅 上海一恒科技有限公司;4K15冷冻大容量离心机 德国Sigma公司;UV-1800紫外-可见分光光度计 日本岛津公司;M5酶标仪 美国Molecular Devices公司;ECLIPSE生物显微镜 日本尼康公司;超低温冷冻冰箱 日本三洋电机公司。
1.3 方法
1.3.1 动物饲养及分组
动物实验室温度20~26 ℃,相对湿度40%~70%。明暗期为12 h/12 h,小鼠自由摄取食物和饮水。适应性喂养1 周后,将60 只雄性昆明小鼠随机分成对照组(C)、酒精模型组(M)、阳性对照组(B)、低剂量壳寡糖组(CL)、中剂量壳寡糖组(CM)、高剂量壳寡糖组(CH),每组10 只。阳性对照组每天以0.2 mL/20 g mb给药灌胃150 mg/kg联苯双酯;根据国家规定壳寡糖食用量不超过0.5 g/d,3 个剂量壳寡糖组每天分别灌胃70、140、210 mg/kg壳寡糖,对照组和酒精模型组小鼠给予等体积的蒸馏水。
根据《保健食品检验与评价技术规范》(2003版),连续给药30 d后,酒精模型组、阳性对照组和3 个剂量壳寡糖组给予12 mL/kg mb的体积分数50%乙醇溶液,对照组给予蒸馏水并禁食16 h。注射60 mg/kg mb的戊巴比妥钠溶液后采血分离血清,处死动物。取肝脏称质量后用液氮速冻于-80 ℃备用。
1.3.2 小鼠体质量、进食量及肝脏系数的测定
小鼠刚进入动物房时称体质量为初始体质量/g,最后处死前称体质量为最终体质量/g。进食量和肝脏系数分别根据公式(1)、(2)计算。

1.3.3 生化指标测定
根据试剂盒说明书测定血清中ALT、AST活力和TC浓度,以及质量分数10%肝脏匀浆中SOD活力和GSH、MDA含量。
1.3.4 组织病理学观察
各组小鼠肝脏组织于体积分数10%福尔马林固定24 h后,通过石蜡切片、苏木精-伊红(hematoxylin-eosin,HE)染色来进行组织病理学观察。
1.4 数据统计与分析
2 结果与分析
2.1 壳寡糖对小鼠体质量、进食量以及肝脏系数的影响
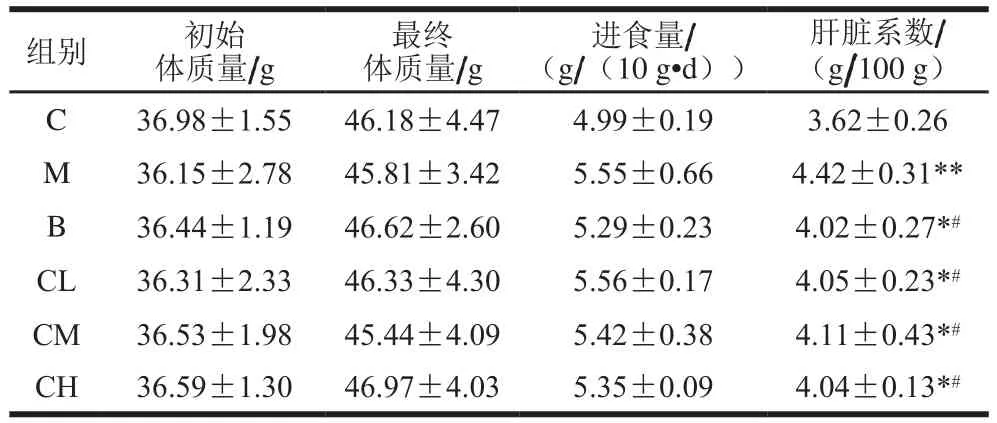
表1 壳寡糖对小鼠体质量、进食量以及肝脏系数的影响Table 1 Effect of COS on body mass, food intake and liver coefficient of mice
从表1可见,初始体质量、最终体质量以及进食量在各个组别之间均没有显著性差异。说明灌胃壳寡糖未对小鼠的生长造成影响。模型组肝脏系数显著高于对照组(P<0.05),表明在摄入酒精后肝脏因受损而肿大;与模型组相比,阳性对照组和壳寡糖各剂量组肝脏系数均显著降低(P<0.05),说明壳寡糖和阳性对照可以缓解小鼠肝脏受损情况,阳性对照组的效果比壳寡糖好。
2.2 壳寡糖对酒精性肝损伤小鼠血清ALT、AST活力和TC浓度的影响
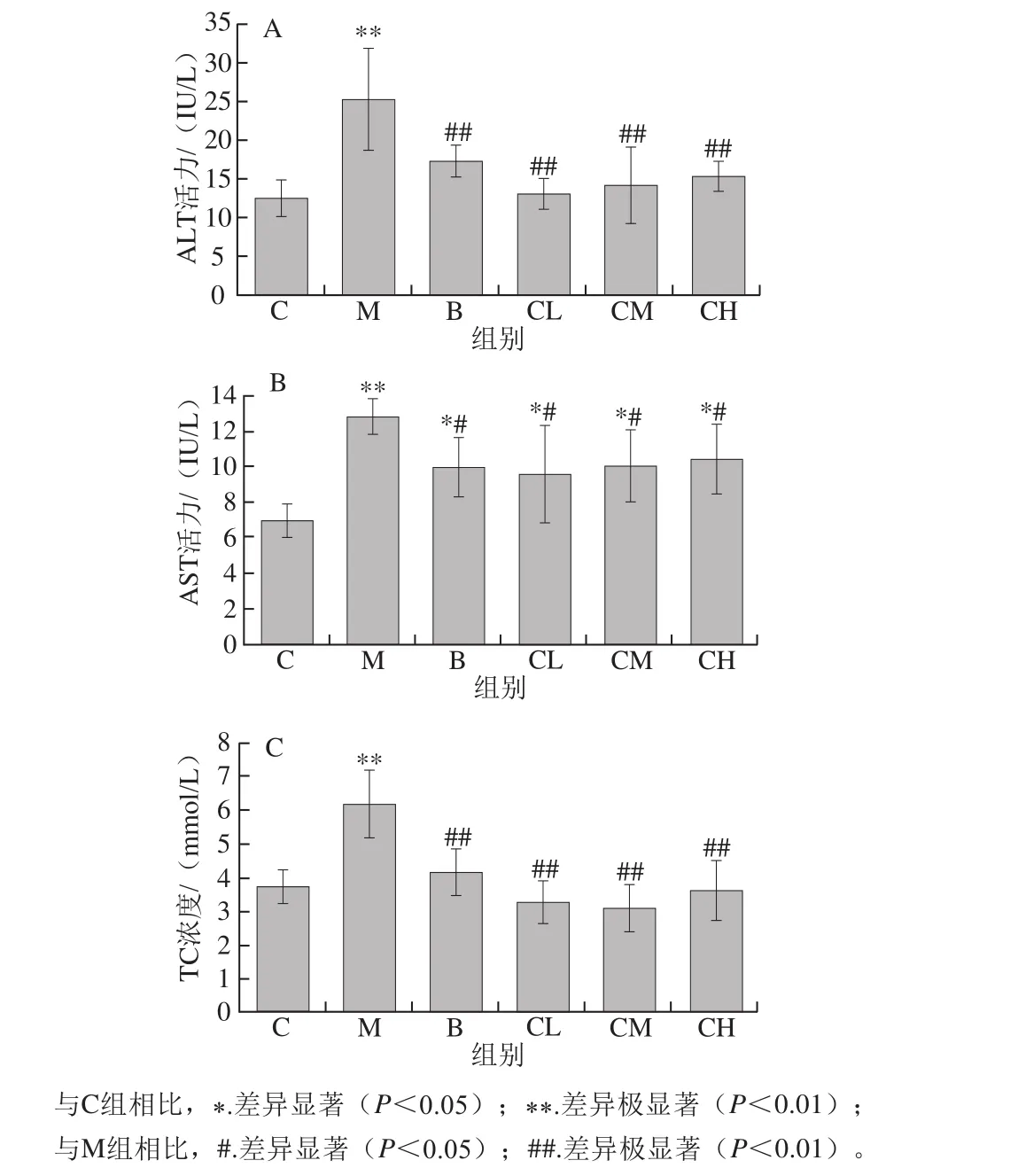
ALT、AST活力是反映肝细胞损伤的重要指标,肝细胞发生严重坏死时其活力会明显升高[14]。从图1中可知,与正常组相比,模型组ALT、AST活力均极显著增加(P<0.01),表明酒精性肝损伤模型成功建立。与模型组相比,阳性对照组和壳寡糖各剂量组的ALT活力极显著降低(P<0.01),趋于正常水平。与模型组比较,阳性对照组和壳寡糖各剂量组AST活力显著降低(P<0.05),但和正常组比较有显著性差异(P<0.05)。总之,壳寡糖可抑制酒精引起的血清ALT、AST活力升高并改善肝功能。刘红云等[12]报道壳寡糖组ALT、AST活力较酒精组极显著降低,这与本研究结果一致。
酒精性脂肪肝与血脂有密切的关系。过量摄入酒精会导致肝脏脂质的积累,如果肝脏发生脂肪病变,血脂浓度则会增加[15-16]。与正常组比较,模型组血清TC浓度极显著升高(P<0.01),表明酒精摄入可能引起胆固醇堆积并影响脂质代谢。与模型组相比,壳寡糖组的血清TC浓度极显著降低(P<0.01),表明它可以改善脂肪堆积。刘亮亮等[3]报道与模型组相比,壳寡糖各剂量组均能显著降低TC浓度,且与正常对照组比较差异不明显,本研究结果与其一致。
2.3 壳寡糖对酒精性肝损伤小鼠肝脏SOD活力和GSH、MDA含量的影响
酒精会在人体的新陈代谢中产生大量的活性氧,影响机体的抗氧化系统,导致酒精性肝损伤,而体内的抗氧化剂会保护细胞免受活性氧的影响,但这些抗氧化剂的活性很容易被过量的脂质过氧化物清除,导致肝脏损伤[17]。
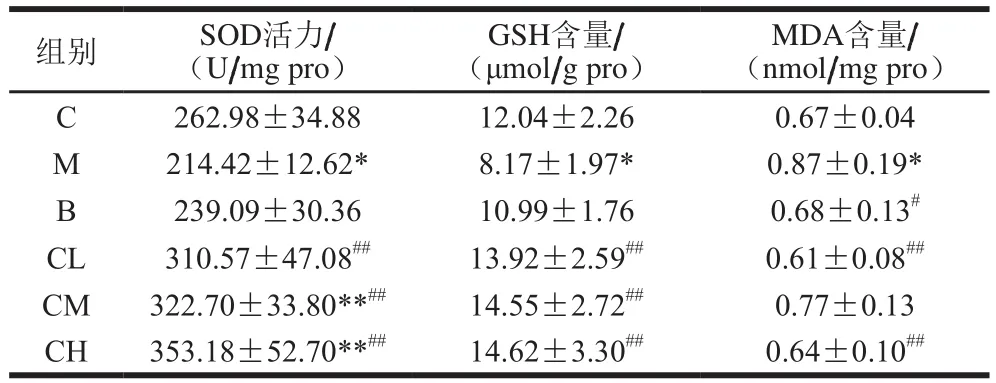
表2 壳寡糖对小鼠肝脏SOD活力和GSH、MDA含量的影响Table 2 Effect of COS on SOD activity and GSH and MDA contents in liver of mice
GSH和SOD在体内氧化与抗氧化能力之间的平衡中起着重要作用[18],由表2可知,与正常组相比,模型组的GSH含量、SOD活力均显著降低(P<0.05),这表明酒精引起小鼠肝脏中过氧化物水平的显著增加,并且使抗氧化能力下降。与模型组相比,壳寡糖组GSH含量、SOD活力极显著升高(P<0.01)。与模型组比较,低剂量和高剂量壳寡糖组的MDA含量极显著降低,而MDA是自由基作用于脂质过氧化的产物,通过测定MDA含量可以反映体内脂质过氧化的程度,它是膜脂质过氧化的常用指标[19-20]。这表明,壳寡糖能有效防止酒精摄入引起的小鼠肝细胞过度氧化,增强机体抗氧化能力可能在酒精性肝损伤的保护中起重要作用。

图2 壳寡糖对小鼠肝脏病理切片的影响(HE染色)(×100)Fig. 2 Photomicrographs of liver sections stained with hematoxylin and eosin (× 100)
由图2可知,在正常组中,肝小叶的结构清楚,肝细胞呈放射状排列且排列整齐,肝窦正常,细胞核结构清晰。相比之下,酒精灌胃后导致严重的肝损伤。模型组肝细胞排列无序,肝窦变窄、分散,而且可见点状坏死和炎症细胞。壳寡糖低剂量组和壳寡糖中剂量组肝细胞排列逐渐趋于整齐,但还可见少数炎症细胞。在壳寡糖高剂量组中,肝细胞排列整齐,肝窦已恢复正常,炎症细胞和点状坏死细胞明显减少,肝细胞雾化情况明显减少。
3 讨 论
本实验结果表明,壳寡糖能显著降低血清ALT、AST活力,改善肝功能;肝脏中肝脏系数、TC浓度、MDA含量也显著降低,有效地减少了脂肪的积累;GSH含量和SOD活力则显著增加,脂质过氧化程度降低;观察肝脏病理学切片可以明显看到壳寡糖组肝细胞排列趋于整齐,说明壳寡糖能有效缓解酒精引起的肝脏损伤。
目前对宿醉和肝脏保护方面的机理研究主要是提高肝组织的抗氧化能力、消除氧自由基、减少脂质过氧化、缓解脂肪堆积、调控代谢关键酶以及降低炎症反应这几个方面[21-22]。尽管酒精引起的肝毒性与不同的机制有关,但不断有证据表明氧化应激在酒精性肝疾病及其发病机理中十分重要[23-26],因为氧化应激会使肝功能紊乱,从而造成肝细胞损伤。氧化应激是指ROS产生及其消耗抗氧化防御系统,造成促氧化剂和抗氧化剂之间的不平衡。本实验中,壳寡糖组都显著提高了肝脏SOD活力和GSH含量,表明壳寡糖可能可以抑制乙醇诱导的脂质过氧化和谷胱甘肽降解,并通过抗氧化作用来降低酒精对肝脏的损害作用。壳寡糖的抗氧化作用与抗氧化基因有关,它包括血红素氧化酶-1、丝裂原活化蛋白激酶、编码还原型辅酶/醌氧化还原酶等[27-28]。另外,Arora等[29]研究表明酒精滥用会引起内毒素血症,转录因子核因子-κB(nuclear factor-κB,NF-κB)激活,释放一些炎症介质(肿瘤坏死因子-α、白细胞介素-1β、白细胞介素-6),导致氧化应激,最终导致肝损伤。已有研究表明壳寡糖能有效地抑制炎症激活因子NF-κB基因启动子活性,也表明了壳寡糖对预防疾病相关的炎症反应方面具有一定功效[30-31]。因此,可在后续研究中增加炎性反应因子及相关通路的检测,继续开展壳寡糖致酒精性肝损伤机制的相关研究工作。
