长白山核桃源五肽对过氧化氢诱导PC12细胞氧化损伤的保护作用及机理
2019-07-20秦汉雄闵伟红
郭 勇,秦汉雄,魏 贞,方 丽,闵伟红*
(吉林农业大学食品科学与工程学院,小麦和玉米深加工国家工程实验室,吉林 长春 130118 )
长白山核桃(Juglans mandshuricaMaxim)属于落叶阔叶乔木树种,核桃仁中含有18 种氨基酸,其中8 种必需氨基酸含量丰富,其效价与动物蛋白接近,是一种天然的优质蛋白[1-2]。食源性生物活性肽是蛋白质经蛋白酶水解后所得的一系列不同分子质量肽段,这些肽段所表现出来的生理活性存在差异[3],其生理活性包括预防癌症[4]、调节免疫[5]、降血压[6]、减肥[7]、降胆固醇[8]和提高记忆力[9]等。
氧化应激是由于体内氧化系统与抗氧化系统作用失衡,使体内产生过多高活性分子,如活性氧(reactive oxygen species,ROS)等,从而造成组织损伤[10]。研究认为,氧化应激广泛参与衰老[11]、炎症[12]、糖尿病[13]、神经退行性疾病[14]和心脑血管[15]等多种病理生理过程。氧化应激产生的自由基是几种疾病实验模型的共同特征之一,氧化应激产生的自由基影响神经细胞的结构和功能,进而导致广泛的神经退行性疾病,包括帕金森病和阿尔茨海默病等[16]。PC12细胞是从大鼠肾上腺嗜铬细胞瘤克隆的细胞株,具备神经细胞的特性,其可被神经生长因子(nerve growth factor,NGF)诱导分化成神经元形态,广泛用于神经退行性疾病的研究[17]。
本实验室前期的工作中,通过对核桃粕分离蛋白进行碱性蛋白酶定向水解、超滤、Sephadex G-25、Sephadex G-15和反相高效液相色谱分离纯化后,经电喷雾串联质谱仪鉴定出分子质量为610.416 6 Da的核桃源五肽Leu-Pro-Leu-Leu-Arg(LPLLR),本实验在此基础上,对核桃源五肽进行过氧化氢诱导PC12细胞的保护作用及机理研究,为核桃抗氧化肽保护神经细胞的开发和利用提供理论依据。
1 材料与方法
1.1 材料与试剂
LPLLR(分子质量610.416 6 Da,纯度99.75%)北京中科亚光生物科技有限公司。
噻唑蓝(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl tetrazolium bromide,MTT)、二甲基亚砜(dimethyl sulfoxide,DMSO) 美国Sigma公司;胎牛血清(fetal bovine serum,FBS) 美国Gibco公司;NO、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、过氧化氢酶(catalase,CAT)、ROS和丙二醛(malondialdehyde,MDA)试剂盒 南京建成生物工程研究所;乙酰胆碱(acetylcholine,ACh) 美国Research and Development公司;SOD2、诱导型一氧化氮合酶(iducible nitricoxide synthase,iNOS)、核转录因子κB(nuclear transcription factor-κB,NF-κB)、肌动蛋白(β-actin) 美国Cell Signaling Technoloy公司;牛(脱脂)乳粉 科迈生物化学有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
RSA224S型分析天平 北京赛多利斯科学仪器有限公司;CB150型CO2培养箱 德国Binder公司;AE31倒置显微镜 麦克奥迪实业集团有限公司;SPECTRA-MAX190型酶标仪 美国Molecular Devices公司;Z36HK高速冷冻离心机 德国Hermle公司;UV-1700紫外-可见分光光度计 日本岛津公司;IX53荧光倒置显微镜日本Olympus公司;ImageQuant LAS500凝胶成像系统上海通用电气医疗集团;1703940型半干式电转仪美国Bio-Rad公司。
1.3 方法
1.3.1 LPLLR对过氧化氢诱导PC12细胞氧化应激的影响
1.3.1.1 PC12细胞培养及传代
将PC12细胞培养瓶置于37 ℃、5% CO2培养箱中,待其生长稳定后,进行继续培养(细胞培养液含90 mL 1640培养液、10 mL胎牛血清、2 mL双抗),细胞传代,细胞冻存(细胞冻存液中1640培养液、胎牛血清、DMSO体积比为7∶2∶1)处理。选择生长状态良好4~9 代细胞进行实验。
1.3.1.2 MTT法检测LPLLR对PC12细胞的毒性
细胞的分组处理:PC12细胞调整浓度为4×105个/mL,每孔100 µL接种于96 孔培养板,于37 ℃、5% CO2培养箱中培养24 h,设空白组(未经任何处理)和样品组(LPLLR终浓度为25、50、100、200 μmol/L),于37 ℃、5% CO2培养箱中培养24 h,加入MTT溶液(终质量浓度为5 mg/mL),继续培养4 h后,弃去培养液,加入150 µL DMSO,振荡10 min至甲瓒结晶完全溶解,酶标仪测OD490nm,其中空白组记为OD0,样品组记为OD1。样品组细胞存活率按下式计算。

1.3.1.3 PC12细胞过氧化氢诱导氧化应激损伤模型的建立
细胞培养同1.3.1.2节,设空白组(未经任何处理)和模型组(过氧化氢终浓度为100、200、300、400、500 μmol/L)于37 ℃、5% CO2培养箱中分别培养1、2、3、4、5 h后,加入MTT溶液(终质量浓度为5 mg/mL),继续培养4 h后,弃去培养液,加入150 µL DMSO,振荡10 min至甲瓒结晶完全溶解,用酶标仪测OD490nm,其中空白组记为OD0,模型组记为OD1。模型组细胞存活率按1.3.1.2节公式计算。
1.3.1.4 LPLLR对过氧化氢诱导PC12细胞氧化应激的保护作用
细胞培养同1.3.1.2节,设空白组(未经任何处理)、模型组(仅过氧化氢处理)、样品组(过氧化氢+LPLLR,其中低、中、高浓度组LPLLR浓度分别为25、50、100 μmol/L)。在37 ℃、5% CO2培养箱中培养24 h后,加入各样品100 µL孵育18 h后,加入终浓度300 μmol/L的过氧化氢继续孵育2 h,加入MTT溶液(终质量浓度为5 mg/mL)继续培养4 h,弃去培养液,加入150 µL DMSO,振荡10 min至甲瓒结晶完全溶解,用酶标仪测OD490nm,其中空白组记为OD0,实验组(模型组及样品组)记为OD1。实验组细胞存活率按1.3.1.2节公式计算。
1.3.1.5 LPLLR对氧化损伤PC12细胞内ROS水平的影响
细胞培养及分组同1.3.1.2节,在37 ℃、5% CO2培养箱中培养24 h后,分别加入终浓度为25、50、100 μmol/L的样品100 µL孵育18 h后,加入终浓度为300 μmol/L的过氧化氢继续孵育2 h,弃去孔内液体,按照试剂盒说明进行操作,以相对荧光强度表示细胞内ROS水平。
1.3.1.6 LPLLR对氧化损PC12细胞内SOD、CAT、GSH-Px活力及MDA、NO、ACh含量的影响
细胞的分组处理:PC12细胞调整密度为4×105个/mL,每孔800 µL接种于6 孔培养板,于37 ℃、5% CO2培养箱中培养24 h,分别加入终浓度为25、50、100 μmol/L的样品100 µL孵育18 h后,加入终浓度为300 μmol/L的过氧化氢继续孵育2 h,弃去过氧化氢刺激的细胞培养液后,用灭菌的磷酸盐缓冲液清洗2 次,加入100 µL细胞裂解液,待细胞完全裂解完毕后吸入1.5 mL的EP管中,4 ℃、2 000 r/min离心10 min,吸上清液待测。按试剂盒说明书测定SOD、CAT、GSH-Px活力及MDA、NO、ACh含量。
1.3.2 Western blotting法检测定PC12细胞中SOD2、NF-κB和iNOS蛋白表达水平
细胞处理方法同1.3.1.6节,用BCA蛋白质量浓度测定试剂盒测定蛋白质量浓度。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离目的蛋白,采用半湿法使目的蛋白电转至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)膜上,用质量分数5%脱脂奶粉封闭1 h;TBST洗膜3 次,每次10 min。将PVDF膜放入含质量分数3%脱脂奶粉的SOD2、NF-κB和iNOS的抗体稀释液中(体积比1∶1 000稀释),4 ℃过夜孵育;TBST洗膜3 次,每次10 min。二抗室温孵育1 h;TBST洗膜3 次,每次10 min。用增强化学发光试剂显色后于凝胶成像仪中曝光拍照。
1.4 数据统计分析
2 结果与分析
2.1 LPLLR的质谱分析结果
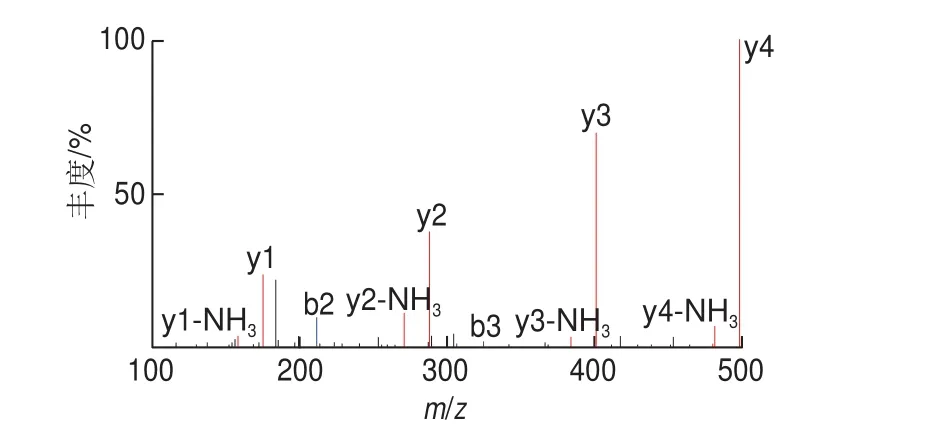
图1 LPLLR的质谱图Fig. 1 Mass spectrum of LPLLR
图1 为经电喷雾串联质谱仪鉴定出LPLLR的质谱图,其分子质量为610.416 6 Da,并由北京中科亚光生物科技有限公司进行化学合成(纯度99.75%)。
2.2 MTT细胞毒性实验结果
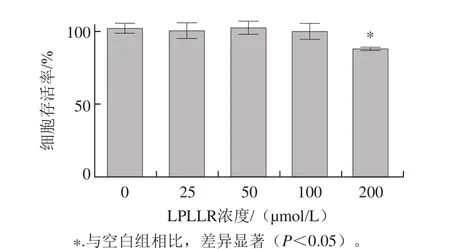
图2 不同浓度的LPLLR对PC12细胞存活率的影响Fig. 2 Effects of different concentrations of LPLLR on survival rates of PC12 cells
MTT法是一种广泛应用于检测细胞增殖、生存能力和药物毒性的方法,其检测原理为活细胞中的氧化还原酶使MTT还原为不溶性物质甲瓒沉淀于细胞内,生成的甲瓒结晶溶于DMSO,在490 nm波长处有最大吸收峰[18]。由图2可知,与空白组相比,LPLLR的浓度为25、50、100 μmol/L时,PC12细胞活力没有显著差异,说明在此浓度下对细胞无毒性作用,对PC12细胞生长繁殖无影响。但在LPLLR的浓度为200 μmol/L时,对PC12细胞活力有显著的抑制作用(P<0.05)。因此,选取样品浓度为25、50、100 μmol/L进行后续实验。
2.3 PC12细胞氧化损伤模型建立
如图3所示,当过氧化氢浓度小于200 μmol/L时,对PC12细胞损伤不明显,细胞存活率在70%以上;当浓度大于300 μmol/L时,过氧化氢对PC12细胞损伤明显,随着浓度增加和刺激时间延长,细胞存活率降低,当刺激时间达到5 h后,细胞存活率降到10%以下。本实验主要研究LPLLR肽段在自然衰老模型中对神经细胞的保护作用,因此选取300 μmol/L过氧化氢刺激2 h建立损伤模型。
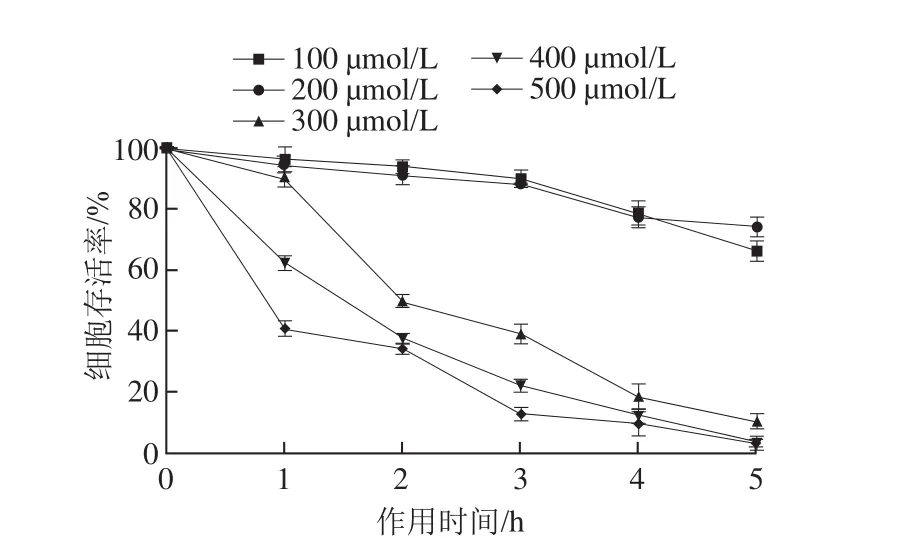
图3 不同过氧化氢浓度和作用时间对PC12细胞存活率的影响Fig. 3 Effects of different hydrogen peroxide concentrations and treatment time on survival rates of PC12 cells
2.4 LPLLR对过氧化氢诱导PC12细胞氧化应激的保护作用
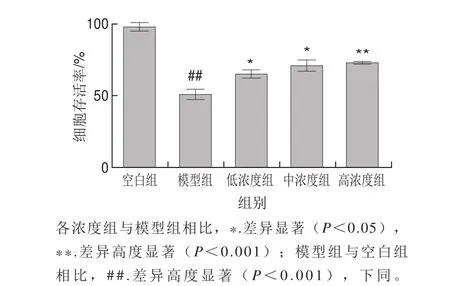
图4 LPLLR对过氧化氢诱导PC12细胞氧化应激损伤模型的保护作用Fig. 4 Protective effect of LPLLR on PC12 cells against H2O2-induced oxidative injury
MTT法检测LPLLR对过氧化氢诱导PC12细胞氧化应激模型的保护作用,如图4所示,与空白组相比,模型组的细胞存活率高度显著降低(P<0.001),说明模型构建成功。经LPLLR刺激后,各组细胞存活率随着LPLLR浓度的增加而逐渐升高,呈浓度依赖关系,说明LPLLR对氧化应激损伤的PC12细胞具有有效的保护作用。
2.5 LPLLR对PC12细胞内ROS水平的影响

图5 LPLLR对PC12细胞内ROS水平的影响Fig. 5 Effect of LPLLR on ROS level in PC12 cells
如图5所示,与空白组相比,模型组中ROS的相对荧光强度高度显著升高(P<0.001),说明模型构建成功。与模型组相比,添加LPLLR的实验组中ROS的相对荧光强度均显著降低(P<0.001,P<0.05),说明LPLLR能降低氧化损伤PC12细胞内的ROS水平。
2.6 LPLLR对PC12细胞内MDA含量的影响

图6 LPLLR对PC12细胞内MDA含量的影响Fig. 6 Effect of LPLLR on MDA content in PC12 cells
LPLLR保护PC12细胞氧化应激损伤模型中MDA含量的变化,如图6所示。与空白组相比,模型组中MDA的含量高度显著大于空白组(P<0.001),说明模型构建成功。与模型组相比,添加LPLLR的实验组中除低浓度组外,中浓度和高浓度组的MDA含量均显著降低(P<0.05)。
2.7 LPLLR对PC12细胞内SOD、CAT和GSH-Px活力的影响
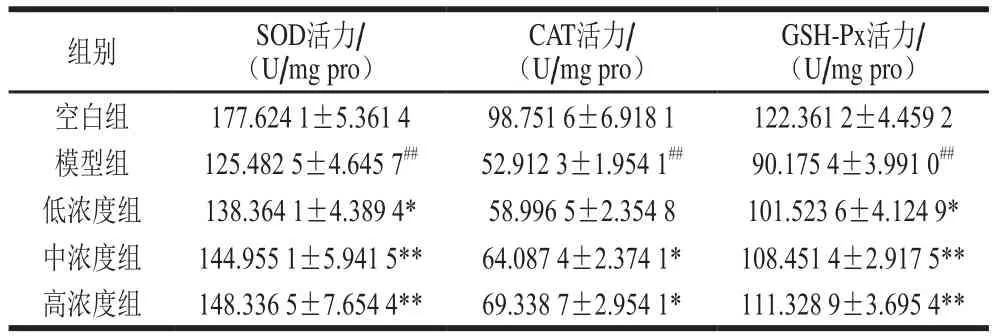
表1 LPLLR对PC12细胞内SOD、CAT和GSH-Px活力的影响Table 1 Effect of LPLLR on SOD, CAT and GSH-Px activity in PC12 Cells
由表1可知,与空白组相比,模型组SOD、CAT和GSH-Px的活力均高度显著下降(P<0.001);与模型组相比,添加LPLLR的实验组SOD、CAT和GSH-Px活力均显著提高(P<0.001,P<0.05)。由此表明,LPLLR能够增加PC12中SOD、CAT和GSH-Px的活力。
2.8 LPLLR对PC12细胞内ACh含量的影响
如图7所示,与空白组相比,模型组中ACh含量高度显著降低(P<0.001),说明模型构建成功。与模型组相比,PC12细胞中ACh含量都随LPLLR浓度的增加而增加,呈浓度依赖性,其中,中浓度和高浓度组与模型组存在显著差异(P<0.05)。

图7 LPLLR对PC12细胞中ACh含量的影响Fig. 7 Effect of LPLLR on ACh content in PC12 cells
2.9 LPLLR对PC12细胞内NO浓度的影响

图8 LPLLR对PC12细胞中NO浓度的影响Fig. 8 Effect of LPLLR on the production of NO in PC12 cells
如图8所示,与空白组相比,模型组的NO浓度高度显著上升(P<0.001);与模型组相比,LPLLR实验组的NO浓度均高度显著下降(P<0.001)。
2.10 LPLLR对PC12细胞中SOD2、NF-κB p65和iNOS蛋白表达的影响
如图9所示,与空白组相比,模型组中SOD2蛋白相对表达量显著降低(P<0.05)。与模型组相比,LPLLR低、中、高浓度组中SOD2蛋白相对表达量均显著升高(P<0.001,P<0.05)。与空白组相比,模型组中iNOS和细胞质NF-κB p65蛋白相对表达量均高度显著升高(P<0.001)。与模型组相比,LPLLR各浓度组中iNOS和细胞质NF-κB p65蛋白相对表达量均显著下降(P<0.001,P<0.05)。
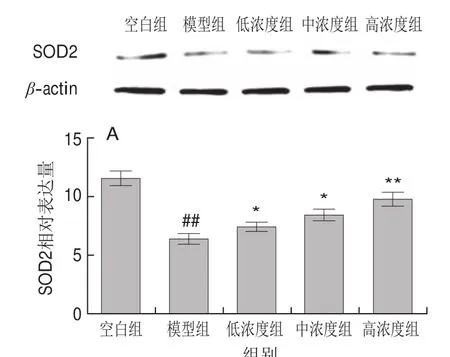

图9 LPLLR对PC12细胞中SOD2(A)、NF-κB p65(B)和iNOS(C)蛋白表达的影响Fig. 9 Effect of LPLLR on protein expression of SOD2 (A),NF-κB p65 (B) and iNOS (C) in PC12 cells
3 讨 论
氧化应激是导致机体衰老的关键因素,会对中枢神经系统造成直接伤害,主要是由于中枢神经细胞耗氧量大但抗氧化水平相对较低,神经元处于氧化应激高风险中[19-20]。通常情况下,ROS与机体内抗氧化系统协调维持稳态,所以少量的ROS不会对机体造成损伤。但当ROS大量积累时,抗氧化系统不能抵御ROS,机体内发生氧化应激,使脂质过氧化进而损伤神经细胞。本研究中,LPLLR能明显提高氧化损伤PC12细胞的存活率,降低细胞中ROS水平,呈浓度依赖关系。有文献报道其他食源性生物活性多肽对氧化损伤的PC12细胞具有保护作用,如美国肉参胶原蛋白肽I1在100 μg/mL时可使氧化损伤PC12细胞的存活率提高68.8%[21];脱脂麦胚蛋白肽在1 mg/mL时可使氧化损伤PC12细胞的存活率提高33%[22];花生蛋白肽[23]和金华火腿肽[24]对氧化损伤的PC12细胞具有良好的保护作用。与这些食源性生物活性肽相比,LPLLR的保护作用更加明显,其原因可能是LPLLR肽段中疏水性氨基酸所占比例为80%,并且末端含有碱性氨基酸R,所以同浓度下,LPLLR的效果更好。研究表明,序列中含有疏水性氨基酸的肽段抗氧化活性较高,而碱性氨基酸R可作为电子受体,夺取氧化所形成自由基的电子从而阻断氧化反应[25-26]。
机体内抗氧化系统主要包括酶抗氧化系统和非酶抗氧化系统,酶抗氧化系统主要包括SOD、CAT和GSH-Px;非酶抗氧化系统主要包括类胡萝卜素、Zn和Se等。酶抗氧化系统往往与非酶抗氧化系统联合发挥抗氧化作用,例如SOD常与非酶抗氧化因子Cu、Zn和Mn结合形成酶复合物Cu-SOD、Zn-SOD和Mn-SOD[27-29]。在机体中SOD存在3 种形式:SOD1存在于细胞质中,SOD2存在于线粒体中,SOD3存在于细胞外。本研究,LPLLR能显著提高PC12细胞内SOD、CAT和GSH-Px活力。ROS主要由线粒体产生,因此本实验采用Western blotting法分析SOD2在PC12细胞中蛋白表达情况,结果表明LPLLR能提高PC12细胞内SOD2含量。实验结果与Jia Ji等[30]的研究结果相一致,能提高细胞内SOD、CAT和GSH-Px活力,以及提高细胞内SOD2蛋白表达含量。
研究表明,ROS可以增强IκB激酶复合物NEMO的Cys54和Cys347二聚化,从而激活NF-κB[31]。NF-κB是以p50/p65异二聚体的形式存在于细胞浆中,其激活可以诱导许多因子如iNOS、环氧合酶2和Mn-SOD等转录。iNOS被激活后催化L-精氨酸末端胍基中的一个氮原子氧化而合成大量NO,NO可以与超氧阴离子反应生成超氧亚硝酸阴离子,并进一步分解为羟自由基和NO2等自由基,使神经细胞产生神经毒性,最终导致细胞凋亡。此外,高浓度NO通过抑制多种与线粒体电荷传递和柠檬酸循环有关的酶,来抑制线粒体呼吸作用,使神经细胞受到损伤。本研究采用Western blotting法分析PC12细胞中NF-κB p65和iNOS蛋白表达情况,以及用酶联免疫吸附检测法测定细胞中NO含量。结果表明,模型组中过氧化氢能上调NF-κB p65和iNOS蛋白表达,增加NO分泌量;实验组中LPLLR能下调NF-κB p65和iNOS蛋白表达,降低NO分泌量。说明LPLLR可能通过抑制NF-κB/iNOS/NO信号通路对过氧化氢诱导PC12细胞进行保护作用。
综上所述,LPLLR对氧化应激损伤的PC12细胞具有一定的保护作用,主要是通过提高酶抗氧化系统中抗氧化酶的活力和抑制NF-κB/iNOS/NO信号通路发挥作用。
