魔芋低聚糖缓解高糖水平诱发的大鼠代谢综合征及相关机制
2019-07-20李浩霞吴丹丹周中凯
焦 丹,李浩霞,吴丹丹,周中凯*
(天津科技大学食品工程与生物技术学院,天津 300457 )
糖尿病是由胰岛素(insulin,INS)分泌不足或INS抵抗导致的以高血糖为特征的一种慢性代谢疾病[1],其发病率极高,可引起机体糖脂代谢紊乱,进而导致神经病变、视网膜病变、肾功能衰竭、心血管病变等各种并发症,极大地增加了糖尿病的死亡率[2]。目前糖尿病治疗主要以西药为主,但其存在着严重的副作用,因此,寻找天然有机功能因子替代当前药物治疗具有一定的现实意义。
魔芋是一种多年生天南星科草本植物,其块茎含有丰富的葡甘露聚糖[3],是其主要的活性成分,已被广泛应用于食品、医药、生物等领域[4-6]。魔芋低聚糖(konjac oligosaccharide,KOS)由魔芋葡甘露聚糖降解而成,具有降血糖、降血脂、清除自由基、提高机体抗氧化能力、抗肿瘤及免疫调节等生理功能[7-9]。杨艳燕等[9]的研究表明,KOS能降低小鼠的血糖水平、提高机体的抗氧化能力;刘瑞雪等[10]的研究表明KOS可明显改善结肠炎大鼠的临床症状;周中凯等[11]的研究表明KOS可改善肥胖小鼠脂代谢紊乱症状。
在分子水平上对糖尿病大鼠糖脂代谢基因表达已取得一些研究进展:张汝学等[12]研究了地黄寡糖对糖尿病大鼠肝脏糖代谢关键酶活性及基因表达的影响;王晓凤[13]通过基因表达研究了荞麦壳中活性物质对体内外糖脂代谢的影响。虽然国内外目前已有许多关于KOS可调节血糖、血脂、改善糖尿病症状的报道,但在分子水平上通过调控糖脂代谢及氧化应激相关基因表达进而缓解糖尿病症状的报道尚少。因此,本研究采用尾部静脉注射链脲佐菌素(streptozotocin,STZ)的方法诱导SD大鼠,建立糖尿病模型,通过对其体质量、血糖浓度、血清脂质组成以及氧化应激相关指标的测定,分析KOS对糖尿病大鼠糖脂代谢及氧化应激水平的调节作用,并进一步通过实时荧光定量聚合酶链式反应(real-time quantitative polymerase chain reaction,qPCR)技术在分子水平上进行作用机制的研究,以期为KOS改善糖尿病糖脂代谢紊乱症状提供更深入的理论指导。
1 材料与方法
1.1 材料与试剂
KOS由天津科技大学粮油科学与工程实验室提供。雄性SPF级SD大鼠,体质量(180±20)g,由中国人民解放军军事医学院实验动物中心提供,生产许可证号:SCXK-(军)2014-0001。
基础饲料 中国人民解放军军事医学院实验动物中心;STZ 上海阿拉丁生化科技股份有限公司;动物组织总RNA提取试剂盒 天根生化科技(北京)有限公司;总胆固醇(total cholesterol,T-CHO)试剂盒、甘油三酯(triacylglycerol,TG)试剂盒、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)试剂盒、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)试剂盒、总超氧化物歧化酶(total superoxide dismutase,T-SOD)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、总抗氧化能力(total antioxidant capacity,T-AOC)试剂盒、大鼠INS水平试剂盒 南京建成生物科技有限公司;PrimeScript RT Reagent Kit 大连宝生物工程有限公司;其余试剂均为国产分析纯。
1.2 仪器与设备
MK-3酶标仪 美国Thermo Fisher Scientific公司;Step one plus qPCR仪 美国ABI公司;智能培养箱宁波赛福实验仪器有限公司;XMTD-204数显式电热恒温水浴锅 天津市欧诺仪器表有限公司;SW-CJ-1FD型单人单面净化工作台 苏州净化设备有限公司。
1.3 方法
1.3.1 动物实验
将40 只SD雄性大鼠随机分成4 组:正常组(NC)、糖尿病模型组(DC)、KOS低剂量组(L-KOS)、KOS高剂量组(H-KOS)。适应性喂养1 周后,禁食不禁水12 h,称体质量。参照文献[14-15]中糖尿病建模方法:尾静脉注射质量分数2% STZ(现用现配,冰浴;溶剂为0.1 mol/L pH 4.5柠檬酸-柠檬酸钠缓冲液),注射剂量为45 mg/kg,正常组注射等剂量的缓冲液。72 h后尾静脉采血,用ONE-TOUCH血糖仪测随机血糖浓度,以血糖浓度超过16.7 mmol/L作为大鼠建模成功的标准。建模成功后每组9 只大鼠。L-KOS组每天灌胃36.14 mg/kg KOS,H-KOS组每天灌胃69.25 mg/kg KOS,正常组和糖尿病组给予同剂量的纯净水。各组大鼠均自由饮水、进食,喂养4 周。4 周后禁食不禁水12 h,处死大鼠,股动脉取血,4 ℃、3 000 r/min离心20 min,取上层血清。解剖大鼠,取出肝脏称质量,快速放入液氮中冷冻,将血清与脏脏置于-80 ℃贮存备用。
1.3.2 指标测定
1.3.2.1 大鼠体质量和空腹血糖浓度的测定
每日对大鼠进行临床活动度观察,记录各组大鼠每周的体质量和空腹血糖浓度。
1.3.2.2 大鼠血清指标的测定
取出备用血清,TG浓度、T-CHO浓度、LDL-C浓度、HDL-C浓度、T-AOC、T-SOD活力、GSH-Px活力、MDA浓度、INS水平测定均按照试剂盒的操作说明书进行,每个样品做3 次平行。
1.3.2.3 与糖代谢、脂代谢、氧化应激相关基因表达量的测定
取出肝脏样品,使用TRIzol试剂进行RNA提取。使用PrimeScript RTReagent Kit对cDNA进行逆转录并进行逆转录qPCR,以18S rDNA基因作内参,每个基因做3 次平行,并根据2-ΔΔCt法计算相对表达量[16]。基因与引物见表1。

表1 基因和引物信息Table 1 Information about the genes and primers used in this study
1.4 数据统计与分析
数据结果以平均值±标准差表示,采用SPSS 19软件对数据进行统计,显著性采用方差分析和邓肯氏(Duncan’s)差异显著性分析,P<0.05表示有显著性差异,P<0.01表示有极显著性差异。
2 结果与分析
2.1 KOS对大鼠体质量和空腹血糖浓度的影响
如图1所示,各组大鼠初始体质量无显著差异(P>0.05),说明大鼠实验分组合理。造模后,与NC组相比,KOS低、高剂量组大鼠体质量增长速度缓慢(P<0.05),而DC组大鼠体质量增长速度不明显,且后期有下降趋势。KOS干预2 周后,与DC组相比,KOS高、低剂量组大鼠体质量显著升高(P<0.05);干预4 周后,与DC组相比,大鼠体质量分别增加了32.05%、22.76%。这表明KOS具有减轻糖尿病大鼠体质量下降趋势的作用。

图1 KOS对大鼠体质量的影响Fig. 1 Effect of KOS on body mass of rats
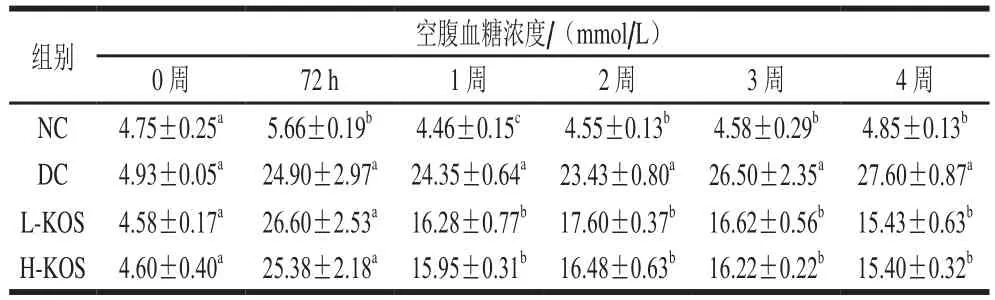
表2 KOS对大鼠空腹血糖浓度的影响Table 2 Effect of KOS on fasting blood glucose of rats
如表2所示,各组初始空腹血糖浓度无显著性差异,说明个体之间血糖浓度差异性不明显。注射STZ 72 h后,大鼠的血糖浓度平均值大于16.7 mmol/L,表明造模成功。KOS干预1 周后,与DC组相比,KOS低、高剂量组的空腹血糖水平分别极显著降低了33.14%、34.50%(P<0.01)。治疗4 周后,与造模72 h后血糖浓度相比,KOS低、高剂量组大鼠血糖水平分别降低了41.99%、39.32%。
2.2 KOS对大鼠INS水平的影响

图2 KOS对大鼠INS水平的影响Fig. 2 Effect of KOS on INS levels of rats
如图2所示,与NC组相比,DC组大鼠INS水平显著降低(P<0.05)。与DC组相比,KOS干预后2 组大鼠INS水平均显著升高(P<0.05),且能达到NC组正常水平(P>0.05)。这说明KOS可促进大鼠INS分泌,改善糖尿病症状。
2.3 KOS对大鼠血脂水平的影响

表3 KOS对大鼠血脂水平的影响Table 3 Effect of KOS on serum lipid levels in rats
如表3所示,与NC组相比,DC组大鼠的TG、T-CHO、LDL-C浓度均显著增加,HDL-C浓度显著降低(P<0.05)。这说明糖尿病易造成大鼠脂代谢紊乱。KOS干预后,与DC组相比,H-KOS组大鼠的TG、T-CHO、LDL-C浓度显著降低(P<0.05),HDL-C浓度显著升高(P<0.05)。这说明高剂量的KOS干预对糖尿病大鼠脂代谢紊乱的改善作用显著。
2.4 KOS对大鼠氧化应激水平的影响
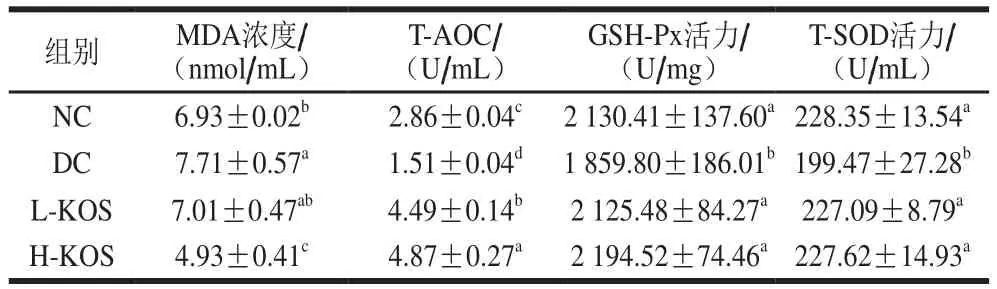
表4 KOS对大鼠氧化应激水平的影响Table 4 Effect of KOS on oxidative stress levels of rats
如表4所示,与NC组相比,DC组的T-AOC、GSH-Px活力、T-SOD活力显著降低(P<0.05),MDA浓度显著增加(P<0.05),这说明糖尿病可使脂质过氧化及氧自由基损伤程度加剧。KOS干预后,KOS低、高剂量组大鼠的抗氧化水平与DC组相比均得到改善,且能达到或高于NC组正常水平。MDA浓度作为脂质过氧化指标之一,可反映机体内脂质过氧化的程度,KOS干预后H-KOS组大鼠的MDA浓度与DC组相比显著降低。结果表明,KOS在一定程度上可抑制脂质的过氧化,减少细胞受氧自由基的损伤,提高糖尿病大鼠的抗氧化应激能力。
2.5 糖代谢、脂代谢、氧化应激相关基因表达量分析
2.5.1 KOS对大鼠糖代谢相关基因mRNA表达水平的影响
为进一步了解KOS调节血糖浓度的分子机制,利用逆转录qPCR技术研究了大鼠肝脏中与糖代谢相关基因的表达水平,结果如图3所示。KOS干预后,与DC组相比,KOS低、高剂量组糖原合成基因GS2、GYG1的表达量显著上升,糖异生基因G6PC1的表达量显著降低,INS诱导基因Insig1、Insig2的表达量显著上升,且均高于NC组,其中H-KOS组Insig2表达量上调至接近NC组的10 倍。这表明KOS干预后能促进糖原的合成,抑制糖异生过程,诱导INS的合成和分泌,进而降低血糖浓度。
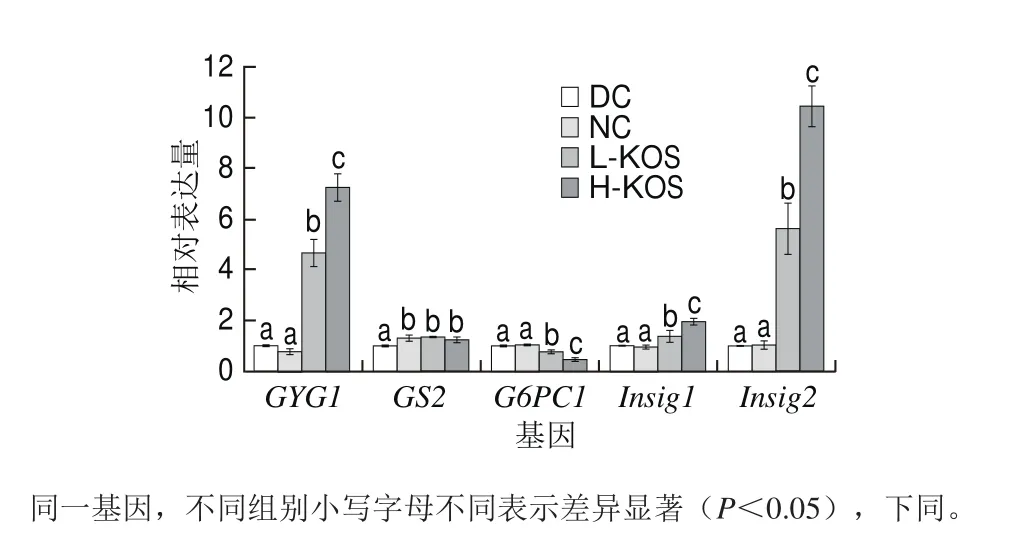
图3 KOS对大鼠糖代谢相关基因表达水平的影响Fig. 3 Effect of KOS on the expression of genes associated with glucose metabolism
2.5.2 KOS对大鼠脂代谢相关基因mRNA表达水平的影响
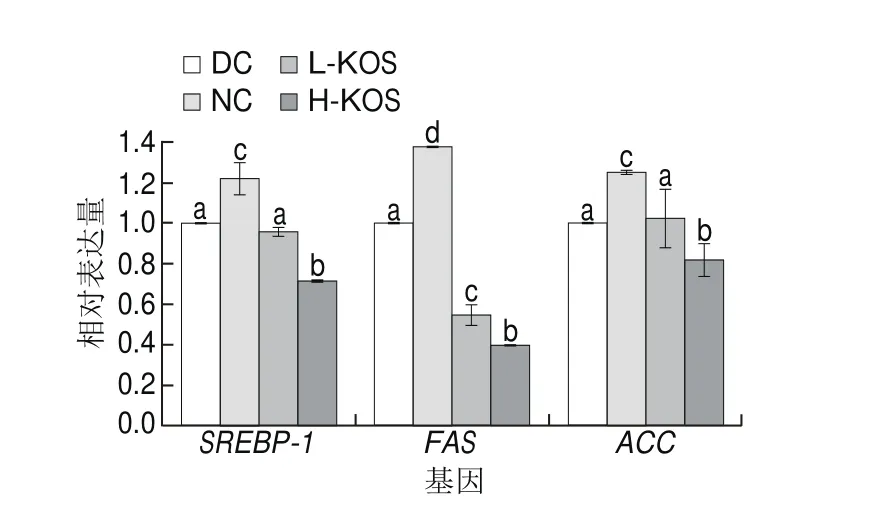
图4 KOS对大鼠脂代谢相关基因表达水平的影响Fig. 4 Effect of KOS on the expression of genes associated with lipid metabolism
表3数据显示,KOS干预可显著改善糖尿病大鼠的血脂组成,为了进一步研究KOS改善血脂的分子机制,利用逆转录qPCR技术研究了大鼠肝脏中与脂代谢相关基因的表达水平,结果如图4所示。ACC、FAS参与脂肪酸的合成[17],SREBP-1主要促进TG的合成。KOS干预后,与DC组相比,KOS低、高剂量组ACC、FAS、SREBP-1基因表达显著下调,其中H-KOS组中FAS的表达量下调60%以上,这说明KOS干预可抑制脂肪酸、胆固醇和TG的生物合成路径,改善糖尿病大鼠的血脂组成,缓解糖尿病症状。
2.5.3 KOS对大鼠氧化应激相关基因mRNA表达水平的影响
如图5所示,KOS干预后,与DC组相比,KOS低、高剂量组Hmox1、Egfr基因表达量显著上调,其中L-KOS组中Egfr基因表达量上调超过2 倍,H-KOS组上调4 倍;L-KOS组中Hmox1的表达量高于H-KOS组,且接近DC组的4 倍。IGFBP-1基因表达量显著降低。
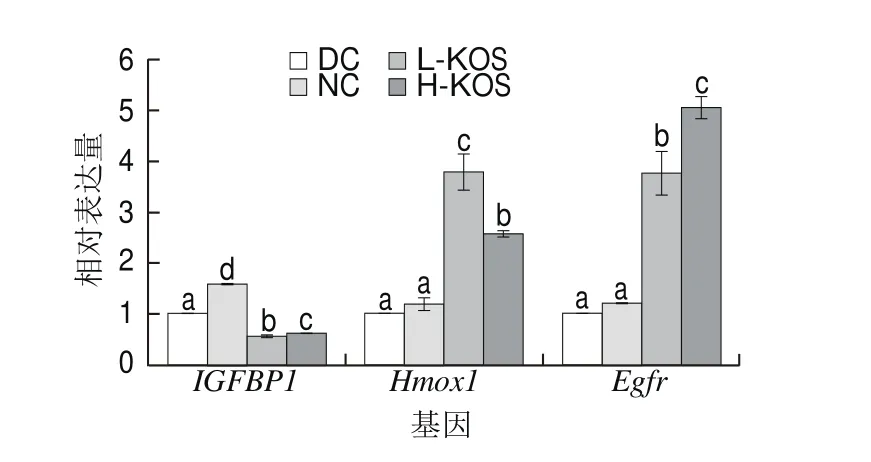
图5 KOS对大鼠氧化应激相关基因表达水平的影响Fig. 5 Effect of KOS on the expression of genes associated with oxidative stress
3 讨 论
本实验以SD雄性大鼠为研究对象,尾静脉注射STZ诱导糖尿病模型。探讨KOS对糖尿病大鼠糖脂代谢及氧化应激水平的影响。
结果表明,与NC组相比,糖尿病可使大鼠体质量减轻、空腹血糖浓度升高。与DC组相比,KOS干预治疗可有效增加糖尿病大鼠的体质量(H-KOS组体质量增加32.05%),显著降低其空腹血糖浓度,这说明KOS对糖尿病大鼠的治疗起到了积极的作用。糖尿病会导致大鼠血液中T-CHO、TG和LDL-C的含量增加,并使HDL-C含量显著降低,进而导致血脂代谢紊乱[18-19]。KOS干预后,与DC组相比,大鼠血清中T-CHO、TG和LDL-C浓度显著降低,HDL-C浓度显著升高。这说明KOS可调节糖尿病大鼠的脂质代谢紊乱,进而缓解糖尿病症状。此外,KOS可提高机体的INS水平,进而改善血糖浓度。
有研究表明,糖尿病糖脂代谢紊乱会打破过氧化和抗氧化之间的平衡,从而降低机体抗氧化能力[20]。而自由基的形成和机体的天然抗氧化能力不平衡被认为是诱发糖尿病的根源[21]。GSH-Px能特异地催化还原型谷胱甘肽对氢过氧化物的还原反应,从而保护细胞膜结构和功能的完整。MDA的含量可直接反映机体内脂质的过氧化程度。T-SOD是促氧化-抗氧化平衡中至关重要的酶。糖尿病会显著降低大鼠的T-AOC、T-SOD和GSH-Px活力,增加MDA含量,增强氧化应激对机体的损伤。KOS干预后,与DC组相比,KOS低、高剂量组大鼠的T-AOC、T-SOD和GSH-Px活力显著提高,MDA浓度降低,说明KOS能抑制糖尿病引起的机体氧化应激损伤。
为了进一步研究KOS调节糖尿病大鼠糖脂代谢和氧化应激的分子机制,通过逆转录qRCR分析了与糖脂代谢及氧化应激相关基因的表达水平。GS2是谷氨酰胺合成酶,谷氨酰胺含量的增加能促进糖原的合成[22],GYG1同样也可以促进糖原的合成。KOS干预后,相对于DC组,KOS低、高剂量组大鼠GS2的表达量上升,其中L-KOS组上调了0.35 倍,优于H-KOS组。这说明KOS可促进肝糖原的合成,降低血糖浓度。G6PC1是糖异生最终反应的关键调控酶[23],KOS干预后,相对于DC组,H-KOS组中G6PC1的表达量下调了0.53 倍,因此大鼠血糖浓度的下降也可能与糖异生的抑制有关。Insig1、Insig2是INS诱导基因,不但在糖代谢平衡中具有重要作用[24],同时也能调节胆固醇和脂类代谢[12]。KOS干预后,相对于DC组,2 种INS诱导基因的表达量均显著上调,其中H-KOS组中Insig1表达量上调1 倍,Insig2表达量上调9 倍。Insig1或Insig2的过度表达也可抑制肝脏中SREBP-1蛋白的活化,减少机体内的脂质沉积[25-26],这与低、高剂量KOS干预后大鼠SREBP-1表达量显著降低的结果一致。此外,ACC和FAS的表达也与SREBP-1有关,SREBP-1是内质网上与脂代谢相关的基因,主要促进TG的合成,激活后可促进FAS、ACC基因的过量表达,最终增加脂质沉积量[27-28]。KOS干预后,与DC组相比,KOS低、高剂量组中FAS、ACC的表达量显著下调,其中FAS的下调量超过60%。这说明KOS干预可抑制脂肪酸、胆固醇和TG的生物合成路径,从而改善糖尿病大鼠的血脂组成。Egfr的高表达量能显著改善糖尿病大鼠的病理症状,提高机体的抗氧化能力[29]。KOS干预后,相对于DC组,H-KOS组中Egfr表达量上调4 倍。IGFBP-1是能与胰岛素样生长因子结合的调节蛋白,能够竞争性抑制其与受体的结合,从而抑制其生理活性[30]。KOS干预后能显著降低KOS低、高剂量组大鼠IGFBP-1表达量。另外,KOS干预也可使Hmox1表达量显著上升。说明KOS可通过增加Egfr、Hmox1的表达量提高糖尿病大鼠机体的抗氧化能力。
综上所述,KOS可通过促进糖原合成和抑制糖异生来调节大鼠血糖浓度,并且通过抑制脂肪酸、胆固醇和TG的生物合成途径来调节脂质代谢,抑制糖尿病引起的氧化应激损伤,增强机体的抗氧化能力。
