植物乳杆菌通过调节肠道短链脂肪酸水平缓解代谢综合征
2019-07-20朱广素王园园马方励赵建新
朱广素,王 刚,*,王园园*,马方励,赵建新,张 灏,陈 卫
(1.江南大学食品学院,江苏 无锡 214122 ;2.无限极(中国)有限公司,广东 广州 510623 )
高能量的饮食可能导致营养摄入与消耗的失衡,从而引发代谢综合征,主要症状包括高血糖、高血脂、胰岛素抵抗及肥胖等一系列代谢紊乱[1-2]。能量摄入过度破坏了肠道菌群的组成及其多样性[3],导致肠道内Firmicutes/Bacteroidetes的比例下降[4]。益生菌主要包括双歧杆菌属和乳杆菌属,已被证实可调节肠道菌群、抑制有害菌的生长、增强肠道免疫力,因此,通过补充益生菌等微生态制剂缓解慢性炎症引发的代谢综合征成为一种新的途径[5-7]。
建立稳定的代谢综合征(metabolic syndrome,MS)动物模型是开展MS发病机制及临床治疗研究的重要基础。目前,文献报道的MS造模方法主要分为遗传型、饮食诱发型和药物诱导型[8]。考虑到遗传型和药物诱导型MS模型的发病进程,与人类MS的自然病程差异较大,且其发病特征及机制有所不同,而长期高热量饮食导致的能量失衡是MS的主要诱因,因此高糖高脂(high-fat and high-sucrose,HFHS)饮食诱发型MS模型更能客观体现自然状态下环境因素对MS的影响,且使用最为广泛[9-11]。对于饮食导致的MS动物模型,大多数研究通过在实验周期内的不同时间节点,检测血清中与代谢相关指标(如血糖含量、胰岛素含量、葡萄糖耐量、血脂四项等参数)来判定造模是否成功[12-13]。
肠道微生物种群发酵不易消化多糖形成的产物为短链脂肪酸(short-chain fatty acids,SCFAs)[14],主要包括乙酸、丙酸和丁酸(物质的量之比约3∶1∶1),占所有SCFAs总量的95%以上[15]。近年来,研究表明SCFAs可以促进肠道蠕动、增加营养物质的吸收,改善胰岛素抵抗引发的肥胖[16]。SCFAs受体GPR43能够抑制脂肪组织的脂肪积累,促进肝脏等其他组织的脂质代谢,维持血糖平衡[17];此外,它还能调节机体下丘脑中枢减少食欲[18],增强胰岛β细胞的功能[19],改善胰岛素敏感性。小肠L细胞积累的SCFAs,可以促进胰高血糖素样肽-1(glucagonlike peptide-1,GLP-1)的分泌,增加饱腹感以维持机体血糖-胰岛素的稳态[20]。
本研究团队前期采用MiSeq高通量测序技术,分析了植物乳杆菌干预对MS大鼠肠道菌多样性和物种组成的影响,发现产SCFAs的细菌种属在高脂饮食大鼠体内发生显著变化。基于上述研究结果,本研究用高糖高脂饮食的大鼠模型,对大鼠血清中血糖血脂等代谢指标和肝脏抗氧化能力进行检测,对肝脏、十二指肠及胰岛进行组织病理学分析,同时测定大鼠粪便中的SCFAs含量,探讨植物乳杆菌对MS的缓解机制。
1 材料与方法
1.1 动物、材料与试剂
实验动物为SD雄性大鼠,购于上海斯莱克公司,使用许可证号:SYXK(苏)2016-0011。适应一周后,随机分为8 组。饲养条件为:4 只一笼,同室饲养,自由饮食饮水,温度为(22±2)℃,相对湿度为(55±5)%,12 h光暗交替。实验用基础饲料和高糖高脂饲料的配方表见表1。

表1 动物饲料配方Table 1 Compositions of experimental diets
实验用菌株均来自于江南大学食品生物技术中心菌种保藏中心,鼠李糖乳杆菌(Lactobacillus rhamnosusGG,LGG)为对照菌株。菌株具体信息及来源见表2。

表2 菌株信息表Table 2 Information about the strains tested in this study
MRS培养基 青岛海博生物技术有限公司;葡萄糖广西梧州制药股份有限公司;罗格列酮片 成都恒瑞制药有限公司;高糖高脂饲料 北京华阜康生物科技有限公司;葡萄糖(glucose,Glu)、总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)检测试剂盒 南京威特曼生物科技公司;超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、丙二醛(malondialdehyde,MDA)检测试剂盒 南京建成生物技术公司;胰岛素检测试剂盒 上海依科赛生物制品有限公司;其他常用试剂均购于国药集团化学试剂有限公司。
1.2 仪器与设备
高速冷冻离心机 德国Eppendorf公司;大容量冷冻离心机、Multiscan Go多功能酶标仪 美国Thermo公司;高温高压灭菌锅 日本SANYO公司;恒温恒湿培养箱 上海森信实验仪器有限公司;高通量组织研磨仪 宁波新芝生物科技股份有限公司;Pannoramic MIDI组织切片扫描仪 匈牙利3DHISTECH公司;气相色谱-质谱联用(gas chromatograph-mass spectrometry,GC-MS)仪 日本岛津公司。
1.3 方法
1.3.1 菌悬液的制备
将菌株接种于的MRS培养基中,37 ℃活化两代后用于制备动物实验所需菌悬液。将培养好的菌液以8 000×g离心20 min,无菌磷酸盐缓冲液清洗菌体2 遍,调整活菌数为5×1010CFU/mL,用质量分数30%的蔗糖溶液重悬后,于-80 ℃保藏备用。灌胃前用无菌水稀释10 倍。
1.3.2 动物分组及处理条件
动物实验方案见表3,每组8 只SD大鼠,处理12 周。辛伐他汀和罗格列酮分别作为降血脂和降血糖的阳性对照。
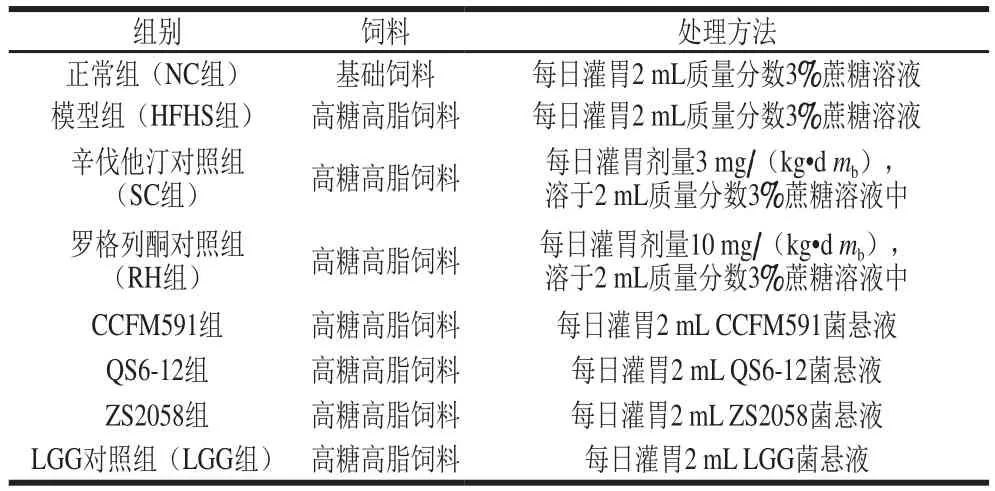
表3 动物实验方案Table 3 Grouping of experimental animals
1.3.3 样品收集
实验结束前,收集大鼠粪便样品,用于测定SCFAs;腹腔注射200 mg/kgmb的戊巴比妥钠溶液麻醉后,取血,解剖摘取脏器。血液在4 ℃、3 000×g条件下离心10 min,少量多次吸取上清液,置于-80 ℃冻存备用。收集肝脏、小肠、胰腺组织,生理盐水漂洗后,置于甲醛溶液中固定,用于组织病理分析。
1.3.4 血液生化指标的检测
按照试剂盒说明书的方法检测血清中Glu、TC、TG、HDL-C、LDL-C的含量。
1.3.5 肝脏抗氧化指标的检测
按照试剂盒说明书的方法检测肝脏中SOD、CAT活力及MDA含量。
1.3.6 腹腔注射葡萄糖耐量测定
在第12周实验结束前,禁水禁食5 h,腹腔注射2 g/kg的葡萄糖溶液,在0、30、60、120 min时检测血糖浓度。葡萄糖耐量的大小由糖耐量曲线下面积(area under curve,AUC)表示。
1.3.7 病理组织学分析
肝脏、胰腺和十二指肠的病理组织学分析参考李向菲[21]的方法:组织样品经固定、洗涤后,用梯度浓度的乙醇溶液脱水,石蜡包埋后切成5 μm厚度的片段,苏木精-伊红染色后用切片扫描仪进行观察,拍照记录。
病理学具体评分标准如下。1)肝脂病变评分方法:根据脂变细胞在肝小叶内的范围,依次定量为0~4 分。0 分(基本正常);0.5 分(轻微、极少量)脂肪变性的肝细胞细胞数占肝小叶内细胞数小于12%;1 分(轻度、少量),脂变的肝细胞数约占12%~25%;2 分(中度、中等量),脂变的肝细胞数约占25%~50%;3 分(重度、多量),脂变的肝细胞数约占50%~75%;4 分(极重度、大量),脂变的肝细胞数大于75%。2)其他评分方法:其他病变根据由轻到重的程度,依次定量为0~4 分:轻微或极少量为0.5 分,轻度或少量为1 分,中度或较多为2 分,重度或多量为3 分,极重度或大量为4 分,正常为0 分。
1.3.8 粪便中SCFAs的测定
参照Samuel等[22]的研究方法,用GC-MS的方法检测大鼠粪便中主要SCFAs(乙酸、丙酸、丁酸)的含量,GC-MS的具体条件参照Wang Gang等[23]的研究。方法如下:取50 mg粪便样品,加入500 μL饱和NaCl溶液充分混匀;加入20 μL质量分数10%硫酸溶液进行酸化后,加入800 μL乙醚振荡,4 ℃、18 000×g离心15 min,取上清液,加0.25 g无水硫酸钠,充分振荡后再次离心(4 ℃、18 000×g,15 min),吸取上清液加入气相瓶中,进行GC-MS分析。
1.4 数据统计分析
2 结果与分析
2.1 植物乳杆菌对大鼠血糖-胰岛素稳态的影响
与NC组相比,HFHS组大鼠表现出一系列一定水平的代谢紊乱,包括空腹血糖和空腹胰岛素水平均显著增加,对葡萄糖的清除能力下降,导致大鼠血糖-胰岛素稳态失衡。
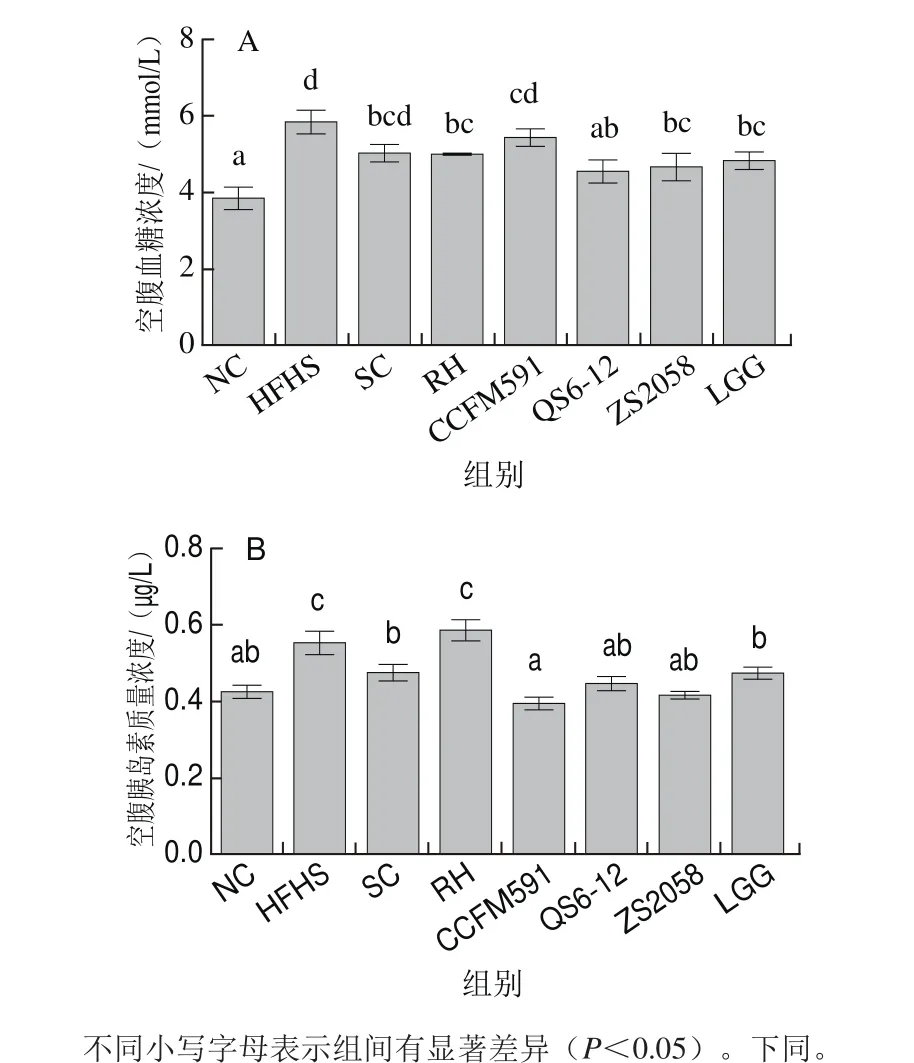
图1 植物乳杆菌对大鼠空腹血糖浓度(A)和空腹胰岛素质量浓度(B)的影响Fig. 1 Effect of L. plantarum on fasting blood glucose (A) and fasting insulin (B) levels

图2 植物乳杆菌对MS大鼠葡萄糖耐量(A)和AUCglucose(B)的影响Fig. 2 Effect of L. plantarum on glucose tolerance (A) and AUCglucose (B)in MS rats
如图1所示,补充3 株植物乳杆菌能够在一定程度上缓解高糖高脂饮食引发的空腹血糖和空腹胰岛素水平的升高,其中QS6-12表现出较好的降血糖能力,而CCFM591能够较显著地改善胰岛素抵抗。由葡萄糖耐量曲线(图2A)可以发现,腹腔注射葡萄糖后,HFHS饮食的大鼠血糖浓度在30 min时急速上升,在接下来的90 min缓慢下降,但仍高于NC组;补充菌株CCFM591和ZS2058显著抑制了血糖浓度的升高,且在120 min时使血糖浓度下降至与NC组水平相当。计算糖耐量曲线下面积(AUCglucose)(图2B)发现,HFHS组的AUCglucose明显高于其余各组,LGG组的AUCglucose较3 株植物乳杆菌更低,RH缓解糖耐量异常效果最为明显,与NC组无统计学差异。
2.2 植物乳杆菌对大鼠血脂指标的影响
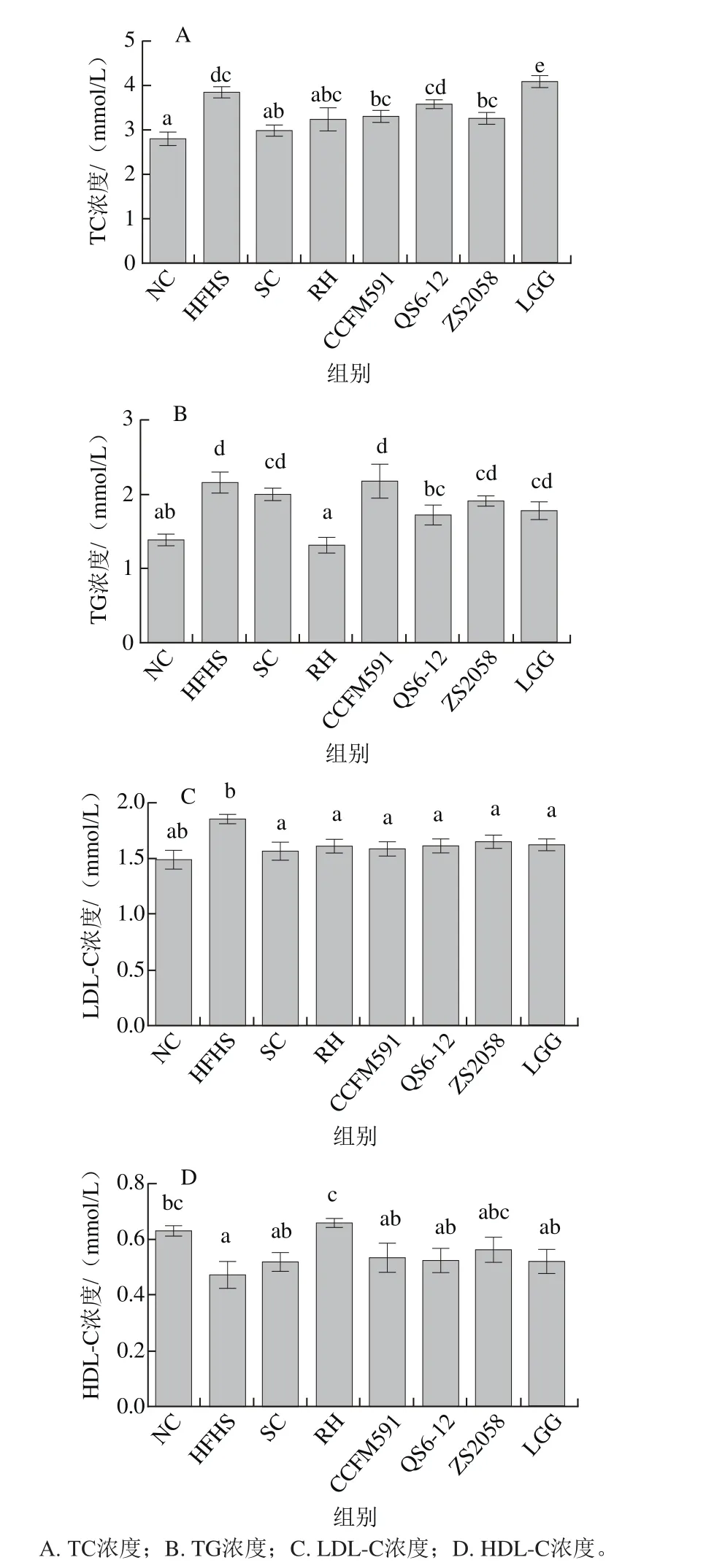
图3 植物乳杆菌对MS大鼠血脂指标的影响Fig. 3 Effect of L. plantarum on blood lipids in MS rats
如图3所示,与NC组相比,HFHS组大鼠血清中TC、TG和LDL-C浓度显著升高,HDL-C浓度下降。补充菌株ZS2058显著降低了血清中TC和LDL-C的浓度;补充菌株QS6-12使TG浓度明显下降;补充植物乳杆菌对大鼠血清中HDL-C浓度影响较小;药物RH对高糖高脂饮食大鼠的血脂紊乱有较好的缓解作用。
2.3 植物乳杆菌对大鼠肝脏抗氧化指标的影响

图4 植物乳杆菌对MS大鼠肝脏氧化应激的影响Fig. 4 Effect of L. plantarum on liver oxidative stress in MS rats
如图4所示,各组大鼠肝脏中CAT活力无显著差异,HFHS饮食导致大鼠肝脏中MDA含量升高、SOD活力下降;补充菌株QS6-12能够显著提高肝脏中SOD活力,与LGG效果相当。补充植物乳杆菌均能降低肝脏MDA的含量。
2.4 植物乳杆菌对MS大鼠组织形态的影响

图5 大鼠肝脏组织的病理学分析(200×)Fig. 5 Histopathological observation of hematoxylin-eosin stained liver sections (200 ×)
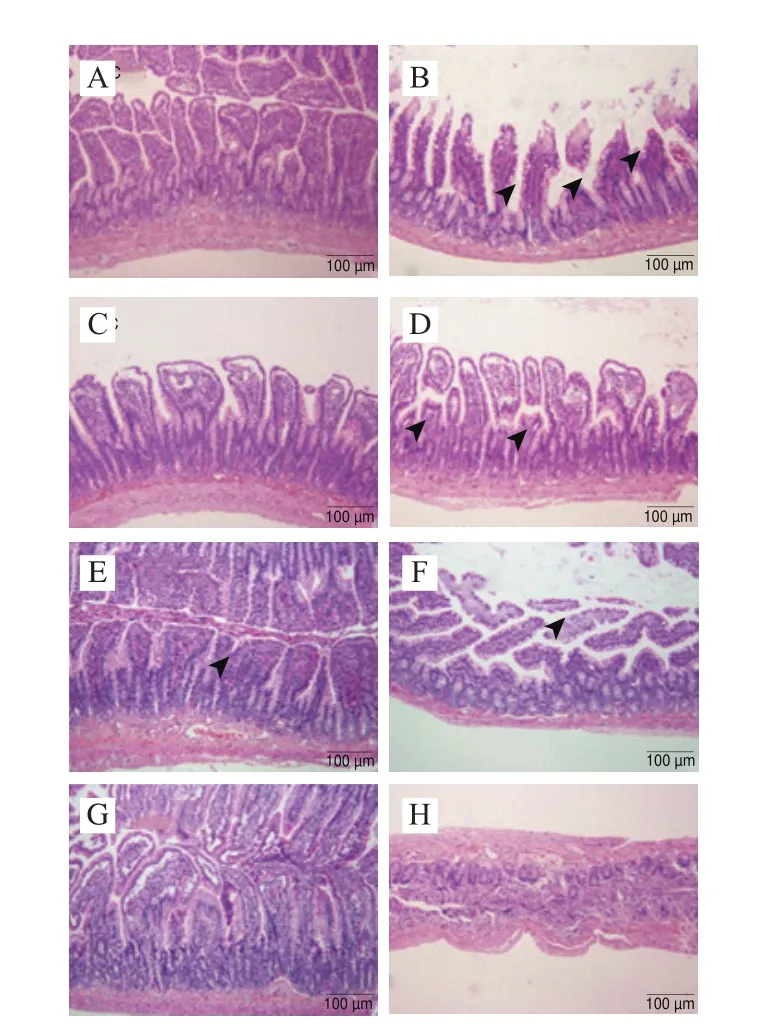
图6 大鼠小肠组织的病理学分析(100×)Fig. 6 Histopathological observation of hematoxylin-eosin stained intestinal tissue sections (100 ×)
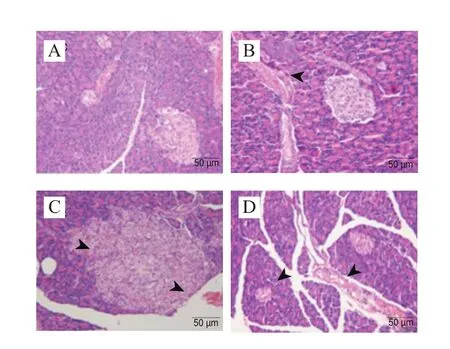

图7 大鼠胰腺组织的病理学分析(200×)Fig. 7 Histopathological observation of hematoxylin-eosin stained pancreatic tissues (200 ×)

图8 大鼠肝脏(A)、十二指肠(B)和胰腺(C)切片的组织学评分Fig. 8 Histopathological scores of liver (A), duodenum (B) and pancreatic tissues (C)
各实验组大鼠肝脏、十二指肠和胰腺的病理学切片如图5~7所示,结合组织学评分(图8)可以看出,HFHS饮食导致大鼠肝脏、十二指肠和胰腺均出现较严重的损伤,包括肝细胞空泡变性、纤维细胞增生,有早期纤维化的形态学表现;小肠病变主要在绒毛,表现出绒毛变宽、间质水肿或巨噬细胞轻度增生;内分泌部胰岛细胞变性、胰岛纤维血管增生、数目减少等。植物乳杆菌灌胃对肝脏病变无显著改善作用;然而,对十二指肠和胰岛的病变均表现出缓解作用,与NC组无显著差异。
2.5 植物乳杆菌对SCFAs的调控
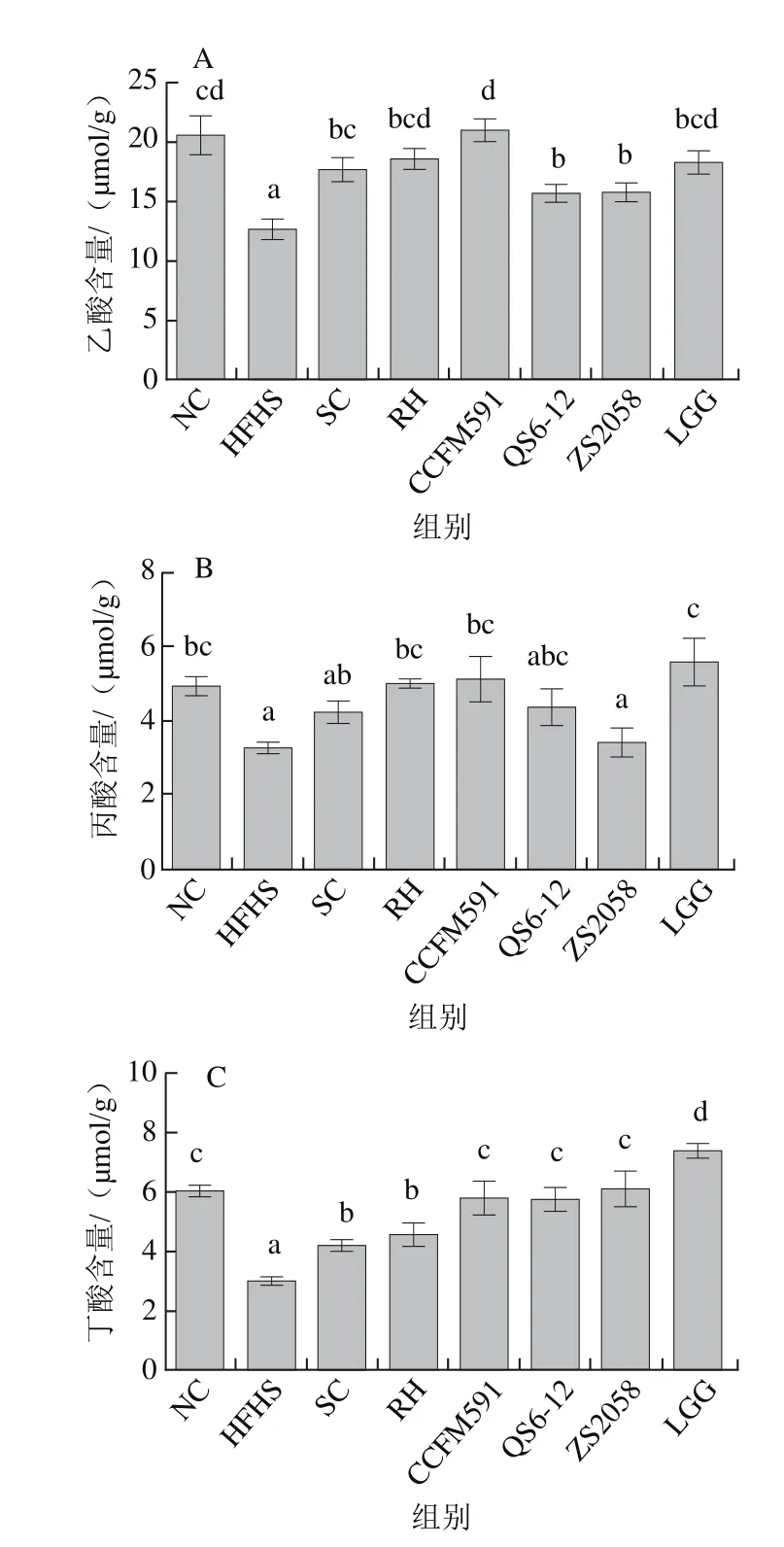
图9 植物乳杆菌对大鼠粪便乙酸(A)、丙酸(B)和丁酸(C)含量的影响Fig. 9 Effect of L. plantarum on levels of faecal acetate (A),propionate (B) and butyrate (C)
进一步对大鼠粪便的SCFAs进行分析,结果如图9所示。HFHS饮食导致粪便中乙酸、丙酸和丁酸的含量显著降低;补充菌株CCFM591使粪便中乙酸和丁酸的含量显著升高,且高于药物RH的效果,与菌株LGG的改善作用相当;除菌株ZS2058外,其他乳杆菌均能提高大鼠粪便中丙酸的含量,LGG组大鼠粪便中丙酸含量最高。
3 讨 论
胰岛素抵抗及其相关疾病的发生发展与高糖高脂饮食导致的系统性低水平炎症密不可分,近年来,越来越多的研究证实膳食补充益生菌可以缓解MS[7,24-25],但其在改善饮食诱导的代谢紊乱中发挥的具体作用仍不明确。本研究利用高糖高脂饮食诱导的MS大鼠模型,通过对大鼠血糖血脂、抗氧化能力进行检测,结合病理组织学及粪便SCFAs的分析,评价植物乳杆菌对MS的缓解作用。
通常情况下,胰腺和肝脏共同作用实现能量的转换,从而维持血液中葡萄糖和胰岛素的稳态,使机体发挥正常功能[21];高糖高脂饮食导致机体能量过剩,血糖和胰岛素之间的稳态失衡。Chen Jinjin等[26]的研究发现,补充长双歧杆菌能够降低空腹血糖的含量,提高胰岛素的敏感性,从而缓解高脂饮食导致的MS;Hsieh等[27]的研究表明,灌胃罗伊氏乳杆菌GMNL-263可降低体质量和血液中胰岛素的含量,改善高果糖饮食引发的胰岛素抵抗;Kim等[28]通过高脂饮食的大鼠模型,发现鼠李糖乳杆菌LGG可通过减少腹部脂肪的产生,增强胰岛素的敏感性。与前人的研究一致,本研究发现高糖高脂饮食的大鼠表现出一系列的代谢紊乱,包括空腹血糖和空腹胰岛素水平均显著增加,对葡萄糖的清除能力下降,导致大鼠血糖-胰岛素稳态失衡;补充3 株植物乳杆菌能够在一定程度上缓解上述症状,其中菌株QS6-12表现出较好的降血糖能力,而菌株CCFM591则在改善胰岛素抵抗方面显示出更明显的效果。葡萄糖耐量实验是一种葡萄糖负荷实验,用以了解胰岛β细胞功能和机体对血糖的调节能力;菌株CCFM591和ZS2058能够较显著地缓解口服葡萄糖导致的血糖浓度异常升高,最终维持机体血糖-胰岛素之间的稳态。
高血脂是MS的并发症之一,研究表明,血清中TC和LDL-C的水平过高将会增加心血管疾病的患病风险[29],本研究结果证实,高糖高脂饮食导致大鼠血清中TC、TG和LDL-C的含量显著升高,HDL-C含量下降;补充菌株ZS2058显著降低了血清中TC和HDL-C的浓度,但对HDL-C浓度影响较小,而菌株CCFM591对血脂紊乱无显著的改善作用,这说明不同的植物乳杆菌在控制血糖血脂代谢方面可能有着不同的调节模式,且血糖调节与血脂调节的机制也存在差异。Yang Bo等[30]曾报道菌株ZS2058具有产共轭亚油酸的能力,已知共轭亚油酸具有调节血液甘油三酯水平、防止动脉粥样硬化的功能,本研究结果再次证明菌株ZS2058具有调控高糖高脂饮食导致的血脂异常的潜力。此外,也有大量的报道证明乳酸菌在血糖血脂调节方面具有潜在的应用价值,如Xie Ning等[31]通过建立高胆固醇大鼠模型,同样证实了植物乳杆菌和嗜酸乳杆菌能够减少血清中TC和LDL-C的含量。Li Chuan等[32]利用高血脂大鼠模型发现,植物乳杆菌NCU116降低了血清中TC、TG和LDL-C水平,提高了HDL-C水平,显著改善了血脂的异常。本研究代谢指标的异常主要是血糖和血脂的变化,表现为代谢紊乱早期的症状;考虑到造模时间原因,该模型导致的代谢失调仍处于MS的前期[12]。
多项基于动物模型的研究表明,补充益生菌能缓解高脂饮食引起的机体氧化应激和炎症反应。Yadav等[33]通过高果糖大鼠模型,发现嗜酸乳杆菌和干酪乳杆菌能缓解血脂异常和氧化应激损伤;干酪乳杆菌Zhang能够降低高脂饮食大鼠的MDA水平,提高SOD和GPx的活力,改善大鼠肝脏的抗氧化能力[34];同样的,本研究显示补充植物乳杆菌能够降低MDA水平,恢复SOD活力,但考虑到造模时间较短,氧化应激水平较低,植物乳杆菌对氧化应激缓解尚不够显著。
SCFAs能够通过AMPK依赖途径参与调节肝脏的脂质代谢等功能。Demigné等[35]通过分离大鼠的肝细胞发现,乙酸是肝脏脂肪合成的底物,而丙酸能够抑制脂质生成。本研究表明,药物罗格列酮能够显著改善大鼠肝脏的病变,且粪便中SCFAs含量较高;但植物乳杆菌对肝脏病变无显著缓解作用。基于肥胖和2型糖尿病的动物模型研究,表明补充乙酸、丙酸和丁酸能够降低肝脏脂肪堆积;但至今仍缺乏SCFAs改善肝脏代谢的临床研究。高脂饮食会导致胰岛细胞病变,与Wang Gang等[23]的研究结果一致,补充植物乳杆菌能够改善胰岛细胞空泡变性和间质纤维血管增生,其中菌株CCFM591的效果最显著。
根据SCFAs参与外周组织的功能调解可以推测,SCFAs与机体的葡萄糖-胰岛素稳态密切相关[36]。乙酸在肠道末端与短链脂肪酸受体GPR41、GPR43共同作用,调节能量摄入和血糖稳态[17];而丙酸和丁酸可诱导小肠糖异生,增强交感神经的活性,从而改善葡萄糖和能量的稳态[37]。Aoki等[38]通过MS动物模型,证实了动物双歧杆菌GLC2505能够通过上调乙酸含量,降低内脏脂肪的积累,增加大鼠葡萄糖耐受能力,最终缓解MS;Yadav等[39]通过给肥胖小鼠灌胃复合益生菌剂VSL#3,发现补充益生菌可以提高乙酸水平,促进GLP-1的分泌,降低血糖水平从而缓解糖尿病;Venter等[40]通过人体研究发现,连续7 周补充丙酸能够降低空腹血糖和胰岛素增量。与上述研究结果一致,综合3 种SCFAs的变化,补充菌株CCFM591能使粪便中乙酸、丙酸和丁酸的含量均得到较为显著的升高,从而表明该菌可能通过对SCFAs的调节发挥了降血糖作用,改善了代谢紊乱大鼠的葡萄糖稳态。而其余乳杆菌对部分SCFAs的调节很可能也参与了对MS的缓解。
4 结 论
本研究通过高糖高脂饮食的动物模型,发现高糖高脂饮食引发了一系列代谢紊乱,植物乳杆菌,尤其是菌株CCFM591可有效调控肠道内3 种SCFAs的水平,这与其降低血脂并调节大鼠血糖-胰岛素稳态,减轻胰岛和小肠组织病变从而缓解大鼠MS的作用相吻合。此外,本研究也为通过膳食补充益生菌来靶向调控SCFAs、缓解机体代谢紊乱提供了新思路。
