摇青机械力对乌龙茶脂肪族类香气形成的影响
2019-07-20周子维游芳宁刘彬彬邓婷婷赖钟雄
周子维,游芳宁,刘彬彬,邓婷婷,赖钟雄,孙 云,*
(1.福建农林大学园艺学院,茶学福建省高校重点实验室,福建 福州 350002 ;2.福建农林大学园艺植物生物工程研究所,福建 福州 350002 )
做青是乌龙茶品质形成的核心工艺,是对青叶进行反复的摇青和摊放的过程。摇青机械力是运动力和摩擦力内外效应的作用,使青叶香气由青气转变为花果香[1]。香气是茶叶感官品质的重要因子,除鲜叶所固有的游离态挥发性物质外,更多香气物质由对鲜叶采后加工处理所形成。目前,茶树鲜叶中已被分离鉴定的挥发性物质约有80余种,绿茶中有200余种,红茶、乌龙茶均约有300余种[2]。茶树鲜叶中的脂类物质包括了脂肪酸、磷脂、甘油酯、糖脂等,约占干质量8%[3],相关研究发现,以亚油酸和亚麻酸为代表的长链不饱和脂肪酸能作为脂氧合酶(lipoxygenase,LOX)代谢途径的底物,在相关酶的催化下,形成大量脂肪族类香气物质[4-6]。引起脂肪酸酶促氧化反应的酶系统定位在叶绿体中,主要包括LOX、氢氧化裂解酶(hydroperoxide lyase,HPL)、乙醇脱氢酶(alcohol dehydrogenase,ADH)以及醇酰基转移酶(alcohol acyltransferases,AAT)等[7]。不饱和脂肪酸在LOX的作用下氧化成为过氧化物,过氧化物在HPL的进一步氧化裂解下生成C6醛类,C6醛类被ADH还原成为相应的醇类物质,而后部分醇类物质在AAT作用下开始发生酯化反应,形成带有花果香的叶醇酯类衍生物,除C6醛类物质外,LOX/HPL系统的产物还有12-氧代-9(Z)-月桂烯酸,该物质又会在∆3-∆2-烯酰-辅酶A异构酶(∆3-∆2-enoyl-CoA isomerase,ECI)的作用下最终形成反式-2-十二碳烯二酸,即愈伤酸(图1),它是植物响应外界损伤而转录相关抗性基因的信号分子[8]。脂肪族的醇类、醛类、酮类等物质,因低沸点、易挥发而受关注度较低,但脂肪族类香气在乌龙茶做青[9]、红茶萎凋[10]、绿茶摊放[11]等工艺过程中,脂肪酸发生裂解变化,为其他高沸点香气的形成提供良好的基础,另一方面脂肪酸氧化降解的程度,也能影响成茶贮藏期间的品质变化。
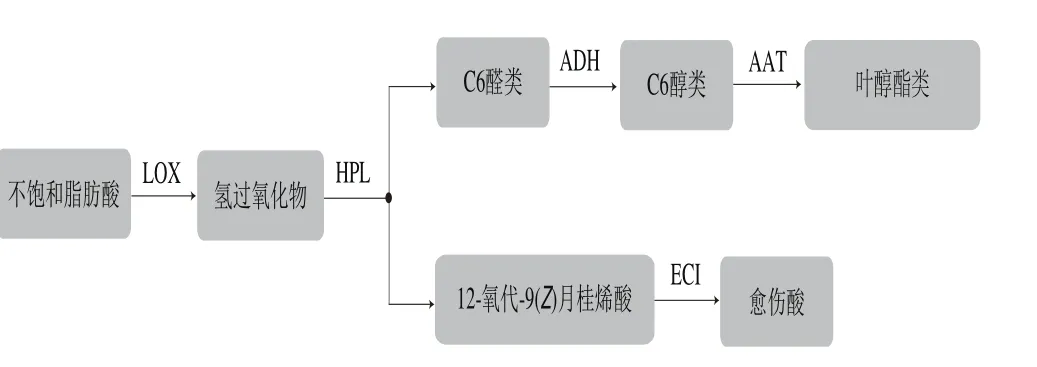
图1 不饱和脂肪酸的脂肪氧合酶代谢通路Fig. 1 LOX pathway of unsaturated fatty acids
作为植物抗逆生理中重要的应答机制,茶树LOX代谢途径的相关基因研究目前以防治茶树病虫害居多[12-14],已登录的相关基因主要有:LOX1(EU195885)、LOX2(FJ418174)、LOX3(FJ794853)、LOX4(HM370508)、HPL(HM440156.1)及ADH(HM440157.1)。LOX是LOX代谢途径的关键限速酶,它与植物的生长、发育、衰老、防御等密切相关[15]。LOX根据酶裂解位点的差异被分为9-LOX和13-LOX亚族两类,亚族间在功能和结构上存在明显差异[16]。HPL被认为是细胞色素P450酶中的特殊类型,专一裂解LOX产物,与植物抗病、抗虫以及特异气味的形成有关[17-18]。Matsui等[19]对从茶树叶片膜结构中纯化获得的两种形态的HPL进行研究,比较了13-HPL对不同脂肪酸底物的反应活性。相关研究表明,LOX/HPL系统在植物种子萌发[20]、果实成熟[21-23]、逆境胁迫[24-25]等过程中发挥重要作用。ADH是一种广泛专一性含锌金属酶,在动植物体内醇类代谢中起关键作用,它将LOX/HPL系统生成的醛类还原为醇类,分为ADH1和ADH2两种类型[26]。相关研究发现,茶树ADH基因能响应虫害胁迫和机械损伤[27-28]。然而,在茶叶生产加工过程中,在摇青机械力处理下,茶叶中脂肪族类代谢物及相关基因表达模式的研究鲜见报道。
本研究以乌龙茶品种毛蟹为材料,为突显摇青机械力的作用,设置等时间未摇青的摊放叶组,通过对离体茶树鲜叶、摇青叶、摊放叶3 种不同叶态中脂肪族类代谢物质差异和LOX代谢途径相关基因表达量的变化,分析摇青机械力对脂肪族类香气形成与相关基因表达量的相关性,阐释离体叶片中脂肪族类香气物质形成的分子机理,为乌龙茶加工过程中香气品质的形成研究提供参考。
1 材料与方法
1.1 材料与试剂
实验材料为种植于福建农林大学教学实验茶场的乌龙茶品种毛蟹(Camellia sinensis cv. Maoxie)。采摘时间为2017年10月上旬,采摘标准为当年生长无病虫害的一芽三四叶。
亚油酸(色谱纯)、亚麻酸(色谱纯) 美国Sigma公司;愈伤酸(标准品) 东京TCI公司;总RNA提取试剂盒 天根生化科技(北京)有限公司;反转录试剂盒及实时荧光定量使用试剂 日本Takara公司。
1.2 仪器与设备
6CYQT-60型摇青机、LGJ-25C型冷冻干燥机 北京四环生物制药有限公司;超高效液相色谱仪 美国Waters公司;气相色谱-质谱联用仪 美国铂金埃尔默公司;高速冷冻离心机 美国贝克曼库尔特公司;实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qPCR)仪 美国罗氏公司。
1.3 方法
1.3.1 茶叶的处理及分组
如图2所示,在对鲜叶(XY)适度萎凋至含水率为72%后,将萎凋叶(1 000 g)均分为两组,实验组采用乌龙茶做青工艺对日光萎凋叶进行4 次摇青处理,每次摇青时间为3 min,期间每次摊放30 min,摇青桶转速控制为40 r/min,做青过程总历时为180 min,以鲜叶呈汤匙状、绿叶红边明显、花果香浓郁为标准做青叶(YQ);同时在相同环境条件下设置对照组,即将另一组萎凋叶进行无摇青的摊放处理,作为等时的摊放叶(TF)。对每次处理的取样进行3 次重复,用锡箔纸包好,采用液氮固样法进行固样,固样后样品放置于-70 ℃冰箱中保存备用。

图2 乌龙茶加工过程中不同处理下的叶态Fig. 2 Turning-over and spreading of tea leaves during oolong tea processing
1.3.2 液相色谱-质谱测定不饱和脂肪酸及愈伤酸
液相色谱-质谱(liquid chromatograph mass spectrometer,LC-MS)条件参照文献[29]。
样品预处理:取冷冻干燥后样品50 mg,加入500 μL试剂1(V(异丙醇):V(水):V(阿魏酸)=2:1:0.002),加入2 颗预冷钢珠,研磨2 min,-20 ℃放置20 min,冰浴中超声30 min,加入1 mL氯仿,-20 ℃放置20 min,冰浴中超声5 min,漩涡振荡1 min,13 000 r/min离心5 min,取下层900 μL,挥干,1 mL甲醇超声复溶1 min,样品存放于-20 ℃待测。
采用BEH C8色谱柱(100 mm×2.1 mm,1.8 μm);气帘气35 psi;离子喷雾电压-4 500 V;温度350 ℃;离子源Gas1:30、Gas2:40;流动相B(10 mmol/L甲酸铵水溶液,含体积分数0.1%甲酸),流动相A(乙腈),采用等度洗脱。在Analyst软件中采用默认参数对各MRM transition进行自动识别和积分。样本浓度计算:将样品分析物的质谱峰面积,代入线性方程中计算。
1.3.3 顶空萃取条件
顶空瓶加热温度80 ℃;取样针温度100 ℃;样品瓶平衡温度150 ℃;样品平衡时间5 min;进样时间1.0 min;加压时间2.0 min;拔针时间0.5 min。
1.3.4 气相色谱-质谱测定脂肪族类香气成分
气相色谱-质谱条件参照文献[30]。采用VF-5MS色谱柱(30 m×0.25 mm,0.25 μm)。进样口温度:250 ℃,升温程序:初始温度40 ℃保持5 min,以2 ℃/min升至70 ℃,再以10 ℃/min升至230 ℃;载气为氦气,纯度99.99%;质谱接口温度250 ℃、传输线温度120 ℃;离子方式EI源,离子源温度200 ℃;检测器电压70 eV;采用全扫描模式,扫描范围45~500 amu。测定数据由仪器自带软件进行分析处理,将茶叶样品中脂肪族挥发性组分与NIST库分析比较后,将峰面积大于1%的色谱峰作为有效观测值,以归一法确定各个物质的含量。
1.3.5 叶片中总RNA的提取及反转录
取0.5 g供试材料,利用RNAprep Pure Plant Kit提取样品的总RNA,用1.2%变性琼脂糖凝胶电泳检测其完整性,并检测其吸光度及浓度,用PrimeScript RT Reagent Kit with gDNA Eraser将提取的总RNA反转录为cDNA。
1.3.6 qPCR检测
以不同叶态的mRNA反转录成cDNA为模板,利用qPCR技术对不同叶态中的脂肪酸代谢途径相关基因的表达进行分析。采用DNAMAN 6.0软件设计茶树ADH基因的qPCR引物(表1),以茶树GAPDH为内标基因[31]。反应体系20 μL:1.0 μL 4×diluted cDNA,10 μL SYBR II,0.8 μL上、下游引物和7.4 μL ddH2O。PCR反应程序:95℃ 预变性3 min;95 ℃变性30 s,60 ℃退火20 s,72 ℃延伸30 s,40 个循环;72 ℃ 延伸10 min。采用2-△△Ct分别计算出相关基因的相对表达量[32]。

表1 茶树中脂肪酸代谢途径相关酶基因的引物Table 1 Primer sequences used for qPCR ampli fi cation of fatty acid metabolism-related genes in tea tree
1.4 数据统计与分析
显著性分析采用SPSS 18.0软件中的单因素方差分析最小显著差异法,P<0.05表示差异显著。相关性分析采用SPSS 18.0软件中双变量相关性检测,以Pearson相关系数衡量变量间的线性关系,显著性采用双侧检验。
2 结果与分析
2.1 摇青机械力对不饱和脂肪酸的影响
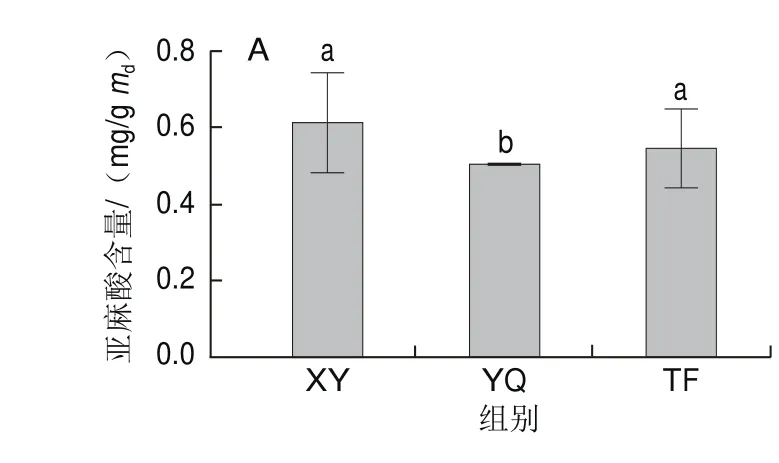
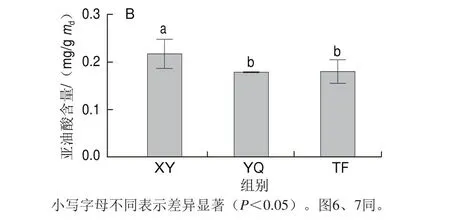
图3 不同叶态中亚麻酸(A)、亚油酸(B)的含量变化Fig. 3 Changes in linolenic acid (A) and linoleic acid (B) content in different kinds of tea leaves
作为LOX代谢途径上重要的前体物质,亚麻酸和亚油酸在LOX的作用下氧化降解后生成脂肪族类挥发物质。LC-MS对样品中靶向代谢物的检测结果如图3所示,鲜叶中的亚油酸(0.614 mg/g)和亚麻酸(0.227 mg/g)含量最高,在摇青机械力处理后含量骤减,分别降低了17.98%、21.52%,摇青叶中的亚麻酸和亚油酸的含量与鲜叶中的差异达显著水平(P<0.05),摊放处理下亚麻酸和亚油酸的含量分别降低了10.86%、20.71%,但摊放叶中仅亚油酸含量与鲜叶差异达显著水平(P<0.05)。
2.2 摇青机械力对脂肪族类香气的影响
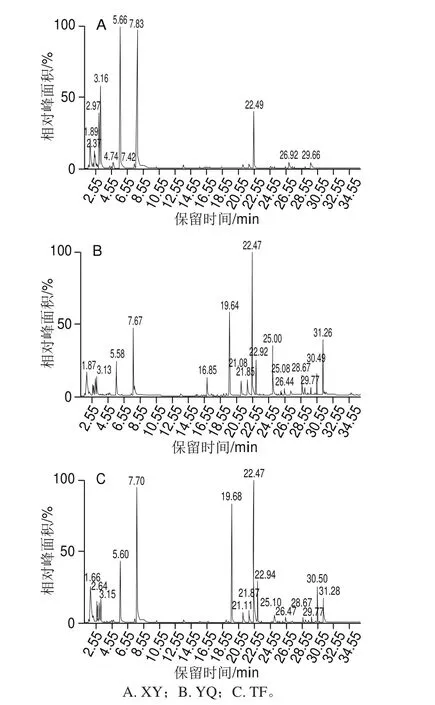
图4 不同叶态挥发性组分的峰面积Fig. 4 Peak proportions of volatile components in different kinds of tea leaves
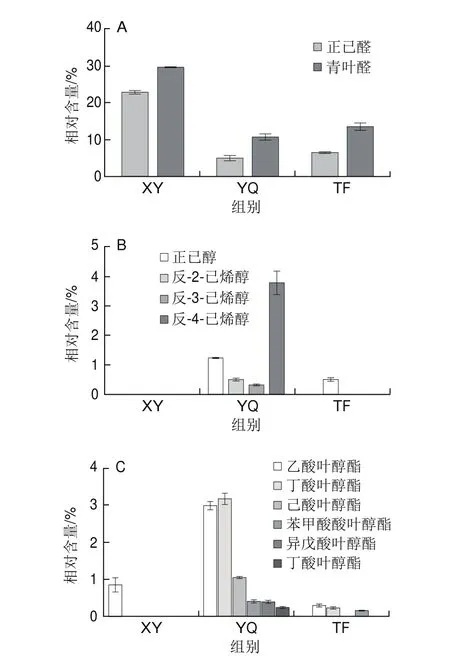
图5 不同叶态C6醛类(A)、C6醇类(B)、叶醇酯类衍生物(C)的变化Fig. 5 Changes in C6 aldehyde (A), C6 alcohol (B) and leaf alcohol ester derivatives (C) in different kinds of tea leaves
实验得到不同叶态不同挥发性物质的峰面积如图4、5所示,从中筛选获得脂肪族类香气物质,根据物质差异分为C6醛、C6醇以及叶醇酯类衍生物3 类。
脂肪族醛类是茶叶清香气味的重要成分之一,以C6醛类含量最为丰富,占茶叶芳香油含量的5%。鲜叶中测得C6醛主要有正己醛(22.53%)和青叶醛(29.46%)。与鲜叶相比,在机械力处理下的摇青叶中正己醛(4.82%)、青叶醛(10.57%)相对含量分别减少了78.60%和64.12%,而摊放叶中正己醛(6.46%)、青叶醛(13.44%)的相对含量也减少了71.33%和54.38%。
脂肪族醇类沸点低、易挥发,具有强烈的青草气。在鲜叶中未测得相应的C6醇类物质,摇青叶中检测到含有正己醇(1.20%)、反-2-己烯醇(0.48%)、反-3-己烯醇(0.30%)以及反-4-己烯醇(3.75%),而摊放叶中仅测得反-2-己烯醇(0.47%)。
脂肪族醇会进一步酯化成为具有水果清香的叶醇酯类物质。鲜叶仅测得乙酸叶醇酯(0.83%),在机械力作用下摇青叶中的叶醇酯类衍生物有乙酸叶醇酯(2.97%)、丁酸叶醇酯(3.15%)、己酸叶醇酯(1.06%)、苯甲酸叶醇酯(0.41%)、异戊酸叶醇酯(0.39%)及丁酸己酯(0.26%),摊放叶中测得的叶醇酯类衍生物有丁酸叶醇酯(0.29%)、己酸叶醇酯(0.22%)及异戊酸叶醇酯(0.14%)。机械力作用下,摇青叶中的叶醇酯类衍生物在类型和含量上都明显增多,其中苯甲酸叶醇酯、丁酸己酯仅在摇青叶中测得,摇青叶中乙酸叶醇酯的含量相比鲜叶增多了257.83%,丁酸叶醇酯、己酸叶醇酯、异戊酸叶醇酯比摊放叶中分别增多了986.20 %、381.82 %以及178.57 %。
2.3 摇青机械力作用下脂肪酸代谢途径相关基因的表达量

图6 不同叶态中LOX(A)、HPL(B)及ADH(C)基因相对表达量的变化Fig. 6 Changes in relative expression levels of LOX (A), HPL (B) and ADH (C) genes in different kinds of tea leaves
不同叶态中脂肪代谢途径相关基因的表达量如图6所示。LOX1基因在摇青叶中相对表达水平最高,是鲜叶的9.62 倍,摊放叶中的表达水平其次,是鲜叶的4.44 倍。不同叶态的LOX1基因的表达量两两之间存在显著性差异(P<0.05)。LOX2和LOX3均是在摊放叶中表达水平最高,其次为摇青叶,摊放叶中LOX2、LOX3基因的表达水平分别是鲜叶的2.21 倍和5.97 倍,摇青叶中的表达水平则分别是鲜叶的1.39 倍和2.87 倍,不同叶态中LOX3基因两两间存在显著性差异(P<0.05),但LOX2基因仅摊放叶与鲜叶、摇青叶存在显著性差异(P<0.05),而鲜叶与摇青叶间并无显著性差异。不同叶态中鲜叶的LOX4表达水平最高,其次为摇青叶,摊放叶中表达量最低。LOX4基因在摇青叶、摊放叶的表达量分别是鲜叶的94%和66%,同时不同叶态的LOX4基因的表达量两两之间也存在显著性差异(P<0.05)。不同叶态中的HPL基因以摊放叶表达水平最高,其次为摇青叶,摊放叶、摇青叶的HPL基因表达量分别是鲜叶的2.69 倍和1.68 倍,摊放叶中HPL基因表达水平与摇青叶、鲜叶间存在显著性差异(P<0.05),但摇青叶与鲜叶间不存在显著性差异。不同叶态的ADH基因以摇青叶的表达量最高,其次为鲜叶,摊放叶最低,摇青叶、摊放叶的ADH基因表达水平分别是鲜叶的2.37 倍和1.01 倍,摇青叶中ADH基因与鲜叶、摊放叶间存在显著性差异(P<0.05),但摊放叶与鲜叶间不存在显著性差异。
2.4 摇青机械力对愈伤酸含量的影响
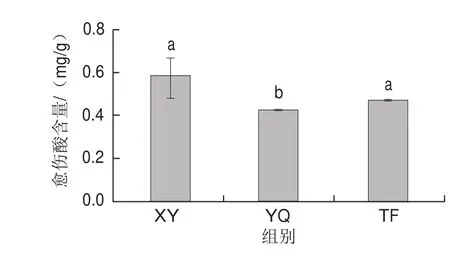
图7 不同叶态中愈伤酸的含量变化Fig. 7 Change in traumaic acid content in different kinds of tea leaves
除C6醛类物质外,LOX/HPL系统的产物还有12-氧代-9(Z)-月桂烯酸,之后又会在十二酰基CoA异构酶(EC 5.3.3.8)的作用下最终形成反式-2-十二碳烯二酸,即愈伤酸。愈伤酸是天然存在于植物中的单元不饱和二羧酸,它能够响应植物的愈伤反应,而介导相关基因的转录。通过LC-MS检测不同叶态的愈伤酸含量,结果如图7所示,愈伤酸含量:鲜叶>摊放叶>摇青叶,这说明在叶片失水过程中愈伤酸含量在减少,但摇青处理后愈伤酸的含量与鲜叶间的差异达显著水平(P<0.05),而摊放处理则未达到显著水平。
2.5 摇青机械力作用下脂肪族类代谢物含量与相关基因表达量间的相关性分析
脂肪族类代谢物含量与脂肪族代谢途径中LOX1-4、HPL及ADH基因的相关性分析如表2所示。结果表明,不同叶态中LOX1基因的表达水平与测得的脂肪族类香气物质含量均存在相关性,其中与青叶醛、正己醛含量极显著负相关(P<0.01),与正己醇、反-3-己烯醇、反-4-己烯醇、丁酸叶醇酯、己酸叶醇酯、苯甲酸叶醇酯、异戊酸叶醇酯及丁酸己酯含量间均存在极显著正相关性(P<0.01),与反-2-己烯醇、乙酸叶醇酯间存在显著性正相关性(P<0.05)。ADH基因的表达水平与正己醇、反-3-己烯醇、反-4-己烯醇、乙酸叶醇酯、丁酸叶醇酯、己酸叶醇酯、苯甲酸叶醇酯、以及丁酸己酯间存在极显著正相关(P<0.01),但与青叶醛、正己醛以及反-2-己烯醇之间不存在显著相关性。LOX4基因的表达水平与正己醛、青叶醛含量存在显著正相关性(P<0.05),同时与反-2-己烯醇含量存在显著负相关性(P<0.05)。LOX3基因的表达水平与反-2己烯醇间存在显著正相关性(P<0.05),而LOX2和HPL基因表达量则与测得的所有脂肪族类香气物质含量均不存在显著相关性。亚油酸、亚麻酸含量仅与ADH基因表达量间存在显著负相关性(P<0.05),而愈伤酸含量与LOX1、LOX3基因表达量间存在极显著负相关性(P<0.01)。

表2 脂肪族类代谢物含量与脂肪酸代谢途径相关基因表达量间的相关系数Table 2 Correlation coef fi cients between aliphatic aroma and relative expression levels of fatty acid metabolism-related genes
3 讨 论
3.1 摇青机械力对脂肪族类代谢物的转变
随着鲜叶的离体,LOX/HPL系统开始氧化降解鲜叶中不饱和脂肪酸,摇青机械力进一步加重离体叶的损伤程度,在摇青叶中C6醛类较摊放叶中转化降低更为明显,且亚油酸和亚麻酸含量均较低,这说明摇青机械力的刺激促进了LOX/HPL系统的活性,Qian Xu等[33]的研究发现,葡萄LOX/HPL代谢通路上相关基因的表达,能显著促进果实中绿叶挥发物质(green leaf volatile,GLVs)的转变。同时,这种损伤胁迫下促使了ADH基因表达水平的上调,并丰富了C6醇类及叶醇酯类衍生物,C6醇类在摇青叶中以正己醛和反式己烯醇为主,反式己烯醇的形成说明摇青机械力可能激活了异构因子,C6醇类物质由顺式向反式转变,这种异构作用促使青叶中强烈的青气香转变为柔和的怡人清香[34],即完成低级的脂肪族类GLVs向果酯类香型转变。叶醇酯类物质是C6醇类物质在AAT作用下叶醇类物质的衍生物,配体的结合使化学性质更加稳定。测得的叶醇酯类及其衍生物普遍具备弥散性清新果香[35],鲜叶和摊放叶中醇酯类物质在组分和含量上都远低于摇青叶,这表明了摇青机械力可能激活了AAT的活性,促使酯化反应发生。以失水为主的摊放叶受到的外界损伤较小,离体鲜叶中13-LOX亚族中的LOX2、LOX3基因及HPL基因大量表达,这说明酶系统在氧化裂解不饱和脂肪酸的同时,生成的愈伤酸可能响应离体胁迫,而摊放过程中完成自我修复,从而抑制了LOX/HPL通路的下游酶活性。
3.2 LOX /HPL代谢通路基因的表达差异
LOX1基因在不同叶态中表达水平与所有脂肪族类香气存在显著相关性,LOX2、LOX3基因表达量变化趋势基本一致,这可能是因为二者同属13-LOX亚族,但LOX1、LOX4基因表达差异却较大,尤其与C6醛类的相关性完全相反,造成这种现象的原因可能是13-LOX亚族基因核酸序列间相似度较高,而9-LOX亚族间基因相似度较低,这在一定程度上表明9-LOX亚族基因所编码的蛋白在进化过程中出现了明显的亚功能化,同时对茶树中LOX1基因编码的蛋白并非完全属于9-LOX亚族[36],该基因编码的蛋白是一类具备双裂解位点的9/13-LOX蛋白,Liu Shou’an等[37]验证茶树中LOX1基因的性征,并发现在该基因在茶花衰老过程中表达水平明显上调。Fu Xiumin等[38]研究了不同光质条件下,LOX基因的表达模式。Gui Jiadong等[39]认为乌龙茶的花果香与做青过程中青叶LOX活性上升有关。王晶[9]则研究了乌龙茶加工过程中LOX活性和香气间的变化。这或许暗示着茶树LOX基因家族中具备多裂解位点的家族成员,对茶叶加工过程中的香气形成有着积极的影响。大量研究表明植物应对外界损伤时LOX代谢途径起主要作用的是13-LOX亚族的基因[40-42],而LOX2、LOX3基因在摊放叶中应对离体胁迫时候的大量表达正契合了这一观点,同时也说明摇青机械力作用的二次损伤,虽不能上调13-LOX亚族基因的表达,但却能显著诱导上调9/13-LOX亚族中LOX1基因的表达。同时ADH基因的表达水平和叶醇酯类衍生物含量呈正相关,表明代谢途径下游的ADH在机械力胁迫下对脂肪香气的形成有积极的作用。辛肇军等[28]从龙井43中克隆了CsADH1序列,发现并验证了CsADH1基因的表达受外界机械损伤、茉莉酸和水杨酸的诱导。
4 结 论
鲜叶中以亚麻酸和亚油酸为代表的不饱和脂肪酸,因采摘造成了第一次的损伤胁迫,激活了LOX/HPL系统,LOX与HPL将不饱和脂肪酸氧化降解为GLVs类物质。摇青处理诱导了LOX1和ADH基因的转录,C6醛类物质被还原为C6醇类物质,在机械力反复作用的摇青叶中,二次损伤在间歇反复进行,自身修复愈伤能力在做青后期已经逐步散失,离体叶片中的愈伤酸不足以修复损伤,而这正激活下游的ADH、AAT,促使摇青叶中丰富的脂肪族类及其他香气物质的形成;但摊放过程中形成愈伤激素,失水的同时完成因采摘而形成第一次损伤的自我修复,并终止了下游代谢的进行,所以,未经摇青的绿茶以绿叶的清香为主,而摇青工艺则赋予了乌龙茶丰富的花果香(图8)。

图8 离体鲜叶脂肪酸代谢与绿茶、乌龙茶香气形成的关系Fig. 8 Relationship between fatty acid metabolism in vitro in tea leaves and the aroma formation of green tea and oolong tea
