6份披碱草属牧草种质材料抗寒性的比较
2019-07-20陈玖红周青平
陈玖红,王 沛,王 平,胡 健,周青平
(西南民族大学生命科学与技术学院,四川 成都 610041)
青藏高原地域辽阔,总面积约250万km2,占中国陆地总面积的1/4。高寒草地面积约128万km2,占青藏高原总面积的54%,是世界最大的天然草地区[1-2]。青藏高原山系平均海拔超过5 500 m,高海拔导致的相对低温突出,是地球同纬度最寒冷的地区,也是全国的低温中心之一。高原面上最冷月月均温低至-15~-10 ℃,大部分地区最暖月月均温 < 10 ℃[2-3]。低温会改变细胞膜透性[4],通过氧化酶系统和渗透调节系统抑制植物代谢反应[5-8],造成植物在低温环境下发育缓慢或不能正常生长。因此低温是影响植物正常生长发育的关键因子之一。植物低温胁迫分为冷害(0~20 ℃)和冻害(≤ 0 ℃),且二者具有明显差异,受到低温伤害时质膜会发生物相变化,由开始的液晶相转为凝胶相,遭受冻害时造成细胞内部结冰,破坏了原生质的结构[9]。植物在不冻结的低温下获得更高的耐寒性的过程叫作冷适应(又称抗寒锻炼),经过冷适应植物的抗冻性也会有所提高,而植物的抗冻性则直接取决于抑制细胞内冰晶形成的能力[10]。
披碱草属(Elymus)是禾本科(Gramineae)小麦族(Triticeae)一重要类群[11],为青藏高原天然草地的建群种和优势种,主要分布在海拔2 000~5 200 m的地区,饲用价值高。该属部分种具有抗旱、耐寒、耐盐碱、耐贫瘠、适应性广、遗传多样性丰富等优良特性,是青藏高原地区的优良草种[12],且由于长期生长在高海拔地区其抗寒性最为突出。然而,因属内不同种遗传背景不同,以及不同种、不同野生种质材料的生境不同,造成不同种及种质之间抗寒性存在差异。本研究以来自高寒地区的3份垂穗披碱草(E.nutans)、2份老芒麦(Elymus sibiricus)、1份圆柱披碱草(E.breviaristatus)为试验材料,通过比较冷胁迫下6份披碱草属牧草幼苗膜脂过氧化程度、保护酶系统的活性、渗透调节物质含量的变化以及其相关关系,探讨这6份披碱草属牧草种质材料幼苗的耐低温生理特性,旨在为高寒地区的抗寒披碱草种质筛选提供理论依据。
1 材料与方法
1.1 供试材料和试验试剂
供试材料如表1所列,试验采用盆栽法,以品氏营养土为培养介质。2018年5月将6份材料的种子均匀撒播在花盆中,播种量为15 g·m-2,覆土,润湿。材料放入人工气候箱培养,每天日间光照为16 h,光照强度为12 300 lx,温度为25 ℃,湿度为60%;夜间无光照,温度为25 ℃,湿度为75%。待出苗后每隔2 d浇灌营养液(N∶P∶K = 1∶1∶1)一次,15 d后(株高约15 cm,生长至三叶期)进行冷胁迫处理:对照组温度仍为25 ℃,处理组温度为5 ℃,其他条件不变。冷胁迫8、16和24 d后进行相关指标的测定。每个处理设置6个重复。
1.2 测定项目及方法
每个处理随机选取生长一致的幼苗,用蒸馏水冲洗干净叶片,吸干水分。叶片相对含水量(ralative water content,RWC)和叶绿素(chlorophyll,Chl)含量的测定以《植物生理学实验技术》为指导[13]。膜透性采用电导法测定[14];丙二醛(malondialdehyde,MDA)含量测定采用硫代巴比妥酸法[15];超氧化物歧化酶(superoxide dismutase,SOD)活性采用氮蓝四䂳(nitro-blue tetrazolium,NBT)法测定,过氧化氢酶(catalase,CAT)活性采用紫外分光光度法测定[16]。

表1 6份供试牧草种质材料来源Table 1 The sources of six Elymus germplasms
1.3 数据处理
利用各指标的变化率(低温处理下的测定值/对照下的测定值)消除各品种间的差异。当比值 < 1 时,描述的是该指标与对照相比的降低情况;当比值 >1 时,表示的是该指标与对照相比的增加情况。本研究采用SPSS 22.0统计分析,采用DUNCAN法对平均值进行多重比较,采用Origin 2017制作图表。
2 结果与分析
2.1 冷胁迫下6份披碱草属种质的叶片相对质膜透性变化率
冷胁迫下,相对质膜透性变化率越低,对细胞膜的破坏程度越小;相对质膜透性变化率越高,对细胞膜的破坏越严重(图1)。冷胁迫8 d时,I-1-1-1的相对质膜透性变化率最高,细胞膜遭到的破坏最严重;12-9-1、11-6的相对膜透性变化率较低,细胞膜的破坏程度较小,且二者差异不显著(P> 0.05)。冷胁迫16 d 时,I-1-5-66的相对膜透性变化率最高,细胞膜遭到的破坏最严重;12-9-1、09-214、11-6的相对膜透性变化率较低,细胞膜的破坏程度较小,且三者差异不显著。冷胁迫24 d时,I-1-5-66、I-1-1-10、I-1-1-1相对膜透性变化率较高,细胞膜遭到的破坏较严重,且三者差异不显著;12-9-1、09-214、11-6相对膜透性变化率较低,细胞膜的破坏程度较小,且三者差异不显著。
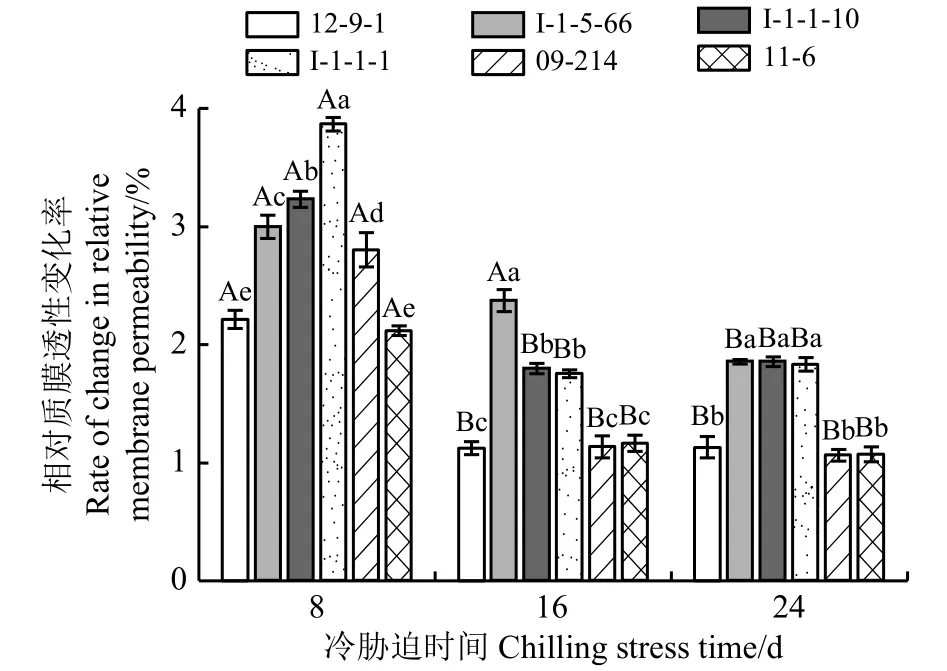
图1 冷胁迫下6份披碱草属种质叶片相对膜透性的变化率Figure 1 The difference between the changing rate of relative membrane permeability of six Elymus germplasms under chilling stress
相对质膜透性变化率在冷胁迫8~16 d的过程中除I-1-5-66差异不显著(P> 0.05)外,其他种质材料差异均显著(P< 0.05);冷胁迫16~24 d时除I-1-5-66的相对质膜透性变化率差异显著外,其他种质材料差异均不显著。说明I-1-5-66前期的抗寒性较稳定,随着冷胁迫时间的延长,其抗寒性逐渐降低;12-9-1、I-1-1-10、I-1-1-1、09-214和 11-6在前期抗寒性显著下降而后期变化不显著,表现出了长期冷胁迫下对低温的适应能力。
2.2 冷胁迫下6份披碱草属种质的叶片丙二醛含量变化率
MDA含量变化率越低,膜脂过氧化程度越低;MDA含量变化率越高,膜脂过氧化程度越高(图2)。冷胁迫8 d时,I-1-5-66的MDA含量变化率最高,膜脂过氧化程度最高;12-9-1、09-214、11-6的MDA含量变化率较低,膜脂过氧化程度较低,且三者差异不显著(P> 0.05)。冷胁迫16 d 时,I-1-1-1的MDA含量变化率最高,膜脂过氧化程度最高;12-9-1的MDA含量变化率最低,膜脂过氧化程度最低。冷胁迫24 d 时,I-1-5-66、I-1-1-1的MDA含量变化率较高,膜脂过氧化程度较高,且二者差异不显著;12-9-1、09-214、11-6的MDA含量变化率较低,膜脂过氧化程度较低,且三者差异不显著。
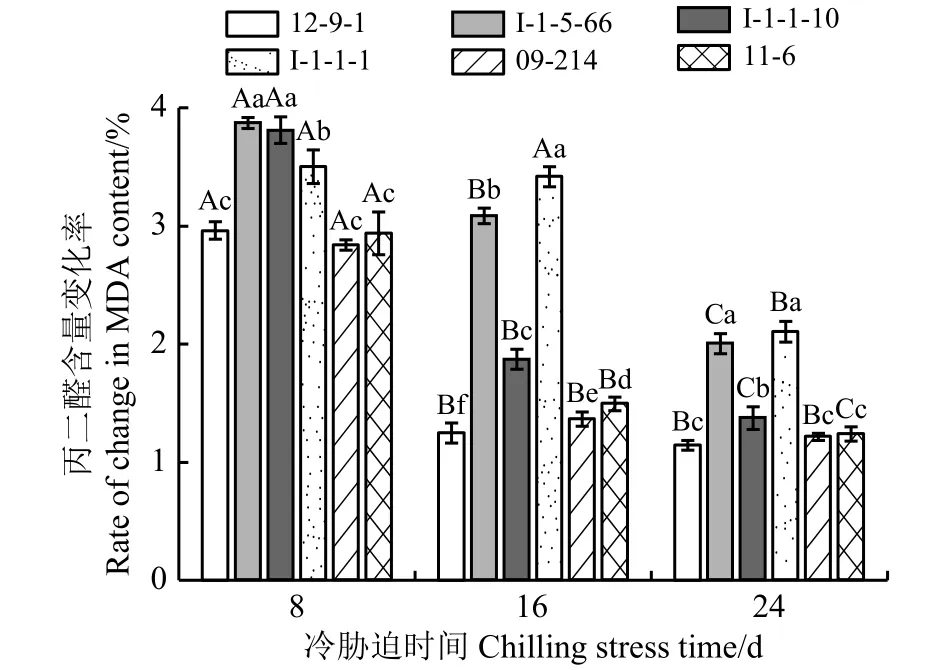
图2 冷胁迫下6份披碱草属种质的叶片丙二醛含量变化率Figure 2 The difference between the changing rate of the content of MDA for six Elymus germplasms under chilling stress
MDA含量变化率在冷胁迫8~16 d的过程中除I-1-1-1差异不显著(P> 0.05)外,其他种质材料差异均显著 (P< 0.05);冷胁迫 16~24 d时 I-1-5-66、I-1-1-10、I-1-1-1、11-6的MDA含量变化率差异显著,12-9-1、09-214的差异均不显著。说明I-1-1-1前期的抗寒性较稳定,随着冷胁迫时间的延长,其抗寒性显著降低;12-9-1和09-214在前期抗寒性显著下降而后期变化不显著,表现出了长期冷胁迫下对低温的适应能力。
2.3 冷胁迫下6份披碱草属种质的叶片相对含水量变化率
RWC变化率越低,细胞的保水能力越弱;RWC变化率越高,细胞的保水能力越强(图3)。冷胁迫8 d时,12-9-1、09-214、11-6的RWC变化率较高,细胞的保水能力较强,且三者差异不显著(P>0.05);I-1-5-66、I-1-1-10、I-1-1-1的RWC变化率较低,细胞的保水能力较弱,且三者差异不显著。冷胁迫16 d、24 d时,12-9-1、09-214、11-6的RWC变化率较高,细胞的保水能力越较强,且三者差异不显著;I-1-1-1的RWC变化率最低,细胞的保水能力最弱。

图3 冷胁迫下6份披碱草属种质的叶片相对含水量变化率Figure 3 The difference between the changing rate of RWC for six Elymus germplasms under chilling stress
RWC变化率在冷胁迫8~16 d的过程中,I-1-1-10、I-1-1-1的 RWC 变化率显著降低 (P> 0.05),12-9-1、I-1-5-66、09-214、11-6 无显著变化(P< 0.05);冷胁迫16~24 d时,I-1-5-66、I-1-1-10、I-1-1-1的RWC变化率显著下降,12-9-1、09-214、11-6的RWC无显著变化。说明I-1-1-10、I-1-1-1随着冷胁迫时间的延长,抗寒性显著减弱,对低温敏感且适应性较弱;12-9-1、09-214、11-6在长期冷胁迫下都能维持较强的抗寒性。
2.4 冷胁迫下6份披碱草属种质的叶片脯氨酸含量变化率
Pro含量变化率越低,对低温的耐受能力越强;Pro含量变化率越高,对低温的耐受能力越弱(图4)。冷胁迫8 d时,I-1-5-66的Pro含量变化率最高,对低温的耐受能力最弱;12-9-1的Pro含量变化率最低,对低温的耐受能力最强。冷胁迫16 d时,I-1-1-10的Pro含量变化率最高,对低温的耐受能力最弱;12-9-1、11-6的Pro含量变化率较低,对低温的耐受能力较强,且二者差异不显著(P>0.05)。冷胁迫24 d 时,I-1-1-1的Pro含量变化率最高,对低温的耐受能力最弱;12-9-1、09-214、11-6的Pro含量变化率较低,对低温的耐受能力较强,且三者差异不显著。

图4 冷胁迫下6份披碱草属种质的叶片脯氨酸含量变化率Figure 4 The difference between the changing rate of the content of Pro for six Elymus germplasms under chilling stress
Pro含量变化率在冷胁迫8~16 d的过程中,I-1-5-66、09-214、11-6的Pro含量变化率无显著差异(P> 0.05)外,其他种质材料的Pro含量变化率均显著升高 (P< 0.05);冷胁迫 16~24 d时除 09-214的Pro含量变化率无显著变化外,其余种质材料均有显著变化。说明I-1-5-66前期的抗寒性较稳定,随着冷胁迫时间的延长,其抗寒性显著降低;09-214在长期冷胁迫的环境下能够维持较稳定的抗寒性,对低温不敏感。
2.5 冷胁迫下6份披碱草属种质的叶片可溶性糖含量变化率
SS含量变化率越低,对低温的耐受能力越强;SS含量变化率越高,对低温的耐受能力越弱(图5)。冷胁迫8 d时,I-1-5-66、I-1-1-10、I-1-1-1的SS含量变化率较高,对低温的耐受能力较弱,且三者差异不显著(P> 0.05);09-214的SS含量变化率最低,对低温的耐受能力最强;冷胁迫16 d 时,I-1-5-66的SS含量变化率最高,对低温的耐受能力最弱;12-9-1的SS含量变化率最低,对低温的耐受能力最强。冷胁迫24 d 时,I-1-5-66、I-1-1-10、I-1-1-1的SS含量变化率较高,对低温的耐受能力较弱,且三者差异不显著;11-6的SS含量变化率最低,对低温的耐受能力最强。
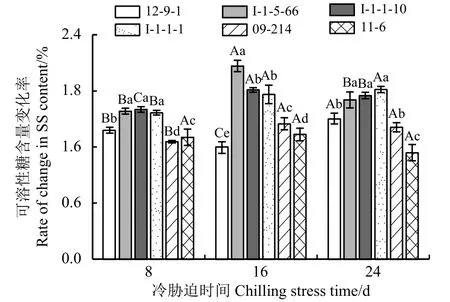
图5 冷胁迫下6份披碱草属种质的叶片可溶性糖含量变化率Figure 5 The difference between the changing rate of the content of SS for the six Elymus germplasms under chilling stress
SS含量变化率在冷胁迫8~16 d的过程中,除11-6无显著变化外(P> 0.05),其他种质材料均呈显著变化 (P< 0.05);冷胁迫 16~24 d 时,I-1-1-1、09-214、11-6的SS含量变化率无显著变化,其余种质材料均有显著变化。说明I-1-1-1、09-214的SS含量变化率在冷胁迫前期显著升高,但随冷胁迫时间的延长,SS含量变化率无显著变化,对长期冷胁迫的环境有一定的适应性;11-6在长期冷胁迫的环境下能够维持较稳定的抗寒性,对低温不敏感。
2.6 冷胁迫下6份披碱草属种质叶片的叶绿素含量变化率
Chl含量变化率越高,对低温的耐受能力越强;Chl含量变化率越低,对低温的耐受能力越弱(图6)。冷胁迫8 d时12-9-1的Chl含量变化率最高,抗寒性最强;I-1-5-66的Chl含量变化率最低,对低温的耐受能力最弱。冷胁迫16 d 时,09-214的Chl含量变化率最高,对低温的耐受能力最强;I-1-5-66、I-1-1-1的Chl含量变化率较低,对低温的耐受能力较弱,且二者差异不显著(P> 0.05)。冷胁迫24 d 时,11-6的Chl含量变化率最高,对低温的耐受能力最强;I-1-1-1的Chl含量变化率最低,对低温的耐受能力最弱。
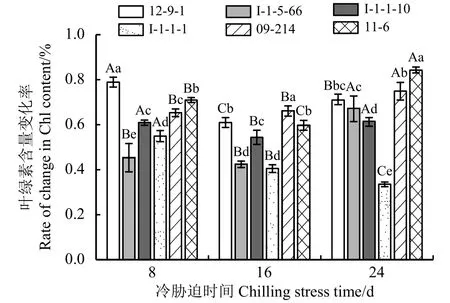
图6 冷胁迫下6份披碱草属种质的叶片叶绿素含量变化率Figure 6 The difference between the changing rate of the content of Chl for six Elymus germplasms under chilling stress
Chl含量变化率在冷胁迫8~16 d的过程中,除I-1-5-66、09-214无显著变化外 (P> 0.05),其他种质材料均呈现显著变化(P< 0.05);冷胁迫16~24 d的过程中,所有种质材料的Chl含量变化率均有显著差异。说明所有供试材料随着冷胁迫时间的延长,抗寒性出现显著变化。
2.7 冷胁迫下6份披碱草属种质叶片的超氧化物歧化酶活性变化率
SOD活性变化率越高,对低温的耐受能力越弱;SOD活性变化率越低,对低温的耐受能力越强(表2)。冷胁迫8 d时,I-1-1-10的SOD活性变化率最高,对低温的耐受能力最弱;09-214、11-6的SOD活性变化率较低,对低温的耐受能力较强,且二者差异不显著(P> 0.05)。冷胁迫16 d 时,I-1-1-1的SOD活性变化率最高,对低温的耐受能力最弱;09-214的SOD活性变化率最低,对低温的耐受能力最强。冷胁迫24 d 时,I-1-1-10的SOD活性变化率最高,对低温的耐受能力最弱;I-1-1-1的SOD活性变化率最低,对低温的耐受能力最强。

表2 冷胁迫下6份披碱草属种质超氧化物歧化酶活性的变化率Table 2 The difference between rate of change of SOD activity for the six Elymus germplasms under chilling stress%
SOD活性变化率在冷胁迫8~16 d的过程中除09-214变化不显著(P> 0.05)外,其余种子均出现显著变化(P< 0.05);16~24 d时除11-6变化不显著外,其余种质材料均表现出显著变化。
2.8 冷胁迫下6份披碱草属种质叶片的过氧化物酶活性变化率
CAT活性变化率越高,对低温的耐受能力越弱;CAT活性变化率越低,对低温的耐受能力越强 (表3)。冷胁迫 8 d时 12-9-1和 I-1-5-66的 CAT活性变化率较高,对低温的耐受能力较弱,且二者差异不显著(P> 0.05);I-1-1-10的CAT活性变化率最低,对低温的耐受能力最强。冷胁迫16 d 时,I-1-5-66的CAT活性变化率最高,对低温的耐受能力最弱;I-1-1-10的CAT活性变化率最低,对低温的耐受能力最强。冷胁迫24 d 时,I-1-5-66的CAT活性变化率最高,对低温的耐受能力最弱;12-9-1和11-6的CAT活性变化率最低,对低温的耐受能力最强。
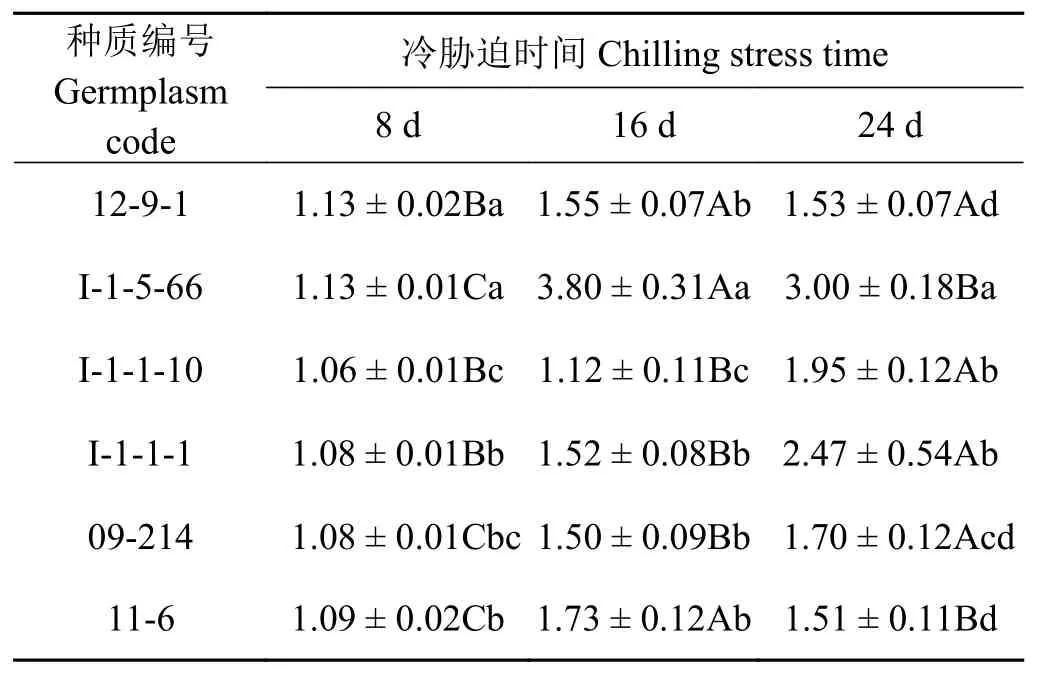
表3 冷胁迫下6份披碱草属种质叶片过氧化物酶活性的变化率Table 3 The difference between rate of change of CAT activity for the six Elymus germplasms under chilling stress%
CAT活性变化率在8~16 d时除I-1-1-10、I-1-1-1变化不显著外(P> 0.05),其余种质材料的变化均显著(P< 0.05);在16~24 d过程中,除12-9-1变化不显著外,其余种质材料的变化均显著。
2.9 6份披碱草属种质苗期抗寒性的综合评价
分别在冷胁迫8、16和24 d时对6份披碱草种质材料各指标变化率的均值进行隶属函数评价,以衡量其苗期抗寒性(表4)。结果表明,12-9-1、11-6、09-214对低温的抵抗能力较强,而I-1-1-10、I-1-5-66、I-1-1-1对低温的抵抗能力较弱。
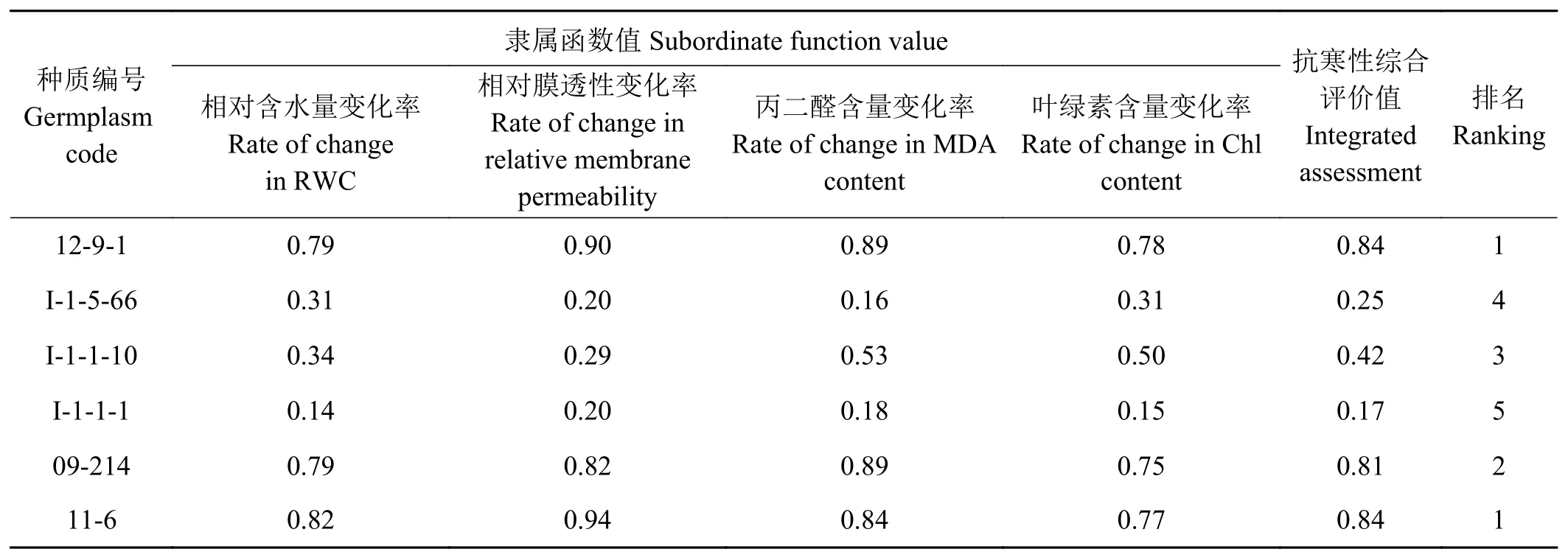
表4 6份披碱草属种质苗期抗寒性隶属函数值评价Table 4 Evaluation of membership function values of six Elymus germplasms at seeding stage of chilling resistance
3 讨论
RWC、相对质膜透性、MDA含量、Chl含量是鉴定植物在冷胁迫环境下的组织代谢活动和抗寒性的重要指标[17]。在本研究中,长期(24 d)冷胁迫环境下,12-9-1、09-214、11-6能维持较高的RWC变化率、相对质膜透性变化率、MDA含量变化率、Chl含量变化率,但I-1-5-66、I-1-1-10、I-1-1-1的RWC变化率、相对质膜透性变化率、MDA含量变化率、Chl含量变化率较低。说明处于高海拔地区(> 2 900 m)的 12-9-1、09-214、11-6 始终能够维持较强的抗寒性,低海拔地区(< 1 900 m)的I-1-5-66、I-1-1-10、I-1-1-1的抗寒性较弱。且冷胁迫8~16 d的过程中,12-9-1、09-214和11-6的相对质膜透性变化率和MDA含量变化率都显著下降,而其他种质材料下降不显著。植物可以通过降低相对质膜透性和MDA含量,降低对细胞膜的破坏程度,提高植物的抗寒性。12-9-1、09-214、11-6的细胞膜破坏程度显著降低,说明高海拔地区(> 2 900 m)的12-9-1、09-214和11-6对低温的适应能力较快。综上所述,高海拔的12-9-1、09-214和11-6表现出较强抗寒性和低温适应性,与付娟娟等[6]的研究结果相同。
细胞膜系统是感受冷胁迫最敏感的部位[18],相对质膜透性和丙二醛含量作为直接衡量细胞膜破损程度的两个指标,在短期冷胁迫(8 d)下,所有供试材料的相对质膜透性和丙二醛含量在短期冷胁迫后迅速增加,为对照的2~4倍;相对含水量变化率为对照的0.7~0.95倍,表明供试种质材料在冷胁迫下细胞的保水能力下降,且12-9-1、09-214和11-6的保水能力高于I-1-5-66、I-1-1-10和I-1-1-1;冷胁迫8 d后,叶绿素含量为对照的0.4~0.8倍。有研究表明,叶绿素含量是随低温胁迫的加剧而呈现下降趋势的[19],但也有研究表明[20]随低温胁迫的加剧叶绿素含量呈上升趋势。原因是前者在试验过程中并不是逐步降低温度,可能导致叶绿素的破坏,与本研究的结果相似;后者是逐步降低温度且各处理仅有8 h,仅是模拟了一个低温胁迫环境,短期的低温胁迫无法使叶绿素部分光合机构失活,叶绿素的破坏需要一个长期的过程。
许多研究主张采用Pro含量和SOD、POD、CAT活性评价植物的胁迫抗性。本研究发现,Pro含量、SS含量、SOD活性和CAT活性的变化率与抗寒性的关系复杂,不宜作为隶属函数的评价指标。
有研究表明:Pro含量变化的原因无法确定,也许是由于蛋白质合成受阻或蛋白质降解[21],且植物体内Pro和可溶性蛋白质的含量并非简单的互相消长的关系[20];也许是由于其本身合成受激或氧化受阻[22]。且Pro含量的变化与冷胁迫的程度和时间也有关系,当超过植物自身渗透调节能力极限时,植物的渗透调节就会失效。在无严重冷害时,Pro的积累则是一种适应性反应[20]。同样作为渗透调节物质的SS与Pro具有相似性[23]。
另外,SOD作为保护酶体系中的关键酶,也是第一活性氧自由基造成的氧化损伤的第一道防线,与自由基反应生成H2O2,而CAT则是专一清除H2O2的酶[24]。过去的诸多研究对SOD和CAT活性与植物抗寒性的关系结果不一,既有研究表明二者活性越高抗寒性越强[8],也有研究表明其活性越高抗寒性越弱[20]。且在不同温度下SOD活性的变化规律也不同,SOD活性随温度降低而逐渐增高,但在到达临界温度时迅速下降,不同材料的临界温度不同[25]。有研究表明[26],植物遭受冷胁迫时,酶促反应受到膜系统破坏的影响,造成反应的顺序和方向性错误。
综上所述,不宜直接采用Pro、SS含量变化率及SOD、CAT活性的变化率的隶属函数值进行抗寒性评价,具体冷胁迫下它们的响应机制还需进一步研究讨论。本研究隶属函数评价结果表明,Pro、SS含量变化率及SOD、CAT活性变化率越小其抗寒能力越强,这与夏铁骑[27]的研究结果相同。
4 小结
高海拔地区(> 2 900 m)的12-9-1、09-214、11-6通过保持冷胁迫下低的相对质膜透性和高的渗透调节能力以维持细胞内水分和叶绿素含量,表现出更强的对寒冷的抵抗能力,其抗寒性强于低海拔 (< 1 900 m)对寒冷较敏感的 I-1-5-66、I-1-1-10、I-1-1-1。在长期低温胁迫过程中,虽然所有供试材料都表现出对低温的适应能力,但高海拔地区的12-9-1、09-214、11-6对低温的适应能力较强。
