仿生可降解PCL-PLGA纤维支架负载人脐带间充质干细胞构建组织工程纤维环
2019-07-17夏金健徐宝山马信龙张杨郭悦杨阳张维昊杜立龙邵鹏飞何冠宇
夏金健,徐宝山,马信龙,张杨,郭悦,杨阳,张维昊,杜立龙,邵鹏飞,何冠宇
腰痛是全球范围的常见疾病,症状重者可导致活动受限甚至残疾,引起巨额的医疗花费和严重的社会负担[1]。椎间盘退变导致的纤维环破裂和髓核突出是引起腰痛的主要原因。症状重者往往需要手术治疗,虽可改善症状,但存在手术并发症且术后长期效果不佳[2]。其主要原因是破裂缺损的纤维环会引起椎间盘退变加速,甚至复发[3]。因此修复破裂缺损的纤维环至关重要。
组织工程技术为纤维环的再生修复提供了重要方法。理想的组织工程纤维环支架需具有良好的生物相容性、可降解性和力学性能,并且模拟天然纤维环的微观结构[4]。为此,本研究采用熔融纺丝技术,以聚己内酯(PCL)和聚乳酸聚乙醇酸共聚物(PLGA)混合物作为原料,旨在构建一种具有生物相容性、适宜降解且具有良好力学性能的组织工程支架,并探讨其作为组织工程纤维环的可行性。
1 材料与方法
1.1 主要材料 (1)组织来源。经在天津医院妇产科行剖宫产手术的产妇同意,获取新鲜无污染的人脐带,用于原代脐带沃顿胶间充质干细胞(HWJ-MSCs)的取材。(2)主要试剂、仪器。PCL(Sigma,美国);PLGA(济南岱罡生物有限公司,质量比PLLA∶PGA=50∶50);FBS、高糖DMEM 培养液(GIBCO,美国);二甲基甲酰胺(化学纯,天津康科德科技有限公司);4%多聚甲醛固定液(化学纯,上海嘉辰化工有限公司);Live/dead 染色试剂(Abcam,英国);CCK-8 细胞检测试剂盒(DOJIND0,日本);恒温培养箱(Hera-cell,德国);数显电动搅拌器(上海精学科学仪器有限公司);CL-2 型恒温加热磁力搅拌器(河南予华仪器有限公司);电加热熔融纺丝机(南开大学分子生物研究所,天津);Leica 体式显微镜(Leica 公司,德国);扫描电子显微镜(SEM,Hitachi,日本);力学加载装置(天津理工大学机械工程学院,天津);共聚焦荧光显微镜(Olympus,日本);酶标仪(PerkinElmer,美国)。
1.2 混合材料制备 本实验以比例为65∶35 的PCL-PLGA混合材料支架为实验组;以纯PCL 支架作为对照组。将2种材料经恒温加热并搅拌,随后将混合充分的材料收集备用,见图1。
1.3 支架制备 制作支架参考Kelnar的方法[5],使用电加热熔融纺丝机制备纤维支架管,制作参数及过程见图2。最终得到直径5 mm的纺丝管膜。将成品支架称质量记为Wa,然后浸泡在二甲基甲酰胺溶液中使PLGA 充分溶解后,清洗干燥至恒重时再次称质量,记为Wb,得出各组支架的实际PCL组成比例,即为Wa/Wb×100%,每组选取5个支架分别重复测量5次取均值。
1.4 支架基本性能评估
1.4.1 孔径、纤维直径、孔隙率 截取5 mm 长的成品支架,经体式显微镜拍照记录后固定在样品台上,经喷金后放入扫描电镜下拍照观察。每组支架选取5张电镜照片,每张照片随机选取不同的3 个位置测量支架直径纤维(μm)、孔径(μm)。参考Hoyer等[6]的方法,将样品置入盛有乙醇的量筒中,根据置入前后乙醇体积变化经计算测得支架孔隙率。每组支架重复测量5次取均值。
1.4.2 力学性能检测 测定过横截圆环面积的支架两端固定在力学加载装置中,分别反复压缩(V1=1 mm/min)或拉伸(V2=10 mm/min),获得压缩或拉伸“力-形变量”的曲线,根据支架形变量和受力面积计算出压缩弹性模量与拉伸弹性模量。每组支架重复测量5次取平均值。
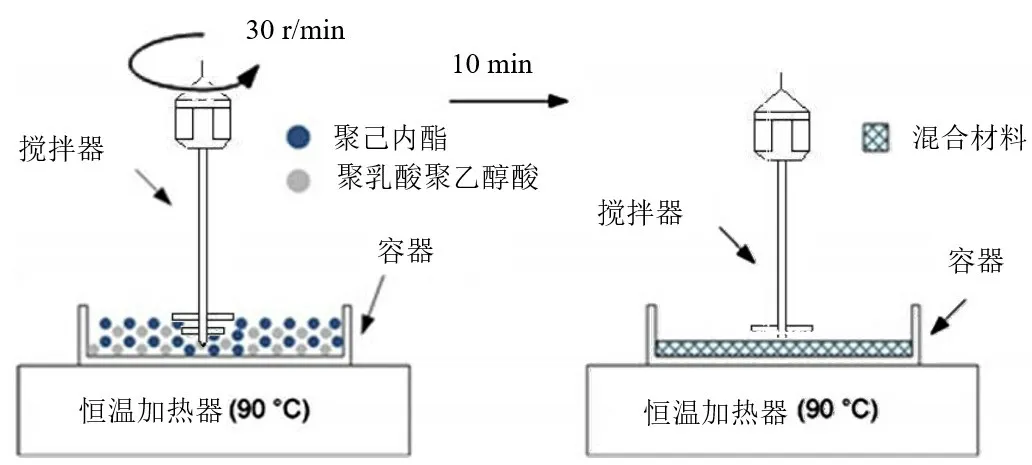
Fig.1 Preparation process of mixed materials图1 混合材料制备流程

Fig.2 Melt spinning and parameters图2 熔融纺丝过程及参数
1.4.3 体外降解 每组(n=25)支架分别称质量,记为W1。参考 Pan 等[7]的方法,将每个样本分别置于一个 15 mL 无菌无酶离心管内,每个离心管加入10 mL 1×PBS(pH=7.4),并加入叠氮化钠(W/W=0.1%)、盘尼西林(100 U/mL)和链霉素(100 U/mL),37 ℃恒温震荡。每组分别从第4 周开始每隔4周取出5 个支架,经冲洗后烘干至恒重后称质量,记为W2。计算体外质量剩余率 A=(W1-W2)/W1×100%,并取平均值。随后在体式显微镜和扫描电子显微镜下观察其结构变化。
1.5 细胞实验
1.5.1 分离培养人脐带沃顿胶间充质干细胞 参考Balasubramanian 等[8]的方法提取 HWJ-MSCs。大致步骤如下:将脐带去掉脐动脉、脐静脉和脐带外膜,只留下脐带沃顿胶。将沃顿胶剪成2 mm3小块放入小瓶中,加入0.2%Ⅰ型胶原酶并加入Hanks溶液稀释混匀。4 ℃消化过夜后将装有沃顿胶和消化液的小瓶放置于37 ℃摇床200 r/min 震荡2 h 充分消化。将溶液通过200目无菌钢网过滤后放入无菌离心管中,1 300 r/min 离心7 min。离心后弃一半上清液,再次加入Hanks 溶液1 300 r/min 离心7 min,得到的沉淀即为原代细胞。将细胞移入T25培养瓶中并加入含1%青霉素和链霉素及20%FBS 的高糖DMEM 培养液,置于37 ℃、5%CO2的恒温培养箱中孵育,隔天换液。待细胞生长融合80%~90%密度时进行传代,P3代细胞被用于本实验研究。
1.5.2 组织工程纤维环体外构建 将支架切成2 mm厚的圆环薄片,灭菌后在孔板中经含血清培养液浸泡过夜后,吸干培养液,将消化好的 P3 代 HWJ-MSCs 以 2×106/mL 的密度接种在支架上。孵育2 h后,向每个孔中加入200 μL培养液,再次放入37 ℃恒温培养箱中孵育,隔天换液。
1.5.3 材料细胞生物相容性检测 分别在负载细胞后的第1、5天取出细胞支架复合体,经无菌PBS清洗和4%多聚甲醛固定30 min后加入细胞Live/dead染色工作液,37 ℃恒温培养箱避光孵育20 min,然后再用无菌PBS清洗。随后将支架取出放置于共聚焦皿中,使用共聚焦荧光显微镜观察细胞存活情况。
1.5.4 材料毒性检测 细胞支架复合体培养1、3、5、7 d时分别加入20 μL CCK-8工作液,随后置于37 ℃恒温箱孵育3 h。最后避光使用酶标仪检测4 个时间点样品在450 nm 波长处的光密度(OD)值。
1.6 统计学方法 本实验数据均使用SPSS 19.0软件进行统计分析,计量数据分析结果均以均数±标准差(±s)表示,采用独立样本t检验比较实验组和对照组之间的差异性,采用单因素方差分析比较组内不同时间点差异性。P<0.05为差异有统计学意义。
2 结果
2.1 支架形态结构及性能特征
2.1.1 支架材料比例验证 经检测,实验组支架PCL 的质量占比均与制料时一致。PLGA 溶解后的实验组支架在体视显微镜下仍表现出规则的纤维走向及规则的孔隙形状,可见PCL 和PLGA 两种材料混合充分,且几乎没有任何材料损失,而对照组支架PLGA 溶解前后在大体观察及体式显微镜下观察时未见明显差异,见图3A、B。

Fig.3 Pictures before and after SDS immersion of each group of scaffolds图3 各组支架PLGA溶解前后图片
2.1.2 支架观察 大体下可见2组环形熔融纺丝支架整体形状规则,由PCL纤维均匀环绕而成;体视显微镜镜下可见2组支架各层纤维呈平行斜交的规则走向,见图3A。扫描电镜图片可见丝与丝交错形成大量菱形孔隙,各孔隙成角接近60°,且各孔空间叠加较紧密,见图4。实验组和对照组支架的纤维直径(μm:50.914±1.367vs.49.674±1.193,n=5,t=1.528,P=0.165)、孔径(μm:70.288±1.157vs.71.524±1.128,n=5,t=1.710,P=0.126)、孔隙率(72.344%±0.805%vs.73.148%±0.766%,n=5,t=1.618,P=0.144)差异均无统计学意义(P>0.05)。
2.1.3 力学性能测试 实验组支架的压缩弹性模量(MPa:1.415±0.110vs.2.365±0.193,n=5,t=9.825,P<0.001)和拉伸弹性模量(MPa:5.467±0.231vs.8.956±0.220,n=5,t=24.470,P<0.001)均较对照组下降,见图5。

Fig.4 SEM figure of scaffolds(×1 000)图4 支架扫描电镜图(×1 000)
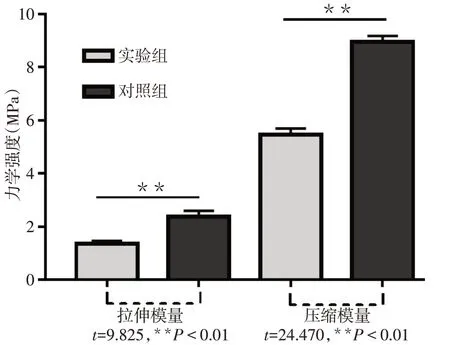
Fig.5 Comparison of mechanical parameters between the two groups图5 2组支架的力学参数比较
2.1.4 体外降解结果 体视显微镜照片显示,实验组支架在体外模拟环境中出现了纤维折断、粉碎的情况,表现出降解趋势,20周时混合支架破碎,完整性被破坏,见图6A~C;通过SEM 可以更直观地观察到,4 周时实验组支架纤维横截面表现出一定程度的裂缝,见图6G。而且随着时间的延长,在第12 周时实验组纤维可见许多更细小的纤维从中剥离的趋势,见图6H;第20 周时出现了支架碎裂,完整性缺失的情况,见图6I。而对照组PCL 支架纤维在3 个时间点的SEM中未观察到明显变化,见图6J~L。实验组质量剩余率随着时间的延长而降低,在各个时间点差异有统计学意义(P<0.01)。对照组各个时间点的称质量结果之间差异无统计学意义(P>0.05)。在每个时间点上,实验组和对照组质量剩余率差异均有统计学意义(P<0.01)。见表1。

Fig.6 Microscopy and SEM images of the degradation process of the two groups of scaffolds in vitro图6 2组支架体外降解过程的体式及SEM图片
2.2 支架干细胞复合体构建
2.2.1 干细胞提取扩增 提取干细胞经传代培养后,生长状态表现为典型的干细胞的长梭条状,细胞近核部较为饱满,头端和尾端较细长。显微镜下P3代人脐带间充质干细胞传代后第3 天的状态,可清楚地观察到干细胞形态,见图7。
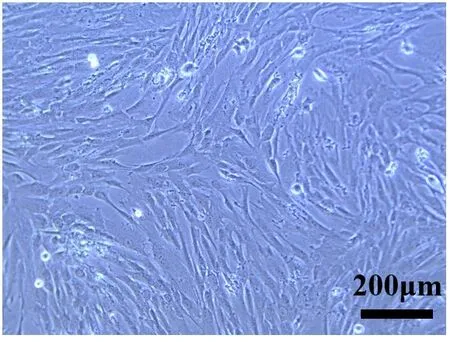
Fig.7 The morphology of the extracted stem cells under a microscope(×200)图7 提取干细胞显微镜下形态观察(×200)
2.2.2 Live/dead 染色 支架接种细胞后,每天可观察到培养液pH 值变化明显。细胞Live/dead 染色的结果显示,各组支架上细胞存活(绿色荧光)良好,第1天2组支架均有少量活细胞存在于观察视野中,见图8A、C。但第5 天可观察到实验组支架上活细胞数量明显较对照组支架多,见图8B、D。上述2个时间点各组支架均未观察到死细胞(红色荧光)。

Fig.8 Live/dead staining of scaffold-loaded cells(×200)图8 各组支架负载细胞的Live/dead染色(×200)
2.2.3 支架细胞毒性检测 结果显示,各组OD值均有随时间的延长而增加的趋势,但实验组总体涨幅明显高于对照组,培养的第1天,各组支架的培养液OD值差异无统计学意义(P>0.05);从第3天开始实验组高于对照组,且随着时间的延长,2组间差异逐渐增加,第 7 天时 2 组间差异明显(P<0.01)。见表2。
3 讨论
3.1 纤维环组织工程支架的仿生结构 近年来,纤维环组织工程成为纤维环修复领域的研究热点。目前国内外专家研究的生物支架制备技术种类很多,包括静电纺丝、冷冻干燥技术、湿纺、3D 打印等技术。Nerurkar等[9]曾利用静电纺丝制作出斜向60°交叉层叠的PCL纤维膜支架来模仿纤维环结构;Alvim Valente 等[10]曾使用冷冻干燥技术制作了 PCL 和PLGA的混合支架;本课题组采用湿法纺丝技术模拟天然纤维环结构,制备出PCL 三维圆周取向的微米纤维支架[11];也有研究者以丝素蛋白为原料,采用定向结晶技术构建出微孔结构支架[12]。但通过这些方法得到的支架取向性较差,达不到人体纤维环60°规则排列的结构模式,而且孔径规格大小并不统一,不利于细胞贴壁生长。熔融纺丝又称熔体纺丝,是一种以聚合物为原料,通过将原料加热并从喷丝孔中挤出,经空气冷却固定成粗细均匀的纤维丝的技术。Brown 等[13]应用熔融纺丝的方法成功制作出纤维成角、孔径和空隙率均一的PCL 管状支架。本实验以熔融纺丝为方法构建出的纤维环组织工程支架,其取向性模拟了人体纤维环60°成角的特征。电镜下可见支架纤维表面光滑且排列规则,因而孔隙的形状及分布高度规则;经检测其较大的孔隙率、孔径和规则的孔隙也将为细胞吸附和增殖提供适宜的场地条件。
Tab.1 Comparison of the remaining ratios of degradation at different time points between two groups表1 各时间点实验组和对照组体外降解质量剩余率比较 (n=5,%,±s)

Tab.1 Comparison of the remaining ratios of degradation at different time points between two groups表1 各时间点实验组和对照组体外降解质量剩余率比较 (n=5,%,±s)
**P<0.01
时间对照组实验组t 4周99.11±0.57 94.15±0.83 11.710**8周98.96±0.55 82.56±0.55 38.113**10周98.80±0.64 78.41±0.88 46.118**12周98.90±0.47 62.90±0.84 86.332**16周98.70±0.55 49.17±0.54 20 125.486**F 0.399 2 811.616**
Tab.2 CCK-8 assay for cell proliferation in experimental and control groups at various time points表2 CCK-8法检测实验组和对照组各时间点细胞增殖情况 (n=5,OD值,±s)

Tab.2 CCK-8 assay for cell proliferation in experimental and control groups at various time points表2 CCK-8法检测实验组和对照组各时间点细胞增殖情况 (n=5,OD值,±s)
*P<0.05,**P<0.01
组别对照组实验组t第1天0.24±0.01 0.25±0.01 1.472第3天0.37±0.03 0.45±0.04 3.616*第5天0.56±0.07 0.88±0.04 7.135**第7天1.08±0.11 1.60±0.05 8.905**F 117.084**1 002.127**
3.2 纤维环组织工程支架的生物降解性和力学性能 PLGA 和PCL 作为经美国食品药品监督管理局(FDA)批准可用于临床的高分子材料,其安全性是毋庸置疑的。PCL 拥有良好的力学性能,但降解周期较长;PLGA 具有较好的降解活性,但因其质地较脆而导致力学性能差强人意[14]。Kelnar 等[5]将PCL与PLGA 混合在一起,结果表明材料混合可以有效控制降解速度,同时混合材料的生物相容性较纯PLGA 并没有明显下降。本研究降解实验显示在PCL 中掺入PLGA 后,其降解性有明显改善,同时力学结果显示实验组的弹性模量虽然较对照组有所下降,但仍在人体正常纤维环力学强度范围内。有动物实验证明破裂纤维环经修复后6个月时椎间盘的生物力学强度可恢复到正常水平的52.30%,术后12个月的生物力学强度恢复率可达91.79%[15]。本实验结果显示,实验组支架第3 个月时的体外质量剩余率接近50%,其降解速率与已知的椎间盘自我修复过程基本相适应。在降解检测过程中,实验组支架在20周时出现支架纤维破碎、结构完整性丢失的情况。我们考虑这一方面是由于体外降解过程一直在震荡条件下完成的,因而支架会受到外界额外的力学影响;另一方面,我们只模拟了体内的液体环境而忽略了体内的生物因素,当支架植入体内后,体内组织细胞填充到支架孔隙中,产生额外的支撑作用。
3.3 纤维环组织工程支架对种子细胞生物相容性的影响 Cui等[16]通过细胞Live/dead染色和MTT检测验证了PLGA 对细胞的生物相容性优于PCL。Ouyang 等[17]经体外实验证实了骨髓间充质干细胞(BMSCs)在PLGA 材料上的增殖能力远高于PCL。本研究通过细胞Live/dead 染色和CCK-8 细胞毒性检测结果证实人脐带间充质干细胞在混合支架上的5 d增殖速率明显快于PCL组。
综上所述,本研究首次以PCL-PLGA 混合材料为原料,通过熔融纺丝技术构建出既具有生物相容性、同时也具备适宜降解性以及良好力学性能的仿生纤维环组织工程支架。通过多种技术手段检测,我们认为PCL-PLGA 混合支架在力学强度、降解速率以及干细胞相容性等方面都有着优异的表现。本实验所有的检测均是基于环状外形的组织工程支架的基础上而实现的,接下来我们将进行体内实验和动物实验,并尝试截取部分圆环支架在小动物纤维环缺损模型上进行体内修复,以便进一步验证此种支架的修复潜力。但本研究仍有不足之处:首先,本实验选取的PLGA其构成比为50∶50,虽然此比例的PLGA具有良好的生物相容性,同时可以借助PCL提高其力学性能,但也应考察其他构成比的PLGA 与PCL结合后的性能。其次,PLGA材料在降解过程中会释放酸性物质的问题仍有待解决。
