红花蜂花粉多糖Ⅰ对H22-荷瘤小鼠的抑瘤作用
2019-07-16陈路燕褚珊珊左绍远
陈路燕,褚珊珊,左绍远
(大理大学 基础医学院,云南 大理 671000)
恶性肿瘤是严重危害人类健康的疾病。在我国肝癌是常见的恶性肿瘤之一,其发病率、死亡率均高于世界平均水平。目前临床上主要采取手术、化疗、放疗等方法治疗,但毒副作用较大,尚未取得较满意的疗效。因此,积极寻找高效、低毒的抗肝癌药物成为当前医药学界面临的一项重要任务。红花即菊科植物红花(CarthamustinctoriusL.),为一年生草本植物,是一种传统中药。味辛、性温,具有活血通经、祛瘀止痛、软坚散结等功效[1-2]。蜂花粉(bee pollen) 系蜜蜂从蜜源植物雄性花蕊内采集的花粉粒,经蜜蜂加工而成的扁圆形状物,具有多种生物活性和药理作用[3]。多糖是通过糖苷键将10 个以上的单糖连接形成的一类结构复杂的生物大分子物质,具有多种生物活性和药理作用[4]。多糖可提高机体的免疫功能,不仅能够促进巨噬细胞以及T淋巴细胞免疫水平,而且能促进干扰素、白介素、肿瘤坏死因子等细胞因子的产生,从而增强了抑瘤和抗癌作用。多糖是蜂花粉的主要活性成分之一,研究表明,不同来源的蜂花粉多糖具有增强机体免疫力、抗肿瘤、抗病毒、抗氧化等多种生物学活性[5]。在前期研究中,我们利用水提醇方法分离提取出红花蜂花粉总多糖(polysaccharide of bee pollen of carthamus tinctorius, 2PBPC),并利用DEAE-52纤维素柱和SehpadexG100柱两种柱层析法从PBPC中分离纯化出5个均一的多糖级分(PBPCⅠ、PBPCⅡ、PBPCⅢ、PBPCⅣ,PBPCⅤ)[6]。前期研究表明,PBPC具有提高机体免疫力、抗氧化、抗凝血等活性[7,8]。为进一步探索PBPC的生物学活性,本实验观察了PBPCⅠ对H22荷瘤BALB/c小鼠的抑瘤作用及其作用机制,以期为进一步深入研究PBPCⅠ的抗肿瘤活性及药理学作用提供参考。
1 材料与仪器
1.1 实验动物
雌性BALB/c 雌性小鼠60只,SPF级,体质量16~20 g,由湖南斯莱克景达实验动物有限公司提供,动物许可证号:SCXK(湘)2016-0002。
1.2 样品、试剂及主要仪器
红花蜂花粉,云南滇峰蜂业有限责任公司产品,批号:20140712;木瓜蛋白酶、透析袋,北京索莱宝科技有限公司;DEAE-52cellulose,北京科技有限公司;H22肝癌细胞株,上海泽叶生物科技有限公司;IL-1α、IL-6、IFN-γ、TNF-α、IL-2、VEGF、ELISA试剂盒,伊莱瑞特生物科技股份有限公司;环磷酰胺(CTX),江苏圣迪医药有限公司(批号:18022825);SHA-C恒温水浴箱,金坛市杰瑞尔电气有限公司;AG135电子天平,瑞士梅特勒-托利多公司;RE-52A型旋转蒸发仪,上海亚东生化仪器厂;MB-53多功能酶标分析仪,深圳市惠松科技发展有限公司;超净台,苏州市金净净化设备科技有限公司。
1.3 方法
1.3.1 PBPCⅠ提取、分离纯化的工艺流程 红花蜂花粉→石油醚、无水乙醇回流→水浴,收集滤液→浓缩至一定体积→2%(W/W)酶, Sevage液(氯正比4∶1)脱蛋白→离心取上清液→醇沉→离心取沉淀→无水乙醇、丙酮、乙醚依次洗涤→冷凝干燥→DEAE-52纤维素柱分离组分→透析醇沉→PBPCⅠ组分→冷冻干燥后置干燥瓶中,-20℃保存备用[9-17]。
1.3.2 动物造模、分组及给药 BALB/c 雌性小鼠60只,随机分为六组:肿瘤模型组、正常对照组、CTX组以及PBPCⅠ低、中、高剂量组,每组10只,称取体质量。除正常对照组外,其余各组小鼠均在右前肢腋窝皮下注射细胞密度为1×107个/mL 0.2 mL的H22肝癌细胞,建立H22肝癌模型。接种24 h后,正常对照组、肿瘤模型组灌胃等量的生理盐水(0.1 mL/10 g),给药组分别灌胃PBPCⅠ100 mg/kg、200 mg/kg、400 mg/kg,CTX组皮下注射30 mg/kg,每天1次,连续给药15天。
1.3.3 PBPCⅠ对肿瘤抑制作用及对免疫器官指数的影响 末次给药后,小鼠禁食不禁水12 h,称体质量,脱颈处死,剥离瘤块,取出脾脏及胸腺,用滤纸吸净血液分别称质量。抑瘤率(%)=(1-实验组瘤质量/模型组瘤质量)×100%;免疫器官指数=免疫器官质量(mg)/体质量(g)。
1.3.4 PBPCⅠ对荷瘤小鼠血清细胞因子的影响 末次给药后,各组禁食不禁水12 h,眼球取血,收集血液,静置30 min,离心,取上清,ELISA法测血清中IL-1α、IL-6、IFN-γ、TNF-α、IL-2 、VEGF含量,操作步骤按照说明书进行。
1.4 统计学处理

2 结果
2.1 PBPCⅠ对H22荷瘤小鼠肿瘤生长的影响
图1表明,除正常对照组外,给药15天后,不同组别有显著变化,与对照组相比,低、中、高、CTX组肿瘤存在不同明显差异,CTX组肿瘤较小,而低、中、高剂量组随着用药剂量的增加,肿瘤逐渐减小。

注:Low(100 mg/kg)、Middle(200 mg/kg)、High(400 mg/kg),CTX(30 mg/kg),control(正常对照组)
2.2 PBPCⅠ对肿瘤抑制作用及对免疫器官指数的影响
结果表明,给药前各组小鼠体质量无明显差异,而给药结束后各组小鼠质量发生明显变化。与荷瘤瘤模型组相比,PBPCⅠ低、中、高剂量组与CXT组小鼠体质量均明显增加。PBPCⅠ低、中、高剂量组与CTX组均能抑制H22肝癌肿瘤的生长,抑瘤率分别为33.48%、45.69%、57.86%、67.93%,表明不同浓度的PBPCⅠ均能抑制肿瘤的生长,但其抑瘤作用比CTX组弱。另外,与正常对照组相比, CTX组小鼠胸腺指数降低(P<0.01),而模型组、PBPCⅠ低、中、高剂量组小鼠的脾指数和胸腺指数则不同程度升高(P<0.01);与模型组相比,不同剂量的PBPCⅠ组小鼠的脾指数和胸腺指数升高,而CTX组小鼠脾指数与胸腺指数降低。结果见表1、表2。


组别剂量(mg/kg)体质量(g)实验前实验后瘤质量(g)抑瘤率(%)正常对照组-17.87±0.6423.88±1.53--模型组-18.56±1.0431.43±0.781.54±0.19-CTX组3017.12±0.7525.53±1.35**0.50±0.03**67.93PBPCⅠ低剂量组10018.91±0.4327.67±1.39**1.02±0.11**33.48PBPCⅠ中剂量组20017.41±0.3328.14±1.54**0.84±0.04**45.69PBPCⅠ高剂量组40018.03±1.4029.27±0.14*0.65±0.04**57.86
注:与模型组比,*P<0.05,**P<0.01。

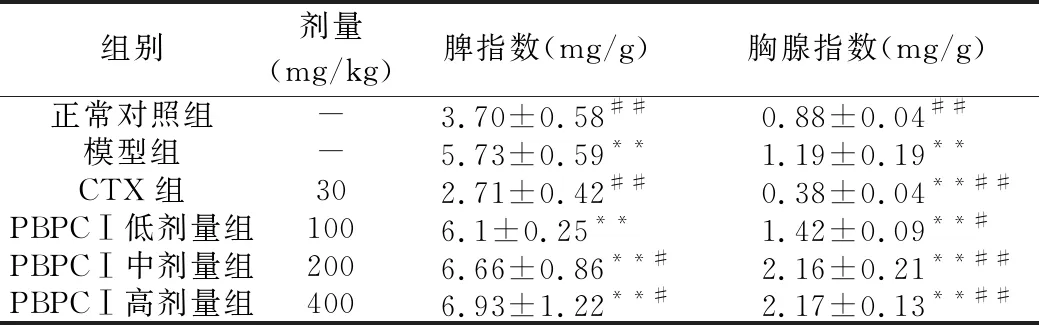
组别剂量(mg/kg)脾指数(mg/g)胸腺指数(mg/g)正常对照组-3.70±0.58##0.88±0.04##模型组-5.73±0.59**1.19±0.19**CTX组302.71±0.42##0.38±0.04**##PBPCⅠ低剂量组1006.1±0.25**1.42±0.09**#PBPCⅠ中剂量组2006.66±0.86**#2.16±0.21**##PBPCⅠ高剂量组4006.93±1.22**#2.17±0.13**##
注:与正常对照组比较,*P<0.05,**P<0.01;与模型组比,#P<0.05,##P<0.01。
2.3 PBPCⅠ对荷瘤小鼠血清细胞因子的影响
与模型组相比,PBPCⅠ高剂量组、CTX组的IL-1α极显著降低(P<0.01),PBPCⅠ中剂量组显著降低(P<0.05);PBPCⅠ低、中、高剂量组、CTX组的IL-6极显著降低(P<0.01);PBPCⅠ低、中、高剂量组中的IFN-γ极显著升高(P<0.01)。同时,与模型组相比,PBPCⅠ中、高剂量组中的TNF-α不同程度升高,而中剂量组显著升高(P<0.05),高剂量组极显著升高(P<0.01);PBPCⅠ低、中、高剂量组中的IL-2不同程度升高,而低剂量组显著升高(P<0.05),中、高剂量组极显著升高(P<0.01);PBPCⅠ中、高剂量组,CTX组的VEGF不同程度降低,而CTX组与PBPCⅠ高剂量组极显著降低(P<0.01),PBPCⅠ中剂量组显著降低(P<0.05)。结果见表3、表4。

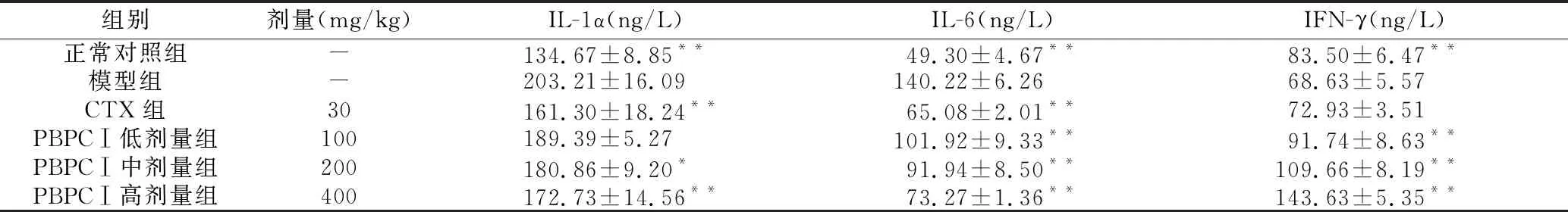
组别 剂量(mg/kg)IL-1α(ng/L)IL-6(ng/L)IFN-γ(ng/L)正常对照组-134.67±8.85**49.30±4.67**83.50±6.47**模型组-203.21±16.09140.22±6.2668.63±5.57CTX组30161.30±18.24**65.08±2.01**72.93±3.51PBPCⅠ低剂量组100189.39±5.27101.92±9.33**91.74±8.63**PBPCⅠ中剂量组200180.86±9.20*91.94±8.50**109.66±8.19**PBPCⅠ高剂量组400172.73±14.56**73.27±1.36**143.63±5.35**
注:与模型组比较,*P<0.05,**P<0.01。


组别剂量(mg/kg)TNF-α(ng/L)IL-2(ng/L)VEGF(ng/L)正常对照组-238.88±9.35*68.71±5.01*170.83±5.94**模型组-225.28±7.0958.31±2.48237.40±5.47CTX组30220.66±7.9451.18±5.84222.84±3.19**PBPCⅠ低剂量组100233.59±7.6268.47±6.56*233.40±3.36PBPCⅠ中剂量组200238.33±10.04*69.79±6.90**228.15±4.64*PBPCⅠ高剂量组400251.67±9.61**71.05±6.68**222.02±9.74**
注:与模型组比较,*P<0.05,**P<0.01。
2.4 PBPC I对H22荷瘤小鼠肿瘤组织病理学变化的影响
与模型组相比,随着PBPC Ⅰ剂量的升高,肿瘤组织越疏松,细胞减少,出现核浓缩、核碎裂、核分裂等凋亡特征,CTX组小鼠组织疏松,细胞显著减少,并且出现了相应的凋亡特征,说明PBPC Ⅰ具有促进肿瘤细胞凋亡的作用。见图2。
3 讨论
IL-2刺激T细胞增生,故被称为 T 细胞生长因子,诱导 NK 细胞分泌TNF-α、IFN-γ 等因子,高浓度的IL-2抑制肿瘤浸润淋巴细胞,增强免疫功能,从而抑制肿瘤生长[18]。IFN-γ能有效地抑制肿瘤新血管的形成,直接抑制肿瘤细胞的增殖,增加肿瘤坏死因子的表达以及表面抗体的相容性[19]。TNF-α可诱导细胞凋亡及肿瘤组织坏死,直接杀伤肿瘤细胞,从而达到抑制肿瘤细胞的增殖[20]。IL-6使肿瘤细胞发生上皮间质转化,增强NK细胞活性,抑制肿瘤细胞凋亡,促进肿瘤生成[21-22]。VEGF具有诱导血管生成,促进肿瘤生长,使血管内皮细胞增殖、分化,也能够增加微血管通透性,对肿瘤的生长具有重要作用[18]。IL-1α促进CD4T细胞活化以及激活NK细胞的活性,对肿瘤的发生发展具有重要意义[23]。
本实验结果表明,PBPCⅠ低、中、高剂量均具有明显的抑制H22肿瘤生长的作用,其抑制率分别为33.48%、45.69%、57.86%。与肿瘤模型组相比,PBPCⅠ低、中、高剂量组的脾指数和胸腺指明显升高,其作用优于CTX。同时PBPCⅠ还能升高荷瘤小鼠血清中IFN-γ、IL-2、TNF-α水平,降低血清IL-1α、IL-6、VEGF含量。由肝癌H&E染色发现PBPCⅠ具有促进肿瘤细胞凋亡的作用。实验结果提示,PBPCⅠ抑制肿瘤生长的作用机制可能是通过调节机体的免疫功能,释放杀伤肿瘤的细胞因子,从而抑制肿瘤生长。
