离子强度对可变电荷表面吸附性铜离子解吸的影响:可变电荷土壤*
2019-07-13邹献中谢卓文艾绍英
邹献中 陈 勇 谢卓文 艾绍英†
(1 广东省农业科学院农业资源与环境研究所,农业部南方植物营养与肥料重点实验室,广东省养分资源循环利用与耕地保育重点实验室,广州 510640)
(2 佛山市高明区农业技术服务推广中心,广东佛山 528500)
已有的研究表明,高岭石表面的吸附性铜离子,在去离子水中第一次解吸时,会出现重吸附现象,导致这一现象的原因是因为离子强度变化对可变电荷吸附表面的表面电位的影响[1]。众所周知,可变电荷土壤的黏土矿物主要是高岭石,同时还含有大量的具有可变电荷表面的氧化铁[2]。氧化铁和高岭石虽然都带可变电荷表面,但在某个特定的pH段,其电荷性质却截然不同,最为明显的是,高岭石的pH0相对较低,当pH大于3.6左右时,其可变电荷主要为负电荷,而氧化铁的pH0相对较高,因此在pH6以下,其可变电荷主要为正电荷[3]。于是在pH3.6~6.0之间时,其对吸附性铜离子的影响应该也是完全不同的。同时基于可变电荷土壤中高岭石和氧化铁的含量,包裹形式等方面的差异性,必然会导致在相同条件下,可变电荷土壤和高岭石的吸附性铜离子解吸规律,将既有相似之处,也有不同特征。在该研究中,我们以两种可变电荷土壤为代表,单一铜离子浓度条件下,利用去离子水和浓度由低到高的惰性电解质NaNO3对在去离子水和0.1 mol·L-1NaNO3中吸附的Cu(II)进行连续性提取,研究离子强度变化对可变电荷土壤中吸附性Cu(II) 在不同pH段解吸的影响,并将之与同等条件下高岭石的表现进行对比,以更好了解可变电荷表面对Cu(II) 的吸附-解吸机理。
1 材料与方法
1.1 供试材料
供试土壤为两种氧化铁含量迴异的我国南方的铁质砖红壤和红壤,分别采自云南昆明黑龙潭公园和江西进贤县红壤站,均为地表以下30~50 cm之间的亚表层土壤。铁质砖红壤和红壤的黏土矿物均以高岭石为主,并含有大量的氧化铁,均属可变电荷土壤[4]。土壤样品经风干和过60目筛之后,用电渗析法制成氢、铝质样品,其基本性质见表1。
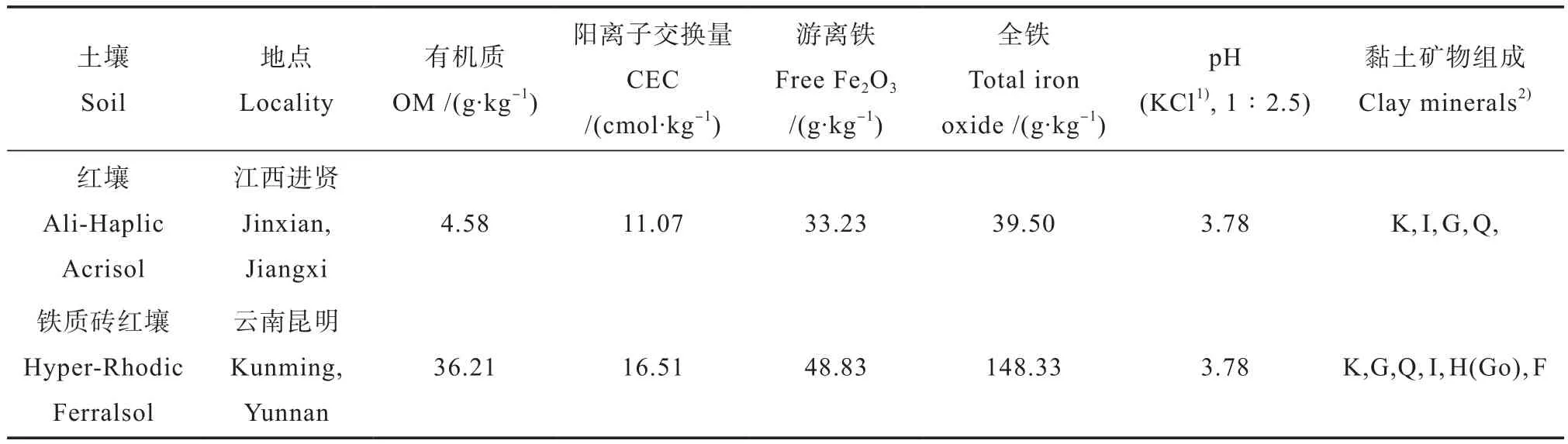
表1 供试土壤基本性质Table 1 Basic properties of soils tested
1.2 研究方法
铜离子吸附实验:称样品1.000 g 于已知重量的酸洗过的100 mL离心管中,加入已用不同体积0.01 mol·L-1NaOH或0.01 mol·L-1HNO3溶液调节过pH的去离子水18 mL,所加入酸碱量已经过预实验,以保证最终吸附实验完成时,平衡液pH范围在3.0~6.5之间,且样点分布间隔合适。使用包裹聚四氟乙烯的小磁铁搅拌子和小型搅拌仪充分混合悬液。放置平衡12 h后用微量加液器加入2 mL 0.01 mol·L-1Cu(NO3)2标准溶液,恒温振荡箱振荡4 h(25℃,220 r·min-1)。吸附平衡后,以3 200 g左右离心力离心4 min,倾出上清液,一部分用玻璃电极法测定pH,一部分用原子光谱吸收法(AAS)测定铜离子浓度。由吸附前后溶液中铜离子的浓度差计算吸附分值(被吸附铜离子数量占所加入铜离子数量的比值)。样品2次重复,吸附分值较低部分3次重复。
铜离子连续解吸实验:将上述含残渣的离心管称重,计算土样中残留液的体积(W2-W1),由残留液体积和Cu(II)浓度,计算残留量。加入已用适量0.01 mol·L-1NaOH或0.01 mol·L-1HNO3溶液调节过pH的去离子水,所加入解吸液的初始pH与将被解吸的样品上次吸附或解吸完成时的平衡液pH基本一致,且最终溶液体积为20 mL。其后实验过程同吸附实验。待该次解吸完成后,重复上述过程。其后用浓度由低到高的NaNO3溶液继续解吸,实验过程同上,直至该浓度NaNO3解吸液条件下,Cu(II) 最高解吸率低于10%为止,其后换用浓度高一级NaNO3溶液继续解吸,直至所用解吸液浓度为1 mol·L-1NaNO3为止。由平衡液体积和测定的Cu(II) 浓度计算出平衡液中Cu(II) 总量,减去解吸开始前的Cu(II) 残留量,得到该样次Cu(II) 解吸量和解吸分值(被解吸铜离子数量占被吸附铜离子数量的比值)。解吸液浓度和解吸次数依次分别为去离子水(3次)、0.01 cmol·L-1NaNO3(3次)、0.1 mol·L-1NaNO3(3次)和1 mol·L-1NaNO3(2次)。用下式计算Cu(II)的解吸分值K:
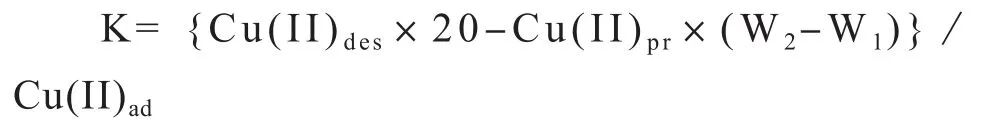
式中,Cu(II)des和Cu(II)pr分别为解吸液和上次吸附或解吸残留液中Cu(II)的浓度,mol·L-1,Cu(II)ad为吸附液中Cu(II)浓度,mol·L-1。
1.3 数据处理
数据处理采用Excel 2010,图中数据均为实测值,作图软件为SigmaPlot13.0。
2 结 果
2.1 pH对铜离子吸附的影响
图1为两种可变电荷土壤(红壤和铁质砖红壤)在去离子水和0.1 mol·L-1NaNO3溶液中被吸附铜离子的吸附分值随pH的变化曲线。与高岭石相似之处在于,首先,无论支持电解质浓度大小如何,吸附分值曲线也均可用Frischer方程拟合,S=1-exp(-(pH/pHe)a),其中a=b+c×pH[5]。拟合方程参数和相关性质见表2,拟合率同样可达到0.996以上,只是方程参数不同。其次,无论是在去离子水中或0.1 mol·L-1NaNO3溶液中吸附,也均在平衡液pH3.7左右出现拐点,似乎说明相比氧化铁,高岭石对可变电荷土壤铜离子的吸附曲线变化更具影响性。不同之处在于,红壤、铁质砖红壤对铜离子的吸附分数从不到0.1上升到将近1的pH范围缩减为3.0~5.5左右。相比红壤,相同pH条件下,惰性电解质浓度变化对铁质砖红壤铜离子吸附分值的影响要小很多,这可能与铁质砖红壤中远远大于红壤的氧化铁含量有关。
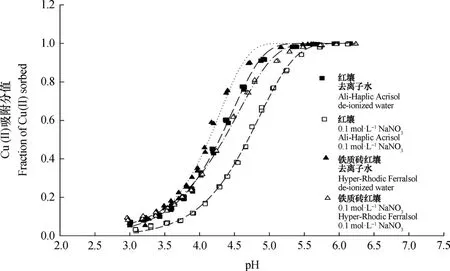
图1 pH对可变电荷土壤在去离子水中或0.1 mol·L-1 NaNO3溶液中吸附铜离子的影响Fig. 1 Effect of pH on the adsorption fraction of Cu(II) on variable charge soils in de-ionized water or a 0.1 mol·L-1 NaNO3 solution

表2 Frischer方程拟合参数Table 2 Parameters of the fitting function shown in Frischer Equation
2.2 吸附性铜离子在去离子水中的连续解吸
两种可变电荷土壤吸附铜离子后,在去离子水中解吸时,解吸分值随pH的变化情况如图2所示。实验结果表明,第一,无论吸附时溶液离子强度高或者低,当平衡液pH低于5.0左右时,大部分情况下,被吸附的铜离子均可在去离子水中解吸,解吸分值随pH的上升而单调下降,且在相同pH条件下,解吸分值随着解吸次数的增加而减少。第二,与高岭石相似的是,当吸附溶液为0.1 mol·L-1NaNO3时,同样出现了重吸附现象,这说明重吸附现象应该在可变电荷土壤中普遍存在。相比铁质砖红壤,红壤的重吸附现象更为明显。与高岭石最大区别在于:即使在去离子水中吸附,高岭石也会出现重吸附现象,但可变电荷土壤则没有,且与可变电荷土壤相比,高岭石的重吸附现象更为明显[1]。
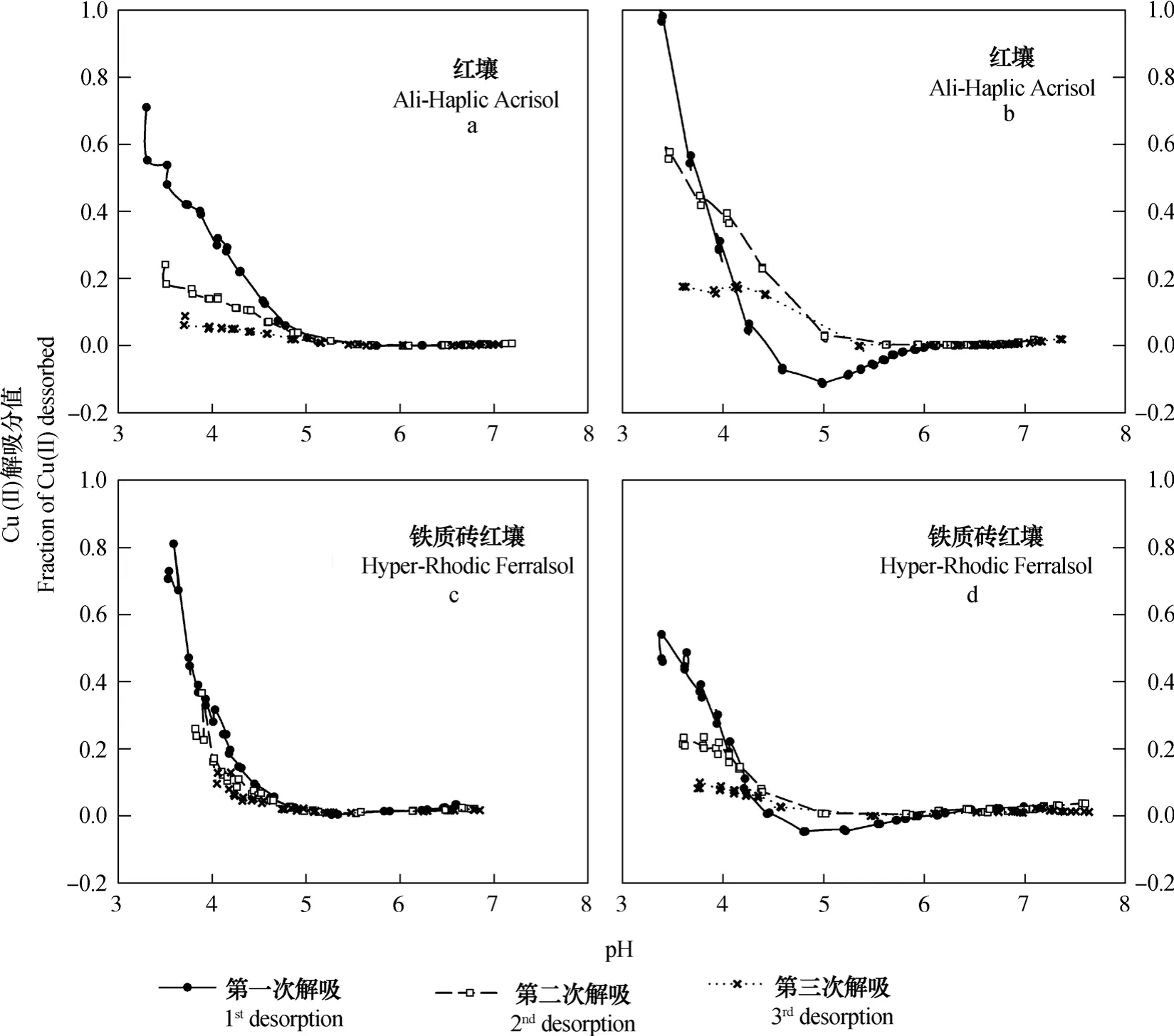
图2 去离子水中解吸时,铜离子解吸分值随平衡液pH升高的变化(a和c:去离子水中吸附;b和d:0.1 mol·L-1 NaNO3 溶液中吸附)(图c数据取自文献[4])Fig. 2 Variation of Cu(II) desorption in de-ionized water with rising pH (a & c: adsorbed in de-ionized water; b & d: adsorbed in 0.1 mol·L-1 NaNO3)(Data in c come from reference [4])
2.3 吸附性铜离子在NaNO3溶液中的连续解吸
去离子水和0.1 mol·L-1NaNO3溶液中吸附铜离子的样品,在去离子水中解吸三次完毕,再依次用浓度由低到高的NaNO3溶液进行解吸时,铜离子解吸分值随pH升高的变化分别如图3和图4所示。实验结果表明,两种可变电荷土壤的吸附性铜离子解吸分值随着平衡液pH上升的变化规律,与高岭石者既存在有诸多相似之处,也有不同之处,相似之处表现为,1)均出现解吸峰现象;2)在NaNO3浓度和pH相同条件下,铜离子解吸分值的大小也均随解吸次数的增加而下降;3)相比其他两种NaNO3解吸液浓度,0.1 mol·L-1NaNO3者的解吸分值最大;4)在解吸分值急剧增加之前,部分样品的解吸曲线都有一个相对比较平缓的上升过程;5)当用不同浓度NaNO3溶液进行解吸时,无论解吸次数,在大部分情况下,解吸曲线也均可出现解吸分值开始急剧增加的拐点,且各拐点所对应的pH吸附(pH特征)也基本一致,也同样均与体系pH变化的拐点基本一致(表3和表4)。不同之处表现为:在拐点pH之前,可变电荷土壤的解吸分值高于高岭石,以及总体而言,除了1 mol·L-1NaNO3外,相比高岭石,可变电荷土壤的解吸分值更低。但在1 mol·L-1NaNO3溶液中解吸时,可变电荷土壤者比高岭石者高。同时,相比红壤,铁质砖红壤者更低,这似乎意味着解吸分值随着氧化铁的含量增加而降低。值得一提是,虽然当吸附液离子强度相同时,不同解吸液条件下的pH特征均基本一致,但吸附液离子强度变化时,pH特征也同样发生变化,同时相同条件下的红壤和铁质砖红壤的pH特征也有细微差别。而且相比铁质砖红壤,红壤的pH特征更为明显。

图3 去离子水中吸附后,不同浓度NaNO3溶液中解吸时,铜离子解吸分值随平衡液pH升高的变化(a和d: 0.01 mol·L-1 NaNO3; b和e: 0.1 mol·L-1 NaNO3; c和f: 1 mol·L-1 NaNO3)(d-f数据取自文献[4])Fig. 3 Variation of desorption of Cu(II), pre-adsorbed in de-ionized water, with rising pH in NaNO3 solution, relative to concentration of NaNO3 (a&d: in solution 0.01 mol·L-1 in NaNO3; b&e: in solution 0.1 mol·L-1 in NaNO3; c&f: in solution 1 mol·L-1 in NaNO3) (Data in d - f come from reference [4])

图4 0.1 mol·L-1 NaNO3溶液中吸附后,不同浓度NaNO3溶液中解吸时,铜离子解吸分值随平衡液pH升高的变化(a和d: 0.01 mol·L-1 NaNO3; b和e: 0.1 mol·L-1 NaNO3; c和f: 1 mol·L-1 NaNO3)Fig. 4 Variation of desorption of Cu(II), pre-adsorbed in 0.1 mol·L-1 in NaNO3, with rising pH in NaNO3 solution relative to concentration of NaNO3 (a&d: in solution 0.01 mol·L-1 in NaNO3; b&e: in solution 0.1 mol·L-1 in NaNO3; c&f: in solution 1 mol·L-1 in NaNO3)

表3 铁质砖红壤各条件下拐点pH和对应pH吸附Table 3 pH of the turning point and corresponding pHad in the Hyper-Rhodic Ferralsol relative to condition
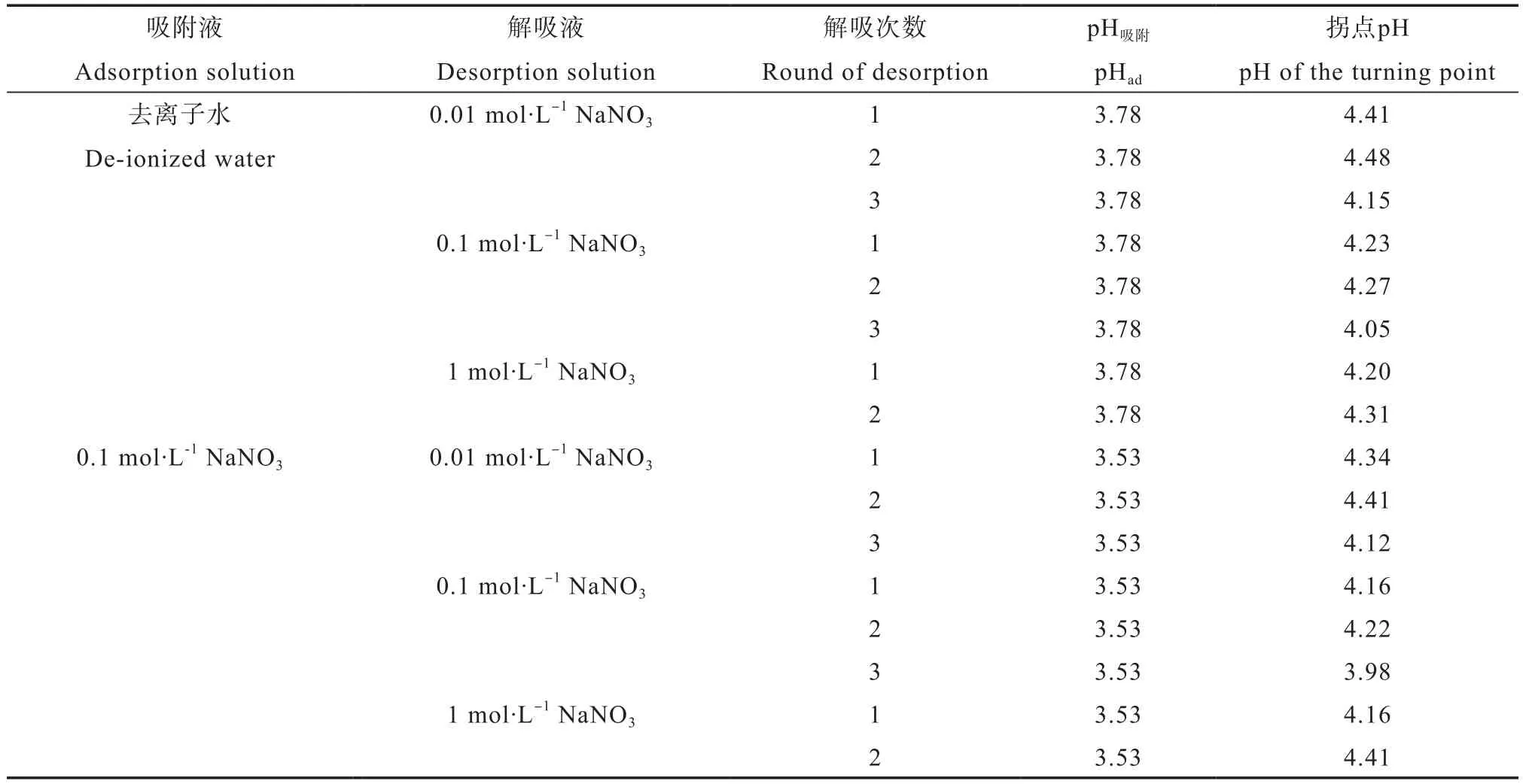
表4 红壤各条件下拐点pH和对应pH吸附Table 4 pH of the turning points and corresponding pHad in the Ali-Haplic Acrisol relative to condition
3 讨 论
红壤和铁质砖红壤均属于典型的可变电荷土壤,与纯粹的高岭石不同的是,它们中含有或多或少的氧化铁,且这些氧化铁并非只是与高岭石的单纯混合,而是覆盖在高岭石表面上。这就导致在相同实验条件下,可变电荷土壤和高岭石既有相似之处,也有相异的地方,就是两种氧化铁含量不同的可变电荷土壤之间,例如本文中所用红壤和铁质砖红壤,也不尽相同。
有关导致重吸附现象的原因,作者[1]认为,pH升高是可能原因之一,但因为在相类似条件下的可变电荷土壤(红壤和铁质砖红壤)并未出现重吸附现象,其ΔpH的变化也与在0.1 mol·L-1NaNO3溶液中吸附铜离子者相似。鉴于可变电荷土壤在去离子水中吸附的铜离子第一次在去离子水中解吸时,虽然ΔpH也出现了升高的现象[6],但并未出现重吸附现象,因此相比ΔpH的升高,离子强度变化更可能是导致重吸附现象的最主要和根本的原因。
高岭石和两种可变电荷土壤在去离子水中解吸时,解吸分值随pH的升高的变化规律稍有不同,这可能与可变电荷土壤中高含量的氧化物有关。由于在研究的pH范围内,氧化物表面基本为正电荷,所以不存在pH特征,当在去离子水中解吸时,其所吸附的铜离子在整个研究范围内均应表现为解吸。
对比同等条件下高岭石和两种可变电荷土壤的表现,可以发现,重吸附现象与氧化铁含量成负相关关系(同样是去离子水中吸附,第一次去离子水解吸时,高岭石者出现了重吸附现象,而可变电荷土壤则没有;相比红壤,铁质砖红壤重吸附现象更弱)。从重吸附现象产生的原因可以很好地解释其中原因,正如之前所言,在所研究的pH范围内,氧化铁表面基本为可变正电荷,因此当离子强度降低时,其对铜离子应表现为解吸,而非吸附。可以预料的是,如果某种因素导致土壤表面参与吸附反应的正电荷数量增加,或负电荷数量减少,则实验结果将导致解吸曲线发生变化,具体表现为在某段pH范围内,铁质砖红壤的解吸分值将整体增加。以本研究中的铁质砖红壤为例,其有机质含量远超过红壤。由于在本研究pH范围内,有机质表面主要为可变负电荷,因此,如果红壤和铁质砖红壤两者氧化铁含量基本一致,在相同条件下,铁质砖红壤的重吸附分值绝对值理应超过红壤,但事实却刚好相反,这似乎说明铁质砖红壤中氧化铁对重吸附绝对值的影响远超过有机质的影响。如果推断正确,将铁质砖红壤的有机质部分或基本去除时,将会出现上述重吸附绝对值减少,甚至可能出现相反的现象,即在整个pH段,铜离子解吸值应基本大于零。当然,这一推断的正确性有待进一步的研究和证实。
图2的结果还表明,红壤和铁质砖红壤在0.1 mol·L-1NaNO3溶液中吸附铜离子后,在去离子水中的第二次和第三次解吸时,重吸附现象消失,解吸率随pH升高的变化趋势与在去离子水中吸附者相似,解吸率降至为零时的平衡液pH也是5.1~5.3左右。这主要是因为第二次与第一次相比,溶液的离子强度差值已经很小,离子强度降低导致的表面电位绝对值的变化将较小,从而亲和力的变化也较小,且此时溶液中铜离子浓度也很低,因此无法出现可观察到的重吸附现象。
图3的结果表明,在去离子水或0.1 mol·L-1NaNO3溶液中吸附的铜离子,在基本去除可在去离子水中解吸的部分之后,剩余的吸附性铜离子,相当部分可被不同浓度NaNO3解吸。在整个所研究的pH范围内,其解吸分值大致在0~5.5×10-4mol·kg-1左右。按照传统的土壤化学原理,除非有较被交换离子吸附自由能更大的离子进行交换吸附,否则惰性电性吸附离子,如Na+能交换下来的阳离子的被吸附通常是因为电性吸附所引起[7]。因此这部分可被解吸的铜离子,应该属于由电性吸附作用导致的可交换态。由于体系pH均基本低于氧化物的pH0,因此在本研究中,由可变负电荷所导致的电性吸附基本由高岭石边面所引起,而由永久负电荷导致的电性吸附的存在与否基本与pH无关。从导致可变电荷土壤吸附铜离子的原因出发,这部分可交换态铜离子又可以分为由高岭石等黏土矿物的永久负电荷导致和由高岭石边面以及氧化物等的可变负电荷导致。事实上,如果我们仔细考虑离子强度对可变电荷表面的表面电位的影响原理[1,8-9],会发现离子强度对被吸附的可变电荷型和永久电荷型铜离子影响机制可能不完全相同。对于永久电荷型,离子强度的增加导致的交换性解吸主要是因为大量的电性吸附性离子,如钠离子,对被吸附铜离子的交换而导致。对于可变电荷型,由于离子强度的增加会导致表面电位绝对值的降低,从而导致对铜离子的吸附势的降低,这本身就会导致吸附性铜离子的解吸。
在有关高岭石的研究中,已经发现解吸分值开始急剧增加时对应的pH解吸在不同解吸条件下并不相同,但与其对应的pH吸附具有高度同一性[1]。这一现象同样存在于红壤和铁质砖红壤中,而且相比高岭石,更为明显。这表明,可变电荷土壤和高岭石中吸附性铜离子的pH特征可能具有专一性,即表征不同pH段铜离子吸附机理变化转折点的pH特征与pH解吸没有太大关系。从这个意义而言,传统的有关pH对可变电荷表面吸附铜离子的影响的认知仍然是不够全面的,可能还需进一步的研究和探索。鉴于pH对铜离子,乃至重金属离子吸附的重要性,这方面的研究具有重要意义和价值。
4 结 论
与高岭石相似,可变电荷土壤中吸附性铜离子在连续性解吸时,也会出现重吸附现象和解吸峰,但由于土壤中氧化铁的存在,导致这些现象相比高岭石为弱,这主要是因为氧化铁和高岭石在所研究的pH范围内,两者表面的可变电荷性质所决定的。对于重吸附现象,离子强度的变化是导致这一现象的最主要和根本的原因。
致 谢本文得到澳大利亚西澳大学N. J.Barrow教授的大力协助,特此表示感谢。
