土壤强还原处理对三七连作障碍因子及再植三七生长的影响*
2019-07-13李云龙王宝英常亚锋续勇波黄新琦张金波4蔡祖聪
李云龙 王宝英 常亚锋 续勇波 黄新琦,3,4 张金波,3,4蔡祖聪,3,4 赵 军,3,4†
(1 南京师范大学地理科学学院,南京 210023)
(2 云南农业大学烟草学院,昆明 650201)
(3 江苏省地理信息资源开发与利用协同创新中心,南京 210023)
(4 南京师范大学,江苏省物质循环与污染控制重点实验室,南京 210023)
三七[Panax notoginseng(Burk.)F. H.Chen],又名田七,为五加科人参属多年生草本植物,是我国特有的名贵中药材,具有活血化瘀、消肿定痛等功效[1]。三七市场需求量大,仅国内就有1300多家企业以三七为原料生产400多个药品,几乎涵盖了所有的中药制药企业[2]。因此,道地三七的可持续生产是保证我国中药产业稳定发展的关键之一。然而,三七既喜阴湿,又是宿根植物,极易被土壤中的病原菌侵染发病。其中根腐病是三七生长过程中最为严重的病害,致病因素复杂,主要是细菌和真菌混合致病,常年发病率为5%~20%,严重时可达70%[3]。尖孢镰刀菌(Fusarium oxysporum)和腐皮镰刀菌(Fusarium solani)是三七根腐病的主要致病菌,专性寄生,在无寄主植物存在时,其休眠孢子仍能在土壤中存活长达20年之久。此外,三七在生长过程中通过自然挥发、雨雾淋溶、根系分泌和植株分解等方式向环境中释放的化感物质是引起土壤微生物区系失衡,刺激病原菌快速生长,导致三七生长不良、发病和死亡的重要因素之一[4]。其中,皂苷类物质是三七主要的次生代谢产物,在植物根与病原菌的互作中扮演着重要的角色,被认为是导致三七连作障碍的主导因素[5]。
目前,科学上消减三七连作障碍的主要途径包括农业防治、化学防治和生物防治[6]。轮作和间作是缓解作物连作障碍较为有效的传统方法[7-8],但三七的忌地性极强,往往需要轮作10~30年才能再植,而且随着种植历史的延长,可种植三七的土地资源日益匮乏,因此轮作已无法满足道地三七可持续生产对土地资源的需求[6]。而土壤化学熏蒸剂是目前生产上应用最广泛的方法,但其作用单一,仅能够杀灭土传病原菌,不能改良土壤理化性状和消除化感物质[9],而且土壤中病原菌的数量在再植作物根系分泌物的诱导下会迅速回升[10],对多年生喜阴湿的宿根植物三七的连作障碍防控效果不佳。利用外源添加有益微生物来防控三七连作障碍的效果往往不稳定,这与添加的有益微生物能否适应土壤环境并存活下来发挥其作用有关[11]。综上所述,至目前为止,科学研究或农业生产上并没有有效消减三七连作障碍因子、实现三七可持续生产的综合农业措施。
土壤强还原处理(Reductive soil disinfestation,RSD)是一种作物种植前的土壤处理方法,其操作简单,处理时间短,不耽误农时,具有杀灭土传病原菌,改善土壤结构,重建土壤微生物区系的多重效应,从而能够有效缓解蔬菜和花卉的连作障碍现象[12-13]。本研究利用云南省文山苗乡三七科技有限公司搭建的“三七连作障碍PK试验平台”内的试验地,研究高碳氮比、低碳氮比和高、低碳氮比等质量混合有机物料RSD处理对连作三七土壤障碍因子尤其是化感物质和土传病原菌、微生物群落结构和多样性及三七存苗率和发病率的影响,并进一步探讨土壤中连作障碍因子消减程度与三七存苗率和发病率的关系,旨在寻求一种快速消减不同连作障碍因子的综合措施,以期为消减和克服三七连作障碍、实现道地三七可持续生产提供一定的理论依据和技术支持。
1 材料与方法
1.1 研究区概况
田间试验位于云南省文山苗乡三七科技有限公司的“三七连作障碍PK试验平台”(23°42′N,104°16′E),属亚热带气候,冬无严寒,夏无酷暑。年均气温15~17 ℃,降雨量为1 100~1 319 mm,全年无霜期356d。试验前该PK地已连续六年种植三七,自从第一次移栽一年七籽条并存活至收获(三年七)以后,此后每年移栽的一年七籽条均在当年全部发病死亡[14]。试验前0~20 cm土层的基本理化性质为pH 7.12,电导率 0.09 mS·cm-1,有机质和全氮的含量分别为10.52和0.36 g·kg-1。
1.2 试验设计
田间试验共设置四个处理:1)不做任何土壤处理的对照(CK);2)添加高碳氮比有机物料的RSD处理(TOC:442.4 g·kg-1,TN:4.66 g·kg-1,C/N 94,SB);3)添加低碳氮比有机物料的RSD处理(TOC:451.2 g·kg-1,TN:22.9 g·kg-1,C/N 19,BD);4)添加高、低碳氮比等质量混合有机物料的RSD处理(m/m=1∶1,SB+BD)。RSD处理的具体操作如下:在连作三七土壤表面均匀添加15 t·hm-2有机物料后通过旋根机将其与耕作层土壤混合均匀,灌溉至田间最大持水量并覆膜处理40 d,处理期间土壤温度为20~30 ℃。各处理包含两垄,分成三个生物学重复区。每垄面积30 m2(2 m × 15 m),各垄之间由40 cm深,20 cm宽的沟隔开。
1.3 土壤样品采集及预处理
待RSD处理结束后,揭开薄膜,采集土壤样品。各处理每个小区按“S”形采样路线随机选取10个采样点,采集0~20 cm的耕层土壤,混合均匀后去除杂物和细根,过2 mm筛。过筛后的新鲜土壤样品分成三份:一份风干后测定皂苷类化感物质;一份保存在4℃用于测定土壤微生物活性;一份保存在-80℃用于土壤基因组DNA的提取。
1.4 土壤皂苷类化感物质的测定
土壤中皂苷类化感物质的提取参照Ya n g等[15]的方法并作适当调整。称取50 g风干土样(100目)三份,分别置于1 L的三角瓶中,加入600 mL 100%甲醇(土/甲醇=1∶12,m/v)摇床过夜提取(30 ℃,220 r·min-1),然后超声提取2 h(35 ℃,45 KHz)后离心(3 000 r·min-1,3 min)并收集上清液,下层土壤再重复提取2次,离心后合并3次上清液,将所有上清液用旋转蒸发仪蒸发至干(30 ℃),称重后再用一定量的色谱甲醇溶解,0.22 μm有机系滤膜过滤后将滤液置于-20 ℃冰箱中保存备用。
称取三七皂苷R1、人参皂苷Rg1、Rb1、Rh1、Rb3、Rd(购于上海阿拉丁生化科技股份有限公司)各1 mg,加入一定量甲醇溶解配制成每1 mL分别含0.1 mg的标准溶液,所得标准溶液用0.45 μm有机系滤膜过滤后各吸取1 mL配制成混合标准溶液。土壤中皂苷类化感物质提取液按照上述方法提取。利用高效液相色谱(High Performance Liquid Chromatography, HPLC)Waters e2695 系统的PDA检测器对土壤中的皂苷进行测定,色谱柱为Waters C18(250 mm × 4.6 mm,5 μm),流动相由乙腈(A)和水(B)组成,0~30 min用18%A和82%B洗脱,30~35 min用30%A和70%B洗脱,35~55 min用35%A和65%B洗脱,55~77 min用18%A和82%B洗脱;流速1.5 mL·min-1;波长203 nm;柱温40 ℃;进样量30 μL。
1.5 土壤微生物活性的测定
土壤中微生物活性的测定参照A d a m和Duncan[16]的方法。称取过 2 mm 筛的鲜土 2 g,置于 50 mL 离心管中,分别加入 15 mL 磷酸缓冲液(60 mmol·L-1,pH 7.6)和 0.2 mL FDA 溶液(1 mg·mL-1),用封口膜封口,在30 ℃、100 r·min-1条件下反应 20 min,结束后立即加入 15 mL氯仿/甲醇(2∶1)溶液终止反应,2 000 r·min-1离心 3 min 后取上清液过 0.22 μm 有机系滤膜,滤液用分光光度计在 490 nm 处测定吸光值。标准曲线参照Zhao等[14]的方法构建。
1.6 土壤DNA提取及荧光实时定量PCR分析
称取0.5 g置于-8 0 ℃冰箱中的土壤,用PowerSoil®DNA Isolation Kit (MoBio Laboratories, Inc., Carlsbad, CA, USA) 按说明书上的步骤进行土壤总 DNA的提取,所有DNA样品保存在-20 ℃冰箱待用。
用于定量细菌1 6 S r R N A(E u b 3 3 8 F/Eub518R)、真菌(ITS1f/5.8S)和尖孢镰刀菌ITS基因(ITS1F/AFP308R)的引物如表1所示。荧光实时定量PCR扩增反应在CFX96TMReal-Time System(Bio-Rad Laboratories Inc.,Hercules,CA,USA)上进行。各基因的标准曲线参照Zhao等[17]的方法构建。
1.7 变性梯度凝胶电泳及DGGE图谱分析
分别利用带有GC夹子的细菌通用引物GCU968/L1401和真菌通用引物 GC-Fung/NS1对细菌和真菌的16S rRNA和18S rRNA基因片段进行PCR扩增(表1)。参照Muyzer等[19]的方法,采用D-Code System(Bio-Rad Laboratories Inc., Hercules,CA, USA)对PCR产物进行变性梯度凝胶电泳(Denatured gradient gel electrophoresis, DGGE)分析。细菌和真菌的变性梯度、电泳条件和凝胶染色显影参照刘亮亮等[26]的方法。利用Quantity One 4.6.3对DGGE图谱进行聚类分析和多样性分析。
1.8 三七存苗率和发病率的测定
一年七籽条于正常种植时间移栽至各处理土壤中,移栽3个月后(三七籽条出苗完全)统计其出苗率,移栽5个月和8个月后统计存苗率和发病率。计算公式如下:

1.9 数据统计分析
本试验为单因素试验,采用SPSS 19.0进行统计分析,单因素方差(One-way ANOVA)配合Tukey’s HSD检验多处理间均值差异的显著性;Pearson相关性分析检验土壤中化感物质含量、病原菌数量与三七出苗率、存苗率、发病率及微生物多样性和丰富度之间的相关性。
2 结 果
2.1 不同有机物料RSD处理对土壤中皂苷含量和降解率的影响
利用HPLC结合标准品的方法分析不同处理土壤提取液中的皂苷成分(图1),结果显示,土壤提取液中可检测出2种主要的皂苷成分,即Rb1和Rh1。结合表2可知,与CK处理相比,RSD处理均能显著降低土壤中皂苷Rb1和Rh1的含量(P≤0.05),其中BD和SB+BD处理对Rb1的降解效果显著优于SB处理(P≤0.05),降解率均高达82%;而SB、BD和SB+BD处理对Rh1的降解效果很好,降解率分别为85.4%、85.8%和88.1%,但不同RSD处理间无显著差异(P>0.05)。土壤强还原处理能够显著降低土壤中皂苷类化感物质的含量,不同RSD处理对皂苷Rb1的降解率不同,这可能与不同碳氮比有机物料刺激产生的微生物类群对Rb1分解利用能力不同有关。
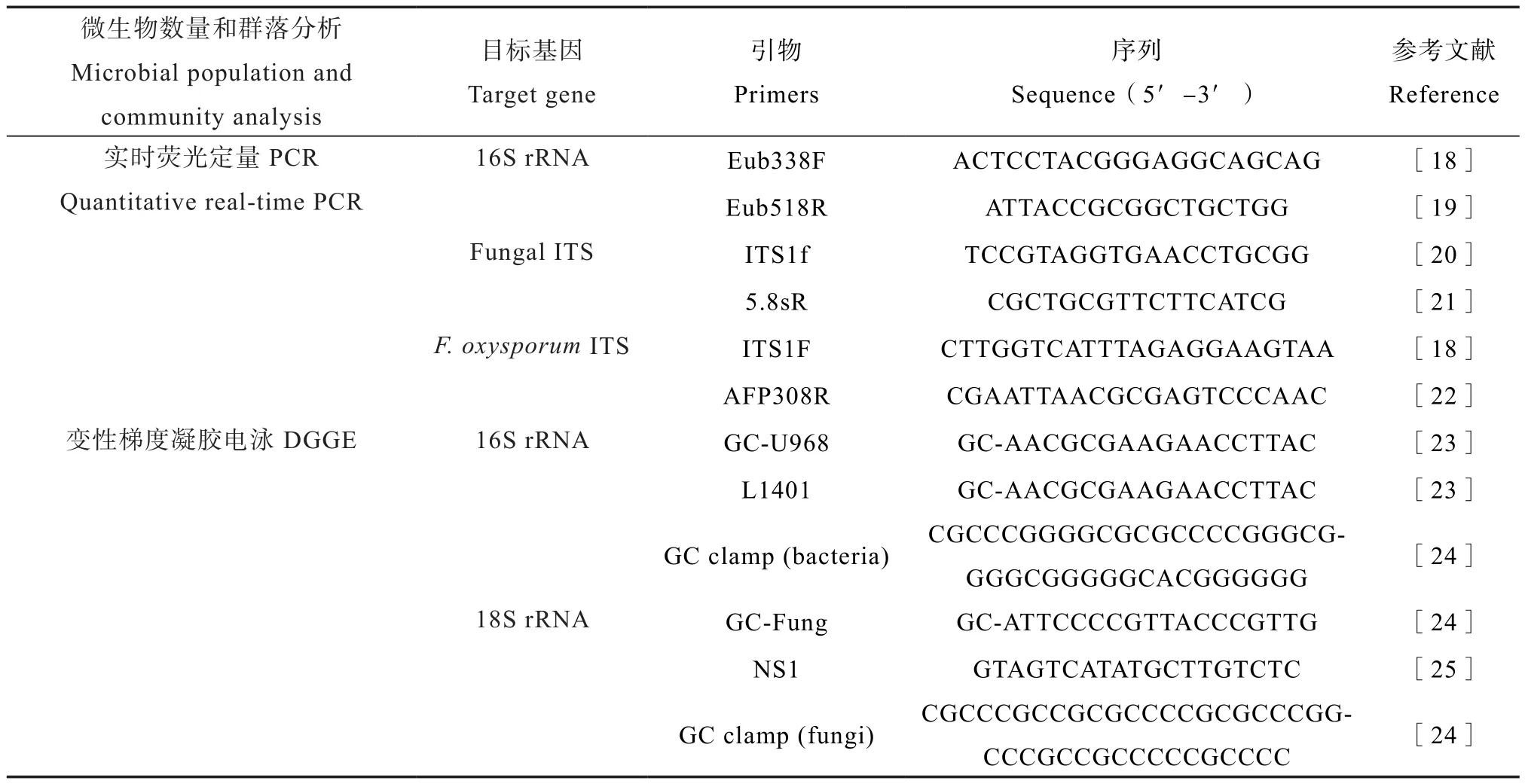
表1 定量PCR和PCR-DGGE所用的引物Table 1 Primers used in real-time PCR and PCR-DGGE
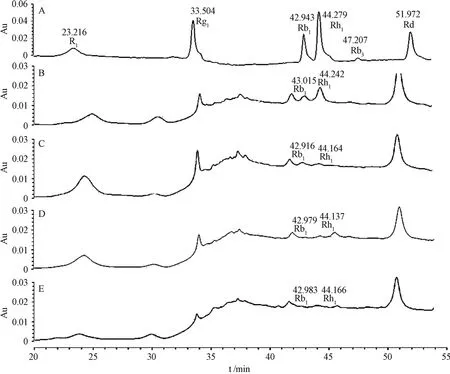
图1 皂苷标准溶液及不同有机物料RSD处理土壤提取液HPLC图。A: 皂苷标准溶液;B:CK;C:SB;D:BD;E:SB+BDFig. 1 HPLC profiles of standard saponins and soil extract from RSD treated soil relative to organic substrate. A: Standard saponinssolution; B: CK; C: SB;D: BD; E: SB+BD
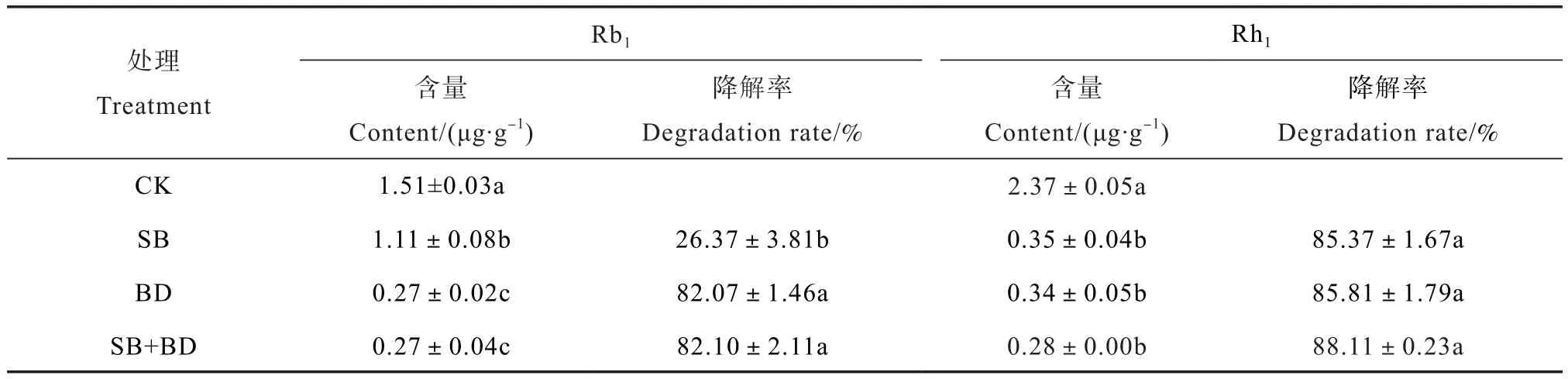
表2 不同有机物料RSD处理对土壤中皂苷含量和降解率的影响Table 2 Effects of reductive soil disinfestation coupled with application of organic substrates on content and degradation rate of soil saponins relative to treatment
2.2 不同有机物料RSD处理对土壤微生物活性的影响
如图2所示,与CK处理相比,RSD处理均能提高土壤微生物活性,其中BD处理的土壤微生物活性最高,达到39.7 μg·g-1·h-1干土,显著高于CK处理(P≤0.05)。土壤强还原过程中添加的有机物料能够为微生物的生长提供碳、氮源,从而能在一定程度上提高微生物活性,而BD处理中添加的有机物料氮含量最高,碳氮比最低,更适宜微生物的生长利用,这可能是BD处理土壤微生物活性最高的原因。
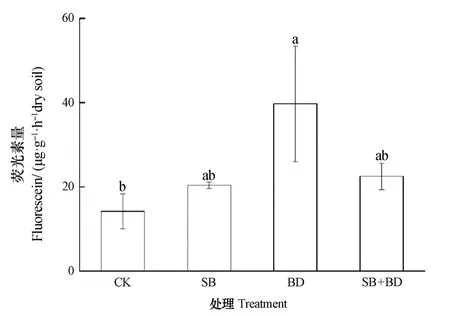
图2 不同有机物料RSD处理对土壤微生物活性的影响Fig. 2 Effects of reductive soil disinfestation coupled with application of organic substrates on soil microbial activity relative to treatment
2.3 不同有机物料RSD处理对土壤微生物数量的影响
如图3A和3B所示,不同有机物料RSD处理对土壤中细菌和真菌数量的影响不同,其中SB和SB+BD处理的细菌和真菌数量显著低于CK和BD处理(P≤0.05),而CK和BD处理间无显著差异。由图3C和3D可知,与CK处理相比,RSD处理后,土壤中尖孢镰刀菌的数量及其与真菌的比例均显著下降(P≤0.05),但不同RSD处理间差异不显著,其中所有RSD处理的杀菌率均高于99.7%。表明土壤强还原处理能够有效杀灭土传病原菌,降低其在土壤真菌类群中的占比,这可能与土壤强还原过程中产生的杀菌物质如有机酸、还原性金属离子有关;也可能与其创造的厌氧环境有关。
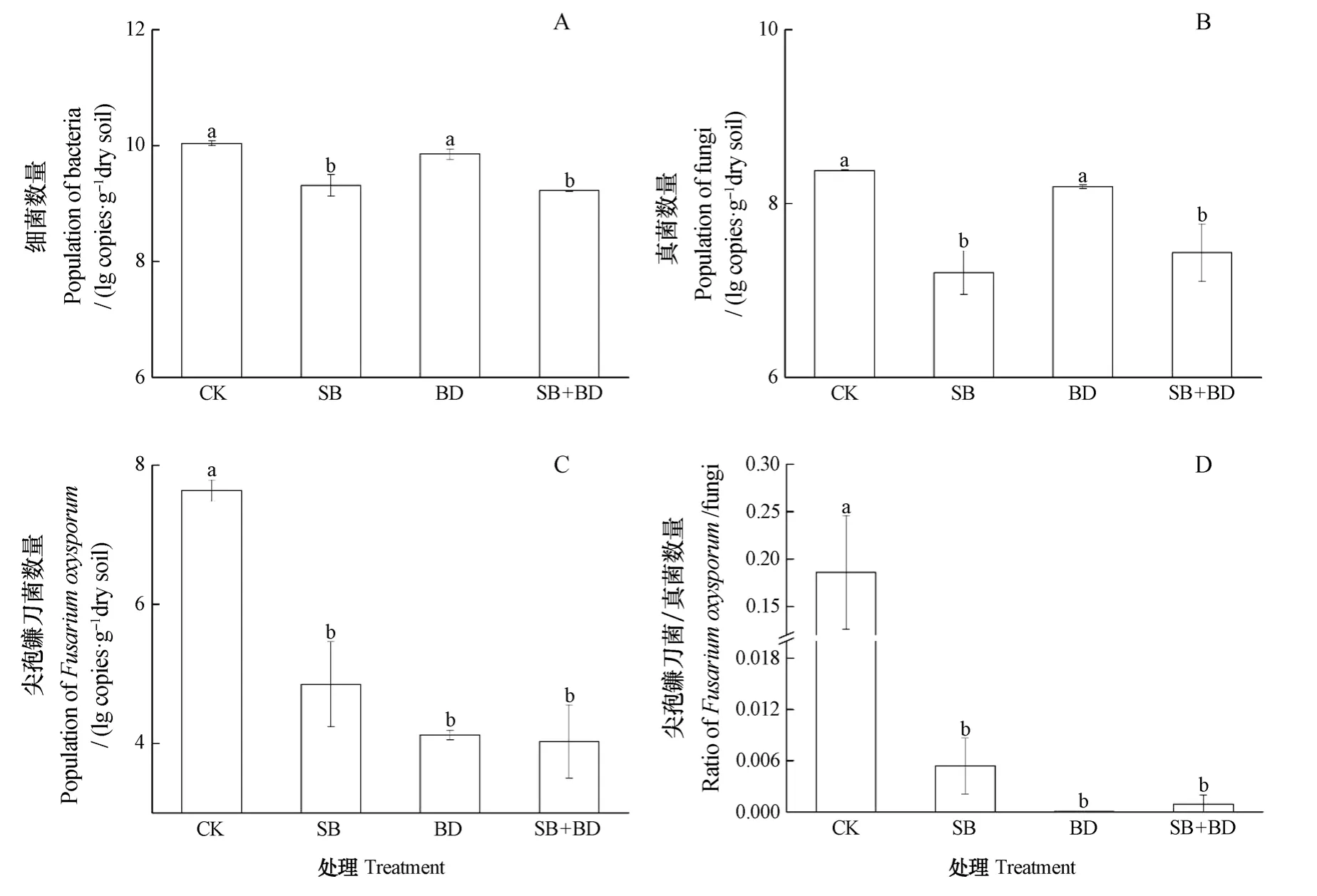
图3 不同有机物料RSD处理对土壤中细菌(A)、真菌(B)、尖孢镰刀菌(C)数量及尖孢镰刀菌/真菌比(D)的影响Fig.3 Effects of reductive soil disinfestation coupled with application of organic substrates on bacteria (A), fungi (B), F. oxysporum(C), and F. oxysporum/fungi ratio (D) relative to treatment
2.4 不同有机物料RSD处理对土壤微生物群落结构和多样性的影响
如图4所示,土壤强还原处理能够显著改变细菌和真菌的群落结构(DGGE条带的位置和数量)。聚类分析结果显示土壤细菌群落结构分成2组,其中SB和CK处理聚在一起,BD和SB+BD处理的细菌群落结构聚在一起(图4A);土壤真菌群落结构同样分成两组,SB、BD和SB+BD处理的真菌群落结构聚在一起,与CK处理分开,且SB和SB+BD处理的真菌群落结构聚在一起,与BD处理分开(图4B)。由表3可知,与CK处理相比,土壤强还原处理能够显著增加细菌的香农多样性和丰富度(P≤0.05),且SB+BD处理的多样性和丰富度指数最高,分别为H'=3.46和S= 34.33,显著高于SB和BD处理(P≤0.05)。此外,BD和SB+BD处理的真菌香农多样性和丰富度指数显著高于CK处理和SB处理(P≤0.05),而处理间(BD与SB+BD;CK与SB)均无显著差异(P>0.05)。土壤强还原处理能够显著改变土壤微生物群落结构和提高其多样性和丰富度(P≤0.05),且这些改变和提高与有机物料的碳氮比和多样性有关。
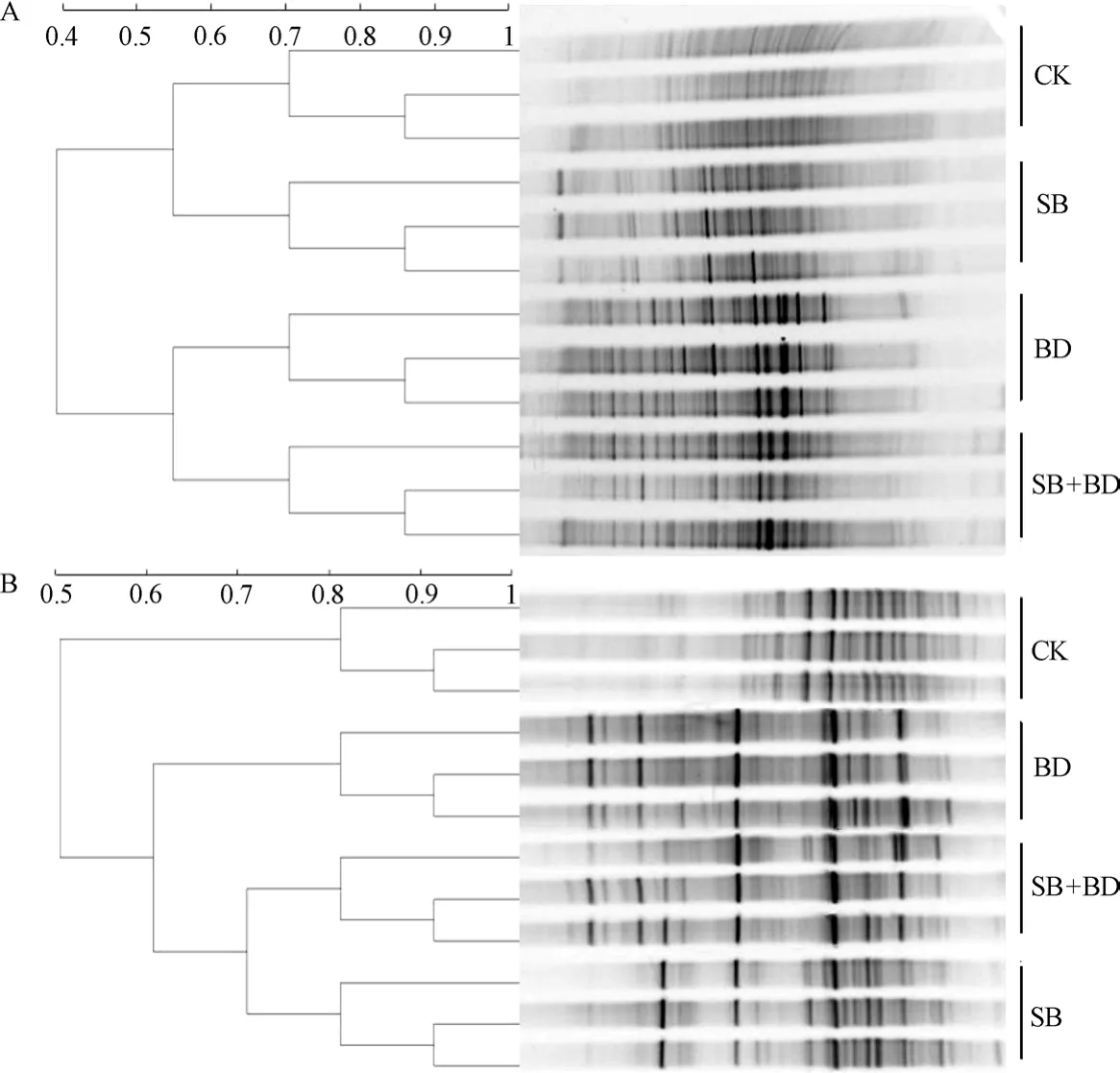
图4 不同处理土壤中细菌(A)和真菌(B)群落结构的聚类分析Fig. 4 Cluster analysis of DGGE banding profiles for bacteria (A) and fungi (B) communities relative to type of organic substrate
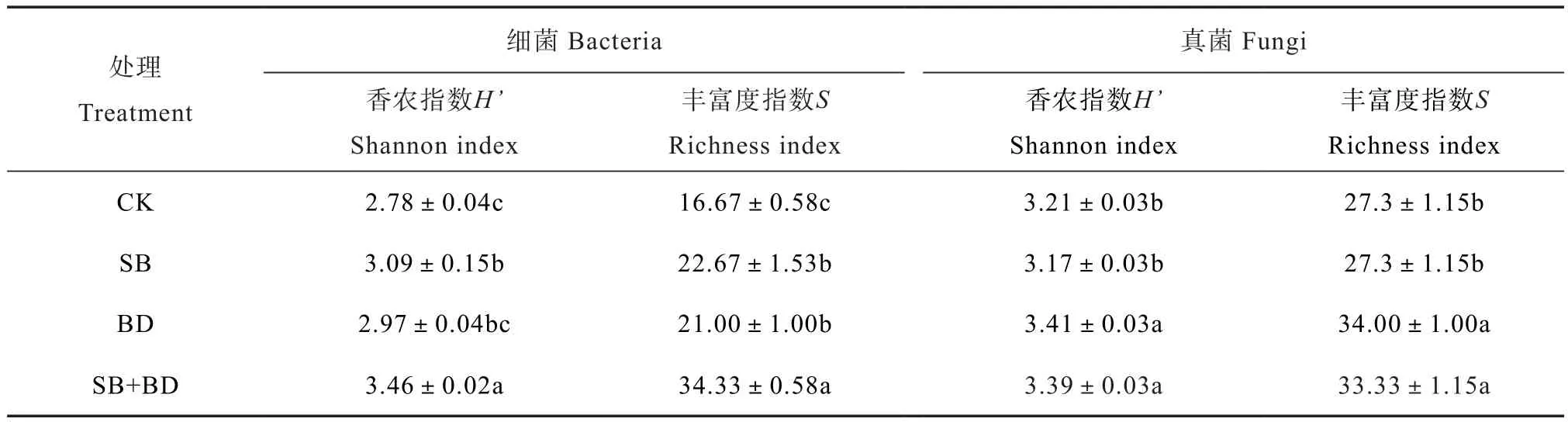
表3 不同处理土壤中细菌和真菌香农多样性和丰富度指数Table 3 Shannon diversity and richness of bacteria and fungi in the soilrelative to treatment
2.5 不同有机物料RSD处理对三七生长的影响
如表4所示,与CK处理相比,土壤强还原处理对三七出苗率无显著影响,但BD和SB+BD处理的出苗率差异显著(P≤0.05)。移栽一年七籽条5个月后,土壤强还原处理的三七存苗率均显著高于CK处理(P≤0.05),且BD处理的三七存苗率最高,达到66.7%;而CK处理的发病率最高,达到89.0%,显著高于SB、BD和SB+BD处理(P≤0.05),且不同RSD处理间的三七发病率差异不显著(P>0.05)。随着再植三七移栽时间的延长,三七的存苗率均逐渐降低,发病率则逐渐增加。至移栽8个月后,RSD处理的存苗率降低至35.1%~48.9%,但仍显著高于CK处理(0%);而RSD处理的发病率增加至36.6%~52.3%,是移栽5个月后发病率的2.75倍~4.67倍,仍显著低于CK处理的100%。其中BD处理的存苗率最高,发病率最低。可见土壤强还原处理能够显著增加三七的存苗率(P≤0.05),降低三七的发病率,但对三七的出苗率影响不大,这可能是因为三七籽条自身的质量是影响出苗率最重要的因素。随着移栽时间的延长,再植三七的存苗率逐渐下降,其原因可能是单一的土壤强还原处理对连作障碍因子的消除具有一定的局限性,未能将其消除完全,从而造成了再植三七发病率逐渐攀升的现象,这也从侧面表明土壤中的障碍因子如病原菌数量和化感物质含量是影响三七生长和发病最重要的因素。
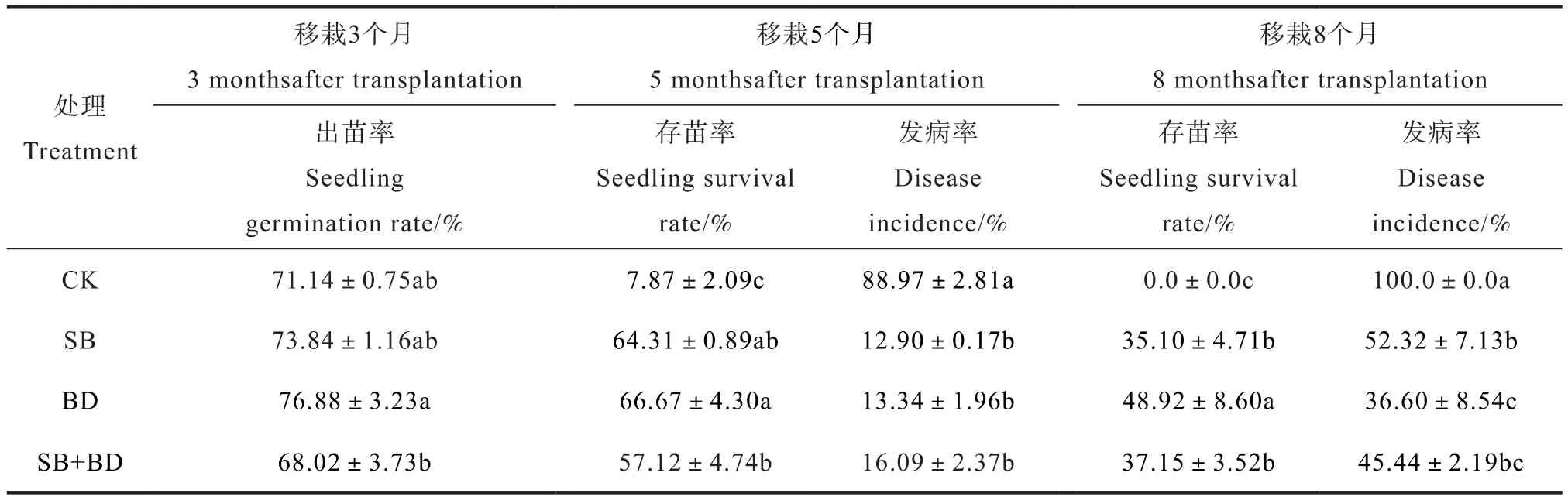
表4 不同有机物料RSD处理对三七出苗率、存苗率及发病率的影响Table 4 Effects of reductive soil disinfestation coupled with organic substrates on germination rate, survival rate, and disease incidence of Sanqi seedlings relative to treatment
相关性分析(表5)显示,土壤中皂苷Rb1、Rh1、Rb1+Rh1含量及F. oxysporum的数量与三七的存苗率呈显著负相关(P≤0.01),与三七的发病率呈显著正相关(P≤ 0.01),但与三七的出苗率无显著相关性。而土壤中皂苷Rb1、Rb1+Rh1含量及F. oxysporum的数量与细菌多样性和丰富度、真菌多样性和丰富度呈显著负相关(P≤ 0.05);土壤中Rh1的含量仅与细菌多样性和丰富度呈显著负相关(P≤ 0.05)。表明RSD处理后,再植三七存苗率显著增加、发病率显著降低与连作土壤中障碍因子如病原菌和皂苷类化感物质的显著消除有关,而这些障碍因子的消除程度与RSD过程中土壤微生物的变化,如微生物多样性和丰富度显著增加有关。
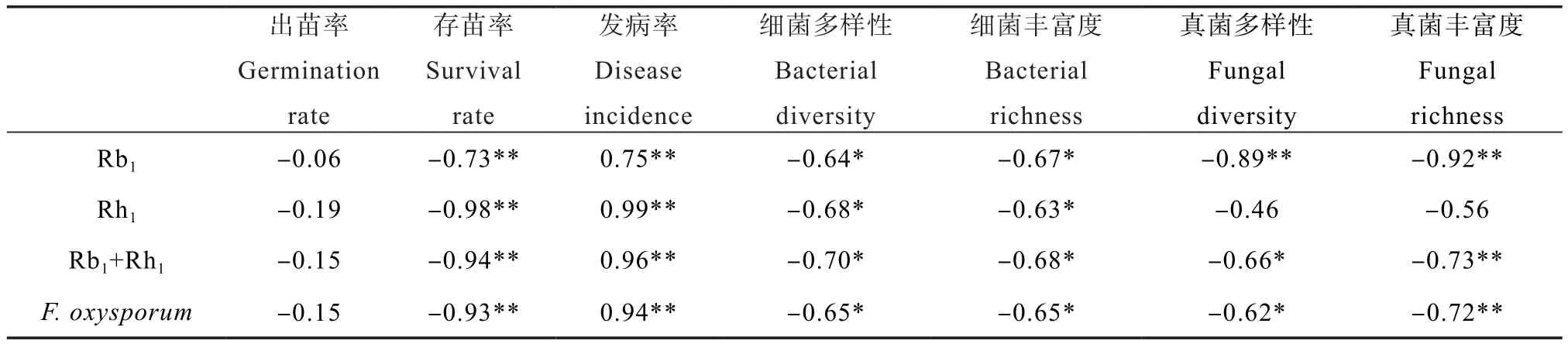
表5 土壤中皂苷含量、病原菌数量与三七出苗率(移栽3个月)、存苗率和发病率(移栽5个月)、细菌多样性和丰富度和真菌多样性和丰富度的Pearson相关性分析Table 5 Pearson correlation coefficients of soil saponins content with F. oxysporum population, germination rate (3 months after transplantation), survival rate, disease incidence (5 months after transplantation), diversity and richness of bacteria and diversity and richness of fungi
3 讨 论
三七是极其珍贵的中药材,具有入药历史久,用药范围广,市场需求量大等特征[1,6]。但是,三七是性喜温暖阴湿的多年生免耕宿根植物,土传病害问题较为严重,而且三七种植忌地性极强,存在严重的连作障碍问题[3]。近年来,随着人们生活水平的提高,保健意识的加强,三七的社会需求量逐年递增,但连年大面积单一的人工栽培模式导致三七的连作障碍问题日趋突出。并且随着种植历史的延长,可种植三七的土壤资源日益枯竭,道地三七的市场需求和生长能力之间形成了尖锐的矛盾[3]。目前,连作障碍已成为制约我国道地三七可持续生产的瓶颈。因此,解决三七忌连作问题,缩短土地资源再利用周期,保证三七栽培的可持续发展和三七药材的道地性已经刻不容缓。
土壤中化感自毒物质累积及其效应是再植三七产生连作障碍的主要因素,有效降低其在土壤中的浓度是缓解甚至克服三七连作障碍的重要前提[5-6]。利用活性碳、生物炭等具有吸附特性的吸附剂可有效降低土壤或营养液中化感自毒物质的浓度,进而减轻植物的化感自毒作用[1,27]。Yang等[15]的研究表明,在水培条件下,向溶液中添加活性炭能够完全抵消三七根系分泌物中自毒物质对三七存苗率的影响,其存苗率较只添加根系分泌物的处理高了3倍多,与只添加水的对照处理相似。但是,这种通过活性炭、生物炭等吸附剂降低土壤中化感物质浓度的作用属于物理作用,因此在一定的环境条件下,被活性炭或生物炭吸附的化感物质会重新释放回到土壤中,从而可能对再植作物的正常生长产生负面作用[28]。李勇等[29]研究发现,在平板条件下,向溶液中添加筛选得到的人参自毒物质的降解微生物,能够有效缓解自毒物质对人参种子萌发的抑制作用。但是,在土壤条件下,其降解效果往往不稳定,这是由于外源添加的微生物首先要适应连作的土壤环境,并且还需与连作土壤土著微生物在养分和生态位的竞争中占优,进而才能在土壤中发挥其作用[30]。因此,生产上也未见有大面积推广应用的实例。在本研究中,经过40d的土壤强还原处理,土壤中皂苷类化感自毒物质的浓度显著下降,其中Rb1和Rh1在BD和SB+BD处理中的降解率达到82%~88%,这是因为在土壤强还原过程中,某些具有化感物质降解能力的厌氧微生物被刺激产生并迅速增殖,从而促进了皂苷类物质的消除。其实,这种厌氧生物降解技术已经在有机污染物尤其是氯代芳香族化合物的降解领域得到广泛的研究和应用[31]。但是,关于哪些微生物类群在土壤强还原过程中参与皂苷类物质的降解,且如何通过改变有机物料的种类来调控这些微生物的数量、种类和活性仍值得进一步的研究。
土壤微生物生态失衡,病原菌富集、有益菌减少是连作三七土传病害频发的主要原因[1]。降低土壤中病原菌的数量,改善土壤微生物群落结构是减少三七土传病害发生率的关键。轮作非寄主植物是降低土传病原菌数量,减少土传病害发生率较为有效的农业措施[6]。Zhao等[14]的研究发现,与连作三七土壤相比,短期的玉米轮作虽然能显著降低病原菌在真菌中的占比,但并不能有效降低土壤中病原菌的数量,这可能是三七需要轮作10~30年才能再植的原因之一。土壤熏蒸剂如氯化苦等虽然能够有效杀灭土壤病原微生物,但同时也降低了土壤中有益微生物的数量,还可能导致土壤微生物群体对病原微生物的竞争抑制作用下降[1]。此外,氯化苦、克百威等12种高毒农药将在5年内全部禁用。本研究发现,高碳氮比有机物料、低碳氮比有机物料或高、低碳氮比混合物料的强还原处理均能显著降低土壤中尖孢镰刀菌的数量,杀菌率高达99.7%,这是因为在土壤强还原过程中,厚壁菌门厌氧微生物如梭菌科(Clostridiaceae)等能够在分解有机物料的同时,产生一些具有杀菌作用的小分子有机酸如乙酸、丁酸等,同时这些微生物类群还能分泌抗真菌物质,从而对病原菌起到杀灭作用[32-33]。Momma等[34]以强还原过程中产生的有机酸种类和浓度为依据,通过平板添加试验的研究表明有机酸能够有效杀灭病原菌的繁殖体,抑制孢子的萌发,这与本实验室前期的研究结果一致[33]。此外,尖孢镰刀菌在真菌中的占比也显著下降,其下降的幅度远远超过短期玉米轮作,表明土壤强还原处理能够选择性地杀灭土传病原菌,同时还能刺激其他真菌类群的生长增殖,从而在一定程度上加剧了其他真菌与病原菌在生态位及养分的竞争,潜在地增强了土壤微生物的抑病能力[14]。低碳氮比有机物料和高、低碳氮比混合物料强还原处理中病原菌/真菌比例低于高碳氮比有机物料强还原处理,其原因可能是低碳氮比有机物料较易分解,能利用的微生物类群谱更广,因此能刺激产生更多的真菌类群和更大的种群数量。
连作土壤中化感物质降解率和杀菌率是衡量三七连作障碍因子消除与否和消除程度的关键,而三七再植之后的存苗率、发病率才是衡量土壤强还原处理方法能否有效缓解三七连作障碍的重要指征。本研究发现,移栽一年七籽条5个月后,连作土壤中三七的存苗率仅7.8%,发病率高达89.0%;而RSD处理的存苗率为57.1%~66.7%,发病率仅为12.9%~16.1%,这表明土壤强还原处理能有效缓解三七的连作障碍,且存苗率与土壤中皂苷物质含量和病原菌数量呈显著负相关,进一步证实强还原处理是一种具有有效消除连作障碍因子潜力的土壤处理方法。但是,再植三七的存苗率随再植时间的延长而逐渐下降,发病率则逐渐增加。在移栽一年七籽条八个月以后,RSD处理的存苗率为35.1%~48.9%,虽仍显著高于对照处理,但也明显低于同期未种植过三七的新土,这可能是由于单一的土壤强还原处理未能将三七种植过后的土壤条件完全恢复到种植以前的水平。因此,继续研究如何提高RSD处理对连作障碍因子清除的效果,开发相应的农业措施,延缓三七在连续种植过程中的发病速度显得尤为必要。
土壤强还原处理是一种操作简单、处理时间短、不耽误农时的作物种植前的土壤处理方法[12]。虽然强还原措施自身具有一定的复杂性,但我们前期大量的田间试验表明,只要严格控制条件,其效果是有效且稳定的,不因土壤类型、作物种类的变化而明显变化[13,26,33,35]。此外,强还原措施所需的成本主要受处理过程中所用物料的种类、收集所需成本的影响而波动,但对于具有高价值的蔬菜、瓜果、花卉等作物,其处理成本与连作后的搬迁成本、继续连作可能导致的经济损失以及连作过程中防控病害所需农药的花费相比,并不算高,因而可以被广大种植户所接受。目前,我们在云南省和浙江省进行了大面积的示范推广,反响良好。
4 结 论
土壤强还原处理是一种快速有效消除土壤连作障碍因子的方法,能够显著降低连作三七土壤中皂苷类化感自毒物质的含量,有效杀灭富集的土传病原微生物,还能够增加土壤微生物多样性和活性,提高连作三七的存苗率、降低其发病率。因此,土壤强还原处理是一种具有解决三七忌连作问题,缩短土壤资源再利用周期潜力的农业措施,但离农业实际生产还有一定的距离,仍需进一步的科学研究。
