抑制脊髓络丝蛋白表达对神经性疼痛成年大鼠疼痛行为的影响研究
2019-07-12胡洁旷昕张倩璐李欢颜阳巧云彭良玉
胡洁,旷昕,张倩璐,李欢颜,阳巧云,彭良玉
本研究创新点:
成年大鼠脊髓背角中络丝蛋白持续表达的作用至今仍不清楚。本研究采用鞘内注射络丝蛋白shRNA慢病毒载体的方法抑制健康成年大鼠及神经性疼痛大鼠脊髓背角络丝蛋白表达的方法,首次发现神经性疼痛大鼠同侧脊髓背角中络丝蛋白的表达明显减少,进一步抑制其表达水平则明显加重神经性疼痛。而对于健康成年大鼠及神经性疼痛大鼠非损伤侧,络丝蛋白表达减少对疼痛行为则无明显影响。提示,脊髓背角络丝蛋白表达减少是神经性疼痛的重要分子机制,将为临床上治疗神经性疼痛提供新的分子靶点。
络丝蛋白(Reelin)是一种细胞外基质糖蛋白,在胚胎时期主要参与神经元的正常迁移和定位过程。出生后,络丝蛋白主要参与突触功能的调节过程。络丝蛋白分泌减少或缺失可导致神经元的连接和突触的重塑发生异常,导致认知功能障碍而参与多种精神疾病的发生和发展过程,例如自闭症、精神分裂症、双向情感障碍、阿尔茨海默病[1]。
络丝蛋白在成年大鼠的脊髓中也有表达,尤其在脊髓背角浅层有较高的表达,其具体病理生理作用仍不清楚[2]。前期研究发现,络丝蛋白表达缺失的Reeler小鼠可导致机械缩足阈值(paw withdrawal mechanical threshold,PWMT)增加而热辐射刺激潜伏期(paw withdrawal thermal latency,PWTL)缩短[3]。但由于络丝蛋白参与胚胎时期脊髓背角神经元的发育和迁移定位过程,Reeler小鼠脊髓背角的神经元定位和板层结构发生明显紊乱。脊髓背角结构正常的成年大鼠,其脊髓背角中络丝蛋白的作用仍不清楚。本课题组的前期研究发现,神经性疼痛大鼠脊髓背角中络丝蛋白的表达明显减少[4]。本实验通过鞘内注射络丝蛋白shRNA慢病毒载体,抑制大鼠脊髓背角中络丝蛋白的表达,观察其对正常大鼠和坐骨神经结扎诱发神经性疼痛大鼠疼痛行为的影响,为临床治疗神经性疼痛提供新的分子靶点。
1 材料与方法
1.1 实验动物 2015年,选取SPF级雄性Sprague-Dawley(SD)大鼠,8~10周龄,体质量280~320 g,购自南华大学动物部。室温24~25 ℃,光照时间为8:00~20:00,分笼饲养3 d。本研究经南华大学附属第一医院伦理委员会批准,严格遵守南华大学附属第一医院动物保护和使用规定。
1.2 方法
1.2.1 鞘内置管、给药和分组 购入后饲养1周左右,体质量达标的119只大鼠腹腔注射戊巴比妥钠50 mg/kg麻醉,采用YAKSH等[5]的研究方法自枕骨大孔处行蛛网膜下腔置管,置入PE-10微细导管至腰髓平面(约8.5 cm)。置管后,经PE-10微细导管注射2%利多卡因15 μl出现下肢瘫痪、约30 min后逐渐恢复运动功能证明PE-10微细导管在蛛网膜下腔,即置管成功。排除存在运动功能障碍的大鼠,共纳入108只大鼠。于置管后第5天,将108只大鼠采用随机数字表法分为正常(Norm)组12只、RNA干扰(RNAi)组12只、假手术(Sham)组12只、Sham+RNAi(SR)组6只、慢性坐骨神经压迫性损伤(CCI)组27只、CCI+RNAi(CR)组27只、CCI+空载体(EV)组12只。
1.2.2 CCI模型的建立 将CCI组、CR组和EV组大鼠腹腔注射戊巴比妥40 mg/kg麻醉后,采用BENNETT等[6]的研究方法制备CCI模型,大鼠置于俯卧位,消毒铺巾,选择右后肢,于股骨下方约1 cm平行于股骨切开皮肤,用小剥离子经股二头肌间隙钝性分离肌肉,暴露坐骨神经,用神经剥离子轻柔地将坐骨神经与周围软组织分离。在坐骨神经分成三支前的主干部位游离神经7 mm左右,在距神经起始处(三支分叉处)上方2 mm,用4.0含铬羊肠线结扎坐骨神经4道,每道间隔约1 mm,被结扎的神经长度为4~5 mm,结扎的松紧度以打结时见肌肉轻微抽动为标准。局部采用0.9%氯化钠溶液冲洗,间断缝合肌肉筋膜、皮下组织以及皮肤。术后将大鼠放入鼠笼,于室温24~25 ℃、安静环境自由喂养;Sham组除不结扎坐骨神经外,其余与上述操作相同;手术由同一人操作。上述手术过程均在无菌条件下进行,并于术前2 h及术后第1、2天,腹腔注射头孢呋辛钠4 mg。
1.2.3 干预方法 取络丝蛋白shRNA慢病毒载体(上海吉凯基因化学技术有限公司)或空载体(上海吉凯基因化学技术有限公司)5 μl(滴度为1×108TU/ml),加入5 μl 0.9%氯化钠溶液稀释至10 μl。于CCI造模术后第1天,CCI组、Norm组和Sham组大鼠鞘内给予0.9%氯化钠溶液20 μl;SR组和CR组大鼠鞘内给予稀释的络丝蛋白shRNA慢病毒载体10 μl,再给予10 μl 0.9%氯化钠溶液冲管;EV组给予稀释的空载体10 μl,再给予10 μl 0.9%氯化钠溶液冲管。络丝蛋白shRNA慢病毒载体序列为:5'-AAGGAACGCTTTGACAGTGAA-3'[7],空载体序列为:5'-TTCTCCGAACGTGTCACGT-3'。
1.2.4 Western blotting法 CCI组与CR组于干预后第4、7、10、14、21天,Norm组、RNAi组、Sham组与EV组于干预后第10天,每次随机选取3只大鼠,麻醉后断头迅速处死,取腰段(L4~5)脊髓,分离出脊髓背角,并将左、右侧分开。提取胞质蛋白,80 ℃冻存。采用Bradford法检测蛋白含量,配平后,按照每4 μl蛋白样品加入1 μl十二烷基硫酸钠-聚丙烯酰胺凝胶(SDSPAGE)蛋白上样缓冲液(5×)(湖南和爱佳儿生物科技有限公司)的比例混合,煮沸5 min。取上样总蛋白80 μg,8% SDS-PAGE电泳分离后,将蛋白质电转移到聚偏二氟乙烯(polyvinylidene difluoride,PVDF)膜上。5%脱脂奶粉室温封闭2 h,分别加入一抗〔络丝蛋白一抗(ab78540),1∶1000稀释,美国Abcam公司;β-actin一抗(KG11014),1∶1000稀释,江苏凯基生物技术股份有限公司〕,4 ℃孵育过夜,TBST缓冲液漂洗3次,5 min/次,加入二抗〔辣根过氧化物酶(HRP)标记的山羊抗鼠IgG,1∶3000稀释,Proteintech Group〕,室温振荡孵育2 h,缓冲液漂洗3次,5 min/次,ECL化学发光液作用1 min,压片、显影和定影。采用Adobe Photoshop CS2软件分析,计算络丝蛋白/β-actin内参条带的积分吸光度(IOD)值。
1.2.5 免疫组织化学 Norm组、RNAi组、Sham组、CCI组、CR组、EV组分别于干预后第10天,随机选取3只大鼠,麻醉后先以0.9%氯化钠溶液心脏灌注后,4%多聚甲醛溶液再次行心脏灌注以固定组织。取出脊髓腰膨大(L4~5)放入4%多聚甲醛溶液中过夜进一步固定组织后行石蜡包埋。薄片切片机将脊髓横切成20 μm厚。二甲苯脱蜡后乙醇逐级水化。室温下放入3%双氧水中浸泡30 min以抑制内源性过氧化物酶的活性。室温下10%山羊血清封闭1 h。加入4 ℃络丝蛋白一抗(1∶1000稀释)孵育48 h,室温下二抗孵育(HRP标记的山羊抗鼠IgG,1∶200稀释,Proteintech Group)30 min。光镜下加入DAB显色1~5 min。苏木素复染,乙醇逐级脱水,封固。奥林巴斯显微镜进行观察拍片,采用IPP 6.0图像分析软件对图像进行分析。
1.2.6 行为学测试 各组分别于干预当天及干预后第1、4、7、10、14、17、21天,每次随机选取6只大鼠,放入透明有机玻璃网箱中适应30 min后进行行为学测试。采用TAL等[8]的方法检测PWMT。采用纤维强度为2~15 g的von Frey纤毛(美国Stoelting公司)垂直刺向大鼠足底,力度以使纤毛弯曲为宜,持续6~8 s。大鼠右后肢迅速畏缩、撤回、舔足视为阳性反应。从2 g von Frey纤毛开始,每个刺激强度测试5次,当出现3次及以上阳性反应为止,最小纤维强度为大鼠的PWMT,设定最大强度为15 g,大于此值计为15 g。采取HARGREAVES等[9]的方法,采用BME-410C型全自动热辐射刺激仪(中国医学科学院生物工程研究所)检测大鼠足底PWTL。初次测试前,调节焦距和光强度直至光点最小,使大鼠基础缩足阈值为20~25 s。为避免大鼠足底烧伤,设定热辐射刺激仪自动切断时间为25 s。记录大鼠出现提足或者舔舐的时间并切断光源。每只大鼠重复测试5次,每次间隔时间为5 min,去掉最大值和最小值,取余3次平均值为PWTL。
1.3 统计学方法 采用SPSS 17.0统计软件进行统计学分析。计量资料以(±s)表示,两组间比较采用t检验,多组同一时间比较采用单因素方差分析,多组不同时间比较采用重复测量方差分析,两两比较采用SNK法。以P<0.05为差异有统计学意义。
2 结果
2.1 Norm组与RNAi组干预后第10天络丝蛋白表达水平比较 RNAi组干预后第10天左、右侧络丝蛋白表达水平高于Norm组,差异均有统计学意义(P<0.05,见表1、图1A)。
2.2 Sham组、CCI组、CR组与EV组干预后第10天络丝蛋白表达水平比较 Sham组、CCI组、CR组与EV组干预后第10天左、右侧络丝蛋白表达水平比较,差异均有统计学意义(P<0.05);其中,CR组干预后第10天左侧络丝蛋白表达水平低于Sham组、CCI组,CCI组、CR组、EV组干预后第10天右侧络丝蛋白表达水平低于Sham组,CR组干预后第10天右侧络丝蛋白表达水平低于CCI组,差异均有统计学意义(P<0.05,见表2、图1B)。
2.3 CCI组与CR组双侧不同时间络丝蛋白表达水平比较 CCI组左、右侧与CR组左、右侧干预后第4、7、10、14、21天络丝蛋白表达水平比较,差异均有统计学意义(P<0.05);其中,第4天CCI组右侧络丝蛋白表达水平低于CCI组左侧,CR组右侧第4天络丝蛋白表达水平低于CR组左侧,CCI组右侧、CR组左侧第7、10、14、21天络丝蛋白表达水平低于CCI组左侧,CR组右侧第7、10、14、21天络丝蛋白表达水平低于CCI组右侧,差异均有统计学意义(P<0.05,见表3、图1C)。
2.4 各组免疫组化结果 免疫组化定位研究显示,Norm组大鼠脊髓背角中络丝蛋白弥漫性分布于脊髓背角的Ⅰ~Ⅱ板层,少量分布于Ⅴ板层和外侧脊髓核(LSN);RNAi组大鼠双侧脊髓背角的Ⅰ~Ⅱ板层及LSN中仅有极少量络丝蛋白的表达,Ⅴ板层仍存在少量表达;Sham组双侧脊髓背角中络丝蛋白的表达则无明显影响;CCI组术后第10天,右侧脊髓背角中络丝蛋白表达水平明显低于对侧,尤其在脊髓背角Ⅰ、Ⅱ板层的外侧,减少较明显;CR组大鼠双侧脊髓背角浅层仅有少量络丝蛋白的表达;EV组络丝蛋白的表达无明显影响(见图2)。
2.5 Norm组与RNAi组不同时间行为学测试指标比较处理方法与时间对PWMT、PWTL不存在交互作用(P交互>0.05);处理方法对PWMT、PWTL的影响,主效果不显著(P组间>0.05);时间对PWMT、PWTL的影响,主效果不显著(P时间>0.05,见表4)。
表1 Norm组与RNAi组干预后第10天络丝蛋白表达水平比较(±s)Table1 Comparison of the mean Reelin expression level of rats between normal and RNAi groups on the 10th day of intervention

表1 Norm组与RNAi组干预后第10天络丝蛋白表达水平比较(±s)Table1 Comparison of the mean Reelin expression level of rats between normal and RNAi groups on the 10th day of intervention
注:Norm=正常,RNAi=RNA干扰
组别 只数 左侧 右侧Norm 组 30.22±0.040.47±0.08 RNAi组 30.51±0.070.96±0.06 t值 11.30518.152 P 值 <0.001 <0.001

图1 各组大鼠脊髓背角络丝蛋白表达水平Figure1 Expression level of Reelin in the spinal dorsal horn of rats in each group
2.6 Sham组、SR组、CCI组、CR组与EV组不同时间行为学测试指标比较 处理方法与时间对PWMT、PWTL存在交互作用(P交互<0.001);处理方法对PWMT、PWTL的影响,主效果显著(P组间<0.001);时间对PWMT、PWTL的影响,主效果显著(P时间<0.001)。其中,干预后第1、4、7、10、14、17、21天CCI组、CR组、EV组的PWMT、PWTL低于Sham组,第7、10、14、17、21天CR组的PWMT、PWTL低于CCI组,差异均有统计学意义(P<0.05,见表5)。
表2 Sham组、CCI组、CR组与EV组干预后第10天络丝蛋白表达水平比较(±s)Table2 Comparison of the mean Reelin expression level of rats among sham,CCI,CR and EV groups on the 10th day of intervention

表2 Sham组、CCI组、CR组与EV组干预后第10天络丝蛋白表达水平比较(±s)Table2 Comparison of the mean Reelin expression level of rats among sham,CCI,CR and EV groups on the 10th day of intervention
注:Sham=假手术,CCI=慢性坐骨神经压迫性损伤,CR=CCI+RNAi,EV=CCI+空载体;与Sham组比较,aP<0.05;与CCI组比较,bP<0.05
组别 只数 左侧 右侧Sham 组 30.93±0.160.65±0.09 CCI组 30.96±0.060.51±0.07aCR组 30.47±0.08ab0.22±0.04abEV组 30.93±0.150.38±0.07aF值 11.61121.471 P值 0.003 <0.001

±s)Table3 Comparison of the mean expression level of Reelin of rats between CCI group and CR group on both right and left sides of spinal dorsal horn at different intervention times表3 CCI组与CR组双侧不同时间络丝蛋白表达水平比较(x
3 讨论
本研究结果显示,抑制成年大鼠脊髓背角络丝蛋白的表达对大鼠疼痛阈值无明显影响。成年大鼠坐骨神经损伤后,同侧脊髓背角中络丝蛋白的表达明显减少,而对侧络丝蛋白的表达则无明显改变。鞘内注射络丝蛋白shRNA明显抑制双侧脊髓背角中络丝蛋白的表达。但抑制脊髓背角中络丝蛋白的表达,仅引起神经性疼痛成年大鼠PWMT进一步缩短,而Sham大鼠PWMT无明显变化。提示,脊髓背角中络丝蛋白对正常大鼠痛觉阈值无影响,但脊髓背角中络丝蛋白表达减少可能参与外周神经损伤后神经性疼痛的发展过程。

图2 各组大鼠术后第10天脊髓背角络丝蛋白(DAB染色,×200)Figure2 Expression level of Reelin in the spinal dorsal horn of rats in each group on the 10th day after surgery
早期研究发现,络丝蛋白作为神经发育和正常定位的重要蛋白,在成年大鼠脊髓的第Ⅰ、Ⅱ和Ⅴ板层仍有较高的表达[2],而其病理生理作用仍不清楚。近年来的一系列研究采用络丝蛋白及其下游蛋白基因敲除的方法发现,络丝蛋白信号通路异常可以导致PWMT明显增高而PWTL明显缩短[3,10-12]。而本研究发现,在正常的成年大鼠中,抑制络丝蛋白表达对RNAi组及Sham组大鼠的PWMT和PWTL均无明显影响,仅引起CCI大鼠PWMT和PWTL下降。这可能与不同时间段抑制络丝蛋白表达带来的影响不同有关。利用基因敲除的方法抑制络丝蛋白信号通路的功能,受影响的小鼠从胚胎时期即受到影响。VILLEDA等[11]利用形态学研究发现,络丝蛋白及其下游的蛋白突变后,小鼠脊髓背角神经元的定位会发生明显变化,第Ⅰ板层的外侧神经元表达减少,第Ⅰ、Ⅱ板层间有明显的间隔区,各类痛觉环路的形成在胚胎时期就已经受到影响。而在本研究中,成年大鼠的神经信号传导环路已经发育成熟,抑制络丝蛋白表达对正常大鼠、Sham大鼠及CCI大鼠非术侧PWMT和PWTL均无明显影响,这进一步支持络丝蛋白信号通路突变引起疼痛行为改变与影响胚胎时期神经环路形成有关。在生理状态下,脊髓背角中络丝蛋白表达减少对大鼠疼痛阈值则无明显影响。
本课题组的前期研究发现,坐骨神经结扎后第4天起,CCI大鼠脊髓背角中络丝蛋白表达明显减少,并持续了至少3周[4]。本研究采用Western blotting及免疫组化技术进一步验证,CCI术后,术侧脊髓背角中络丝蛋白的表达明显减少,而对侧则无明显改变。前期研究发现,络丝蛋白表达减少与神经性疼痛的行为存在明显的相关性[4]。本研究采用RNAi的方法,进一步抑制神经性疼痛大鼠脊髓背角中络丝蛋白的表达后,CCI术侧PWMT和PWTL低于Sham组,这进一步提示络丝蛋白可能参与了神经性疼痛过程。但是,络丝蛋白影响神经性疼痛过程的机制以及脊髓背角中络丝蛋白表达减少的原因还不清楚。络丝蛋白除参与神经元的生长和定位外,在成年大鼠中,其主要通过调节突触的重塑,影响N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid receptor,NMDA)受体表达和功能而影响学习、记忆和认知功能[13]。脊髓背角中突触重塑是脊髓水平形成中枢敏化和慢性疼痛的重要机制[14],络丝蛋白是否通过调节突触的功能而参与神经性疼痛过程还有待进一步研究。
综上所述,在生理状态下,脊髓背角络丝蛋白对疼痛阈值无明显作用,但脊髓背角络丝蛋白表达减少可能参与神经损伤引起的神经性疼痛的发生和发展过程。脊髓背角络丝蛋白表达减少是神经性疼痛的重要分子机制,将为临床治疗神经性疼痛提供新的分子靶点。
表4 Norm组与RNAi组不同时间行为学测试指标比较(±s)Table4 Comparison of pain behaviors of rats between normal and RNAi groups at different intervention times
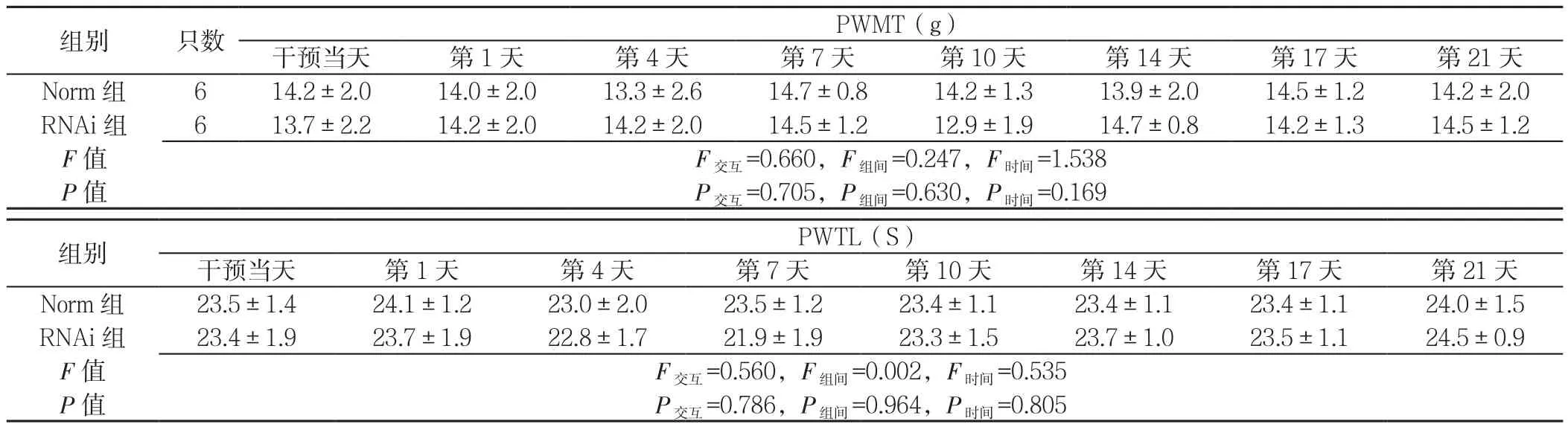
表4 Norm组与RNAi组不同时间行为学测试指标比较(±s)Table4 Comparison of pain behaviors of rats between normal and RNAi groups at different intervention times
注:PWMT=机械缩足阈值,PWTL=热辐射刺激潜伏期
组别 只数PWMT(g)干预当天 第1天 第4天 第7天 第10天 第14天 第17天 第21天Norm 组 614.2±2.014.0±2.013.3±2.614.7±0.814.2±1.313.9±2.014.5±1.214.2±2.0 RNAi组 613.7±2.214.2±2.014.2±2.014.5±1.212.9±1.914.7±0.814.2±1.314.5±1.2 F值 F交互=0.660,F组间=0.247,F时间=1.538 P值 P交互=0.705,P组间=0.630,P时间=0.169组别PWTL(S)干预当天 第1天 第4天 第7天 第10天 第14天 第17天 第21天Norm 组 23.5±1.424.1±1.223.0±2.023.5±1.223.4±1.123.4±1.123.4±1.124.0±1.5 RNAi组 23.4±1.923.7±1.922.8±1.721.9±1.923.3±1.523.7±1.023.5±1.124.5±0.9 F值 F交互=0.560,F组间=0.002,F时间=0.535 P值 P交互=0.786,P组间=0.964,P时间=0.805
Table5 Comparison of pain behaviors of rats among sham,SR,CCI,CR and EV groups at different time points of intervention表5 Sham组、SR组、CCI组、CR组与EV组不同时间行为学测试指标比较(±s)

Table5 Comparison of pain behaviors of rats among sham,SR,CCI,CR and EV groups at different time points of intervention表5 Sham组、SR组、CCI组、CR组与EV组不同时间行为学测试指标比较(±s)
注:SR=Sham+RNAi;与Sham组比较,aP<0.01;与CCI组比较,bP<0.05
PWMT(g)干预当天 第1天 第4天 第7天 第10天 第14天 第17天 第21天Sham 组 613.3±2.613.0±2.414.2±2.013.3±2.113.7±1.513.0±2.413.5±2.314.2±1.6 SR 组 612.5±2.713.8 ±1.913.7±2.212.8±1.913.2±1.513.8±2.013.0±2.314.3±1.2 CCI组 613.7±2.09.8±1.7a6.7±1.0a5.8±1.3a5.3±1.6a6.0±1.3a7.8±1.3a7.7±2.0aCR 组 614.2±2.09.5±2.0a5.7±1.5a3.7±1.5ab3.0±1.1ab3.2±1.0ab4.3±1.5ab4.7±1.0abEV 组 613.5±2.88.5±1.5a6.3±1.5a6.2±1.3a5.0±1.1a6.8±2.0a7.2±1.6a6.8±1.3aF值 F交互=6.780,F组间=159.817,F时间=28.986 P值 P交互<0.001,P组间<0.001,P时间<0.001 PWTL(S)干预当天 第1天 第4天 第7天 第10天 第14天 第17天 第21天Sham 组 23.7±1.023.6±1.422.7±1.723.1±1.023.4±1.123.2±0.923.4±1.123.6±1.5 SR 组 23.5±1.922.2±2.122.5±1.321.8±1.923.3±1.524.1±1.024.0±0.924.1±1.4 CCI组 23.6±2.015.3±1.9a10.8±1.3a9.0±1.0a7.7±0.9a9.2±1.0a10.4±1.1a10.1±0.9aCR 组 23.9±1.216.6±1.2a10.5±1.6a6.9±1.7ab3.9±0.8ab4.1±0.9ab3.9±0.8ab5.7±0.9abEV 组 23.7±1.115.5±1.3a10.4±1.1a9.4±0.7a8.2±0.8a9.9±0.9a9.7±1.1a10.1±0.8aF值 F交互=42.976,F组间=1306.502,F时间=227.132 P值 P交互<0.001,P组间<0.001,P时间<0.001组别组别 只数
作者贡献:彭良玉进行文章的构思与设计,对文章整体负责,监督管理;胡洁、李欢颜、阳巧云进行研究的实施与可行性分析,数据收集;胡洁、张倩璐进行数据整理;旷昕、彭良玉进行统计学处理,结果的分析与解释,论文修订,负责文章的质量控制及审校;胡洁撰写论文。
本文无利益冲突。
