白蛋白结合型紫杉醇为基础的化疗方案治疗复发性小细胞肺癌的临床疗效
2019-07-11杨科李峻岭乔英凯赵红艳王生卉曹素焕
杨科,李峻岭,乔英凯,赵红艳,王生卉,曹素焕
1北京市朝阳区桓兴肿瘤医院肿瘤内科,北京10006502国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院内科,北京100021
根据最新的全球癌症统计分析报告,目前在所有恶性肿瘤中,肺癌的发病率及病死率均居于第1位,分别为11.6%与18.4%[1],其中小细胞肺癌(small cell lung cancer,SCLC)占肺癌总数的15%~20%,且有2/3的患者在诊治初期即出现广泛的转移[2]。SCLC具有生长迅速、侵袭力强等特点,虽然发病率相对于非小细胞肺癌(non-small cell lung cancer,NSCLC)较低,但其预后极差,病死率较高,因而得到了人们的普遍重视。以往研究发现,几乎所有的广泛期SCLC患者在一线化疗后都会出现复发[3]。虽然既往国内一些研究也对复发性SCLC的后线治疗做出过一些探讨总结,但各种后线治疗总体疗效欠佳[4]。针对复发性SCLC的治疗方案仍没有一个明确的标准,因此寻找一种有效的治疗方案尤为重要。目前紫杉醇是NSCLC的常用一线药物,其疗效已得到普遍认可,但其对SCLC的治疗,国内研究较少。有研究者针对初治的SCLC应用紫杉醇化疗方案,结果显示,其总有效率明显低于以铂类为基础的联合化疗[5]。因此,通常在其他药物无效的前提下才会给予紫杉醇方案。通过前期的一些研究发现,在复发性SCLC患者中应用紫杉醇单药化疗或与其他药物联合化疗已经表现出了一定的疗效[6-8]。本研究分析了白蛋白结合型紫杉醇为基础的化疗方案对SCLC的临床疗效及不良反应,现报道如下。
1 资料与方法
1.1 一般资料
选择2016年1月至2018年3月北京市朝阳区桓兴肿瘤医院(中国医学科学院肿瘤医院桓兴病区)收治的复发性SCLC患者。纳入标准:①经病理检查证实为SCLC,至少接受过标准的一线依托泊苷联合顺铂或依托泊苷联合卡铂方案化疗;②具有可以测量的病灶;③年龄为18~76岁;④美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体力状况评分≤3分;⑤生存期>3个月。排除标准:①具有严重的药物过敏史;②合并心血管疾病、未能控制的高血压或严重的肝肾功能异常。根据纳入和排除标准,本研究共纳入25例复发性SCLC患者。25例患者中,男23例,女2例;年龄43~76岁,中位年龄60岁;≤60岁11例,>60岁且≤65岁8例,>65岁且≤70岁3例,>70岁3例;ECOG评分:1分23例,2分1例,3分1例;二线治疗5例,三线治疗9例,四线治疗8例,五线及以上治疗3例。
1.2 治疗方法
所有患者均接受白蛋白结合型紫杉醇治疗,130 mg/m2,第1天和第8天静脉滴注,21天为1个周期,观察并记录化疗期间发生的不良反应。具体化疗方案如下:①白蛋白结合型紫杉醇单药治疗13例(52%);②白蛋白结合型紫杉醇联合其他药物治疗12例(48%),其中白蛋白结合型紫杉醇联合奈达铂双药治疗6例,白蛋白结合型紫杉醇联合抗血管生成药物靶向治疗6例(联合阿帕替尼5例,联合贝伐珠单抗1例)。均按药品说明书指示用药。
1.3 观察指标和评价标准
治疗前对患者进行计算机体层摄影(CT),化疗2个周期后或患者病情进展明显时复查CT评价疗效,依据美国国立癌症研究所实体瘤疗效评价标准(response evaluation criteria in solid tumor,RECIST)[9]对患者进行疗效评价,分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)、疾病进展(progressive disease,PD)。客观缓解率(objective response rate,ORR)=(CR+PR)例数/总例数×100%,疾病控制率(disease control rate,DCR)=(CR+PR+SD)例数/总例数×100%。依据美国国立癌症研究所不良反应事件通用术语标准(National Cancer Institue-common terminology criteriaforadverse events,NCI-CTC)4.0[10]评价患者化疗期间的不良反应,不良反应分为0~4级。
1.4 随访方法
采用门诊及电话方式进行随访,随访截止时间为2019年3月。25例患者无失访,随访率为100%,中位随访时间为5.6个月。统计患者的无进展生存期(progression-free survival,PFS)。PFS是指患者从首次用药至PD或任何原因死亡的时间(以发生在先的事件计算)。
1.5 统计学方法
采用SPSS 22.0软件对数据进行统计分析,计数资料以例数和率(%)表示,组间比较采用Fisher确切概率法。以P<0.05为差异有统计学意义。
2 结果
2.1 疗效分析
25例患者共完成78个周期的化疗,化疗周期数为1~7个。其中,5例(20%)患者只完成1个周期化疗,20例(80%)患者完成2个及以上周期化疗,中位化疗周期数为3。25例患者均可评价疗效,其中,CR患者0例,PR患者6例(24%),SD患者6例(24%),PD患者13例(52%)。化疗后,患者的ORR为24%(6/25),DCR为48%(12/25),其中白蛋白结合型紫杉醇单药治疗患者的DCR为46.2%(6/13),与白蛋白结合型紫杉醇联合其他药物治疗患者的50.0%(6/12)比较,差异无统计学意义(P>0.05)。白蛋白结合型紫杉醇联合奈达铂双药治疗的6例患者中,PR和SD患者共3例,PD患者3例,DCR为50%(3/6)。随访至2019年3月,共有12例患者存活,13例患者死亡,中位PFS为5.4个月。
2.2 不同临床特征SCLC患者疗效的比较
不同性别、年龄、治疗线数、化疗周期数、用药方案及ECOG评分的SCLC患者的ORR和DCR比较,差异均无统计学意义(P>0.05)。(表1)

表1 不同临床特征SCLC患者的临床疗效( n=25)
2.3 不良反应发生情况
25例复发性SCLC患者中,23例(92%)患者出现了不良反应,所有患者均未因不良反应中断治疗且无治疗相关死亡的发生。患者的不良反应主要以骨髓抑制、脱发、外周神经毒性、胃肠道反应、肌肉关节疼痛、乏力为主。骨髓抑制主要表现为白细胞减少(16例)、中性粒细胞减少(15例)及血红蛋白减少(9例)。其中1级骨髓抑制患者5例,2级骨髓抑制患者8例,3级骨髓抑制患者3例,4级骨髓抑制患者2例,所有患者经粒细胞集落刺激因子治疗后均好转。外周神经毒性主要表现为手足末端麻木,胃肠道反应主要表现为恶心呕吐及腹泻。患者的不良反应以1~2级为主,所有患者均对白蛋白结合型紫杉醇为基础的化疗方案整体耐受性良好且不良反应可控制,治疗过程中也无过敏反应的发生。(表2)
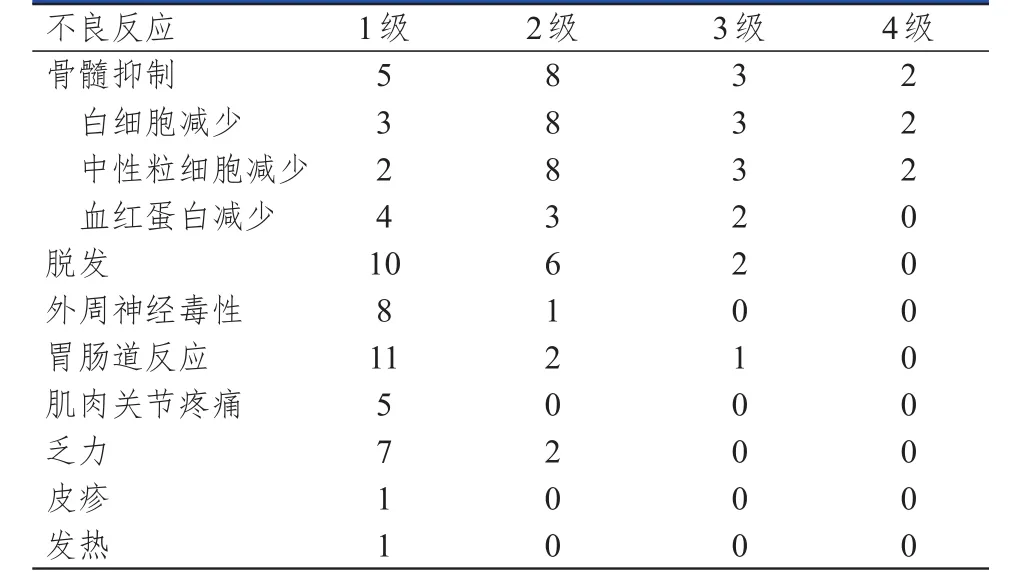
表2 25例SCLC患者化疗后的不良反应发生情况
2.4 不同临床特征SCLC患者不良反应发生情况的比较
不同性别、年龄、治疗线数的SCLC患者的各种不良反应的发生率比较,差异均无统计学意义(P>0.05)。化疗周期数为1的SCLC患者白细胞减少和中性粒细胞减少的发生率均为20.0%,分别低于化疗周期数≥2患者的75.0%和70.0%,差异均有统计学意义(P<0.05)。单独用药SCLC患者乏力的发生率为15.4%,低于联合用药患者的58.3%,差异有统计学意义(P<0.05)。ECOG评分<2分的SCLC患者肌肉关节疼痛的发生率为13.0%,低于ECOG评分≥2分患者的100%,差异有统计学意义(P<0.05)。不同化疗周期数、用药方案、ECOG评分的SCLC患者的其他不良反应发生率比较,差异均无统计学意义(P>0.05)。(表3)
3 讨论
本研究观察了白蛋白结合型紫杉醇为基础的化疗方案对复发性SCLC的疗效和不良反应,结果显示ORR为24%,DCR为48%,中位PFS为5.4个月。总体来说,白蛋白结合型紫杉醇为基础的化疗方案在SCLC患者中表现出了较好的临床疗效及较轻的不良反应。其中白蛋白结合型紫杉醇单药治疗患者的DCR为46.2%(6/13),与白蛋白结合型紫杉醇联合其他药物治疗患者的50.0%(6/12)比较,差异无统计学意义(P>0.05),但考虑到本研究的样本量较小,结果可能存在偏倚。
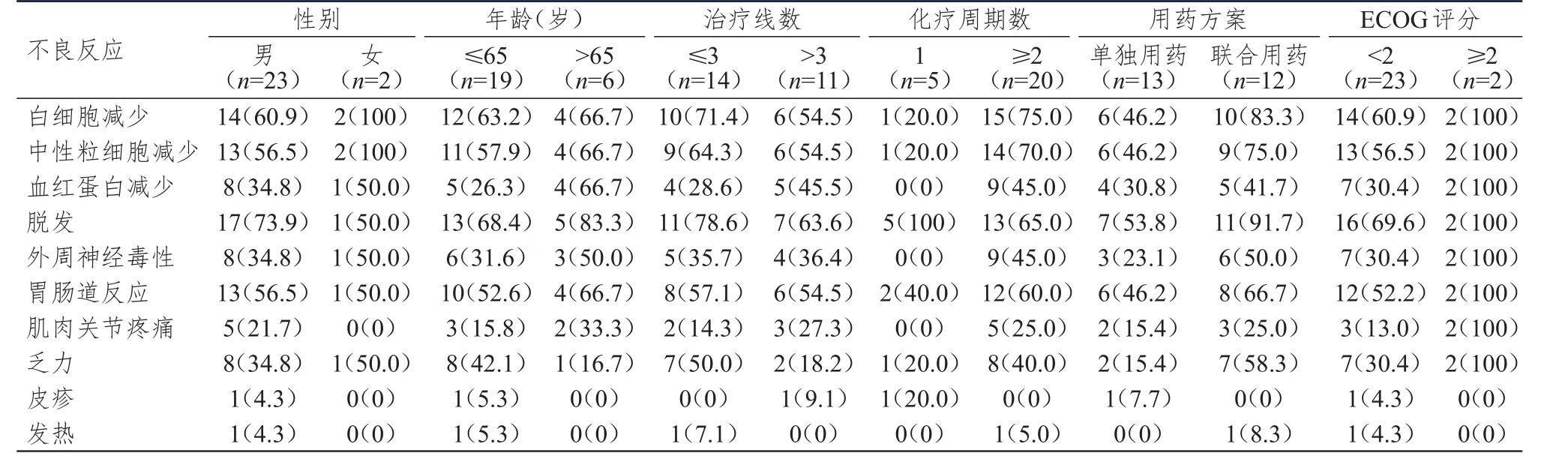
表3 不同临床特征SCLC患者不良反应发生情况的比较[ n=25, n(%)]
研究表明,化疗仍是SCLC首选的治疗方案[11]。依托泊苷与铂类双药联合治疗SCLC的ORR可达60%~80%[12]。研究表明,伊立替康作为SCLC的一线用药也可取得良好的疗效[13]。但针对SCLC一线化疗后复发的治疗方案仍没有一个明确的标准,近几年的研究多集中于细胞毒性药物、靶向药物及免疫抑制剂3种药物,且疗效并不确定[14],而拓扑替康作为目前唯一一个获得美国和欧盟批准的用于敏感复发性SCLC二线治疗药物的疗效远低于期望值。一项关于拓扑替康的研究纳入了6项临床试验共631例患者,其中包括74%的敏感型复发患者和26%的难治性复发患者,结果显示,拓扑替康治疗后患者的总有效率为16.4%,其中敏感型复发患者的有效率为21.0%,难治性复发患者的有效率为4.6%[15]。在另一项纳入637例SCLC患者的研究中,拓扑替康治疗后患者的有效率为16.9%[16]。这些研究均表明拓扑替康虽然是全球公认的复发性SCLC的标准用药,但其带来的生存获益有限。氨柔比星是一种新型蒽环类嵌入式拓扑异构酶Ⅱ抑制剂,有许多研究显示其对复发性SCLC具有一定的疗效。Inoue等[17]对59例符合条件的SCLC患者应用氨柔比星或拓扑替康进行治疗,其中包括36例敏感型复发患者和23例难治性复发患者,结果发现,氨柔比星组患者的总有效率达到38%,而拓扑替康组患者的总有效率为13%,提示氨柔比星治疗SCLC的效果可能优于拓扑替康。但随后在难治性SCLC患者中的细分对比研究结果显示,氨柔比星组患者的缓解率(response rate,RR)、中位PFS及中位生存期(median survival time,MST)分别为16.9%、3.5个月、7.8个月,拓扑替康组患者的RR、中位PFS及MST分别为31.1%、4.1个月、7.5个月。就MST而言,拓扑替康略有劣势,但总体来说,该试验再次证实了拓扑替康治疗难治性SCLC的优越性。然而在一些欧美国家的临床研究及Meta分析中发现,氨柔比星似乎在日本人群中的有效率高于欧美国家人群,因此其使用还受到诸多限制[16,18]。还有一些临床研究提供了很多其他的治疗思路,例如有研究报道伊立替康与顺铂、依托泊苷[19]或奈达铂[20]等联合用药,以及伊立替康单药的化疗方案[21]均对复发性SCLC具有良好的作用。
本研究使用的白蛋白结合型紫杉醇与上述方案的疗效大致相当,或优于上述方案,且本研究中三线以上治疗的患者中仍有2例被评价为PR,表明患者在多药耐药的情况下,仍然对白蛋白结合型紫杉醇保持着一定的敏感性。Ramalingam等[22]应用以紫杉醇为基础联合伊立替康治疗的二联方案对51例复发性SCLC进行治疗,结果发现总有效率为21%,其中敏感型复发患者的有效率为25%,难治性复发患者的有效率为14%,17例患者发生3级以上不良反应。该研究结果与本研究大致相当,但本研究使用的白蛋白结合型紫杉醇相较于紫杉醇更具优势,其原因在于白蛋白结合型紫杉醇在制备过程中通过高压振动技术将紫杉醇与人血白蛋白制成平均直径为130 nm的颗粒[23],相较于用聚氧乙烯蓖麻油或乙醇作为溶剂的紫杉醇的变态反应发生率低[24],且不会由于溶剂在血液中形成胶束而影响紫杉醇的释放,这可能也是影响紫杉醇疗效的因素之一。本研究结果显示,白蛋白结合型紫杉醇作用于复发性SCLC的耐受性良好,不良反应较轻,其中最严重的骨髓抑制为骨髓抑制,5例(20%)患者发生3级及以上骨髓抑制,但经升白细胞治疗后症状均有所改善。非骨髓抑制的不良反应主要包括脱发、外周神经毒性、胃肠道反应、肌肉关节疼痛、乏力、皮疹以及发热等。此外,其中脱发的发生率较高,达到72%(18/25),但治疗停止后头发可以恢复生长,不影响化疗的进行。除1例患者发生3级肠道反应外,其余不良反应均在3级以下,经对症治疗后均好转。值得注意的是,本研究中,ECOG评分<2分的SCLC患者肌肉关节疼痛的发生率低于ECOG评分≥2分的患者,单独用药的SCLC患者乏力的发生率低于联合用药的患者,化疗周期数为1的患者白细胞减少和中性粒细胞减少的发生率均低于化疗周期数≥2的患者,差异均有统计学意义(P<0.05)。因此,在临床应用时需多加注意,必要时根据个人情况对治疗方案及时进行调整。本研究中不良反应的发生情况也与其他以紫杉醇为基础的针对复发性SCLC的临床研究结果相符[6,25-26],证明白蛋白结合型紫杉醇的不良反应发生率较低,安全性良好。
综上所述,白蛋白结合型紫杉醇为基础的化疗方案治疗复发性SCLC显示出了较好的疗效,同时不良反应相对较轻,患者耐受性良好。同时,本研究也存在一些不足,主要在于纳入病例数相对较少,观察对象中联合用药方案以及性别等基本因素存在不均衡的情况,因此对于临床疗效的判定及不良反应的评估存在一定的局限性,对最终呈现出的结果有一定的影响。如果能在今后的研究中进一步扩大样本量,同时将敏感型复发与难治性复发SCLC患者进行分组研究,可能会使研究结果更具有说服力,提供更全面、详实的数据。尽管存在一些不足,但本研究的结果仍然为复发性SCLC患者的临床用药选择提供了新的思路。通过后续的进一步临床研究和观察,完善相关数据,甚至可能改写白蛋白结合型紫杉醇在复发性SCLC治疗中的地位。
